rTEV蛋白酶使用说明
- 格式:pdf
- 大小:63.64 KB
- 文档页数:2

一、tev蛋白酶的简介tev蛋白酶是一种用于原核生物和真核生物中表达的重要酶。
它可以识别并切割蛋白质中的特定的肽键,因此在生物学和生物技术领域中有着广泛的应用。
tev蛋白酶最初是从土壤杆菌中分离出来的,后来被发现在其他细菌、酵母及植物中也存在相似的酶,因此被广泛应用于不同生物系统的蛋白表达和研究中。
二、tev蛋白酶的序列特点tev蛋白酶的序列长度较短,一般为了250-300个氨基酸。
其氨基酸序列中含有一个特定的切割位点,通常为Glu-Asn-Leu-Tyr-Phe-Gln-Gly。
tev蛋白酶的体系结构和机理已经在许多研究中得到了详细的解析,其活性部位和底物结合方式也被广泛研究和应用。
三、tev蛋白酶在蛋白工程中的应用由于其特异性和高效性,tev蛋白酶在蛋白工程中得到了广泛的应用。
研究人员可以利用tev蛋白酶来切割和纯化重组蛋白,其切割位点的特异性意味着可以在融合蛋白中特异性地切割并释放目标蛋白。
tev蛋白酶也可以被用于蛋白结晶和其他生物技术领域。
四、tev蛋白酶在基因编辑和细胞工程中的应用tev蛋白酶也被广泛应用于基因编辑和细胞工程领域。
在CRISPR/Cas9系统中,tev蛋白酶常被用于切割Cas9蛋白和它的融合蛋白,并在基因编辑过程中发挥重要作用。
在细胞工程领域,tev蛋白酶也可以用于蛋白标记和追踪等研究中。
五、tev蛋白酶的研究进展和展望随着生物技术领域的发展,tev蛋白酶的研究也在不断深入。
研究人员不断寻求提高tev蛋白酶的特异性和活性,以满足不断增长的生物技术需求。
tev蛋白酶的结构和机理解析也将为其在生物医学和药物研发中的应用提供更多可能性。
六、结论tev蛋白酶作为一种重要的蛋白酶,在生物技术和生物医学领域有着广泛的应用前景。
研究人员将继续努力深入 tev蛋白酶的研究,不断推动其在蛋白工程、基因编辑和细胞工程中的应用,为生物技术和生物医学领域的发展贡献更多力量。
七、tev蛋白酶在药物研发中的应用除了在蛋白工程和基因编辑领域的应用外,tev蛋白酶还在药物研发中发挥着重要的作用。
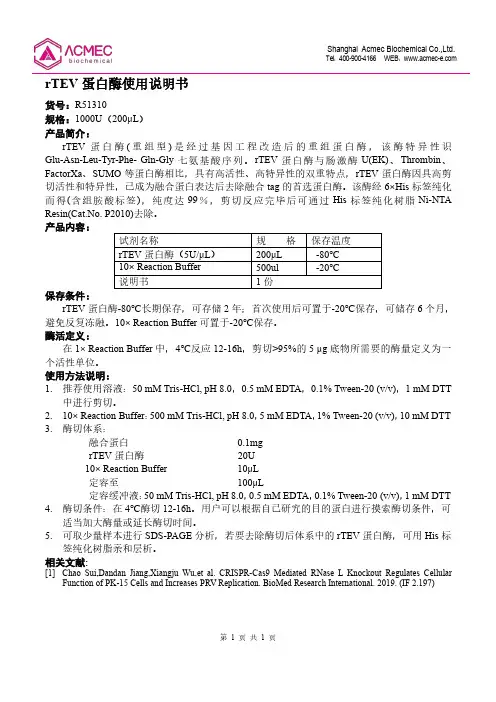
第1页共1页rTEV 蛋白酶使用说明书货号:R51310规格:1000U (200μL )产品简介:rTEV 蛋白酶(重组型)是经过基因工程改造后的重组蛋白酶,该酶特异性识Glu-Asn-Leu-Tyr-Phe-Gln-Gly 七氨基酸序列。
rTEV 蛋白酶与肠激酶U(EK)、Thrombin 、FactorXa 、SUMO 等蛋白酶相比,具有高活性、高特异性的双重特点,rTEV 蛋白酶因具高剪切活性和特异性,已成为融合蛋白表达后去除融合tag 的首选蛋白酶。
该酶经6×His 标签纯化而得(含组胺酸标签),纯度达99%,剪切反应完毕后可通过His 标签纯化树脂Ni-NTA Resin(Cat.No.P2010)去除。
产品内容:试剂名称规格保存温度rTEV 蛋白酶(5U/μL )200μL -80℃10×Reaction Buffer 500ul -20℃说明书1份保存条件:rTEV 蛋白酶-80℃长期保存,可存储2年;首次使用后可置于-20℃保存,可储存6个月,避免反复冻融。
10×Reaction Buffer 可置于-20℃保存。
酶活定义:在1×Reaction Buffer 中,4℃反应12-16h ,剪切>95%的5μg 底物所需要的酶量定义为一个活性单位。
使用方法说明:1.推荐使用溶液:50mM Tris-HCl,pH 8.0,0.5mM EDTA ,0.1%Tween-20(v/v),1mM DTT中进行剪切。
2.10×Reaction Buffer :500mM Tris-HCl,pH 8.0,5mM EDTA ,1%Tween-20(v/v),10mM DTT3.酶切体系:融合蛋白0.1mgrTEV 蛋白酶20U 10×Reaction Buffer 10μL定容至100μL定容缓冲液:50mM Tris-HCl,pH 8.0,0.5mM EDTA ,0.1%Tween-20(v/v),1mM DTT 4.酶切条件:在4℃酶切12-16h 。

tev蛋白酶切位点的dna序列
Tev蛋白酶切位点的DNA序列是指Tev蛋白酶可以识别并切割的DNA序列,也被称为Tev切割位点。
Tev蛋白酶是一种常用的内切酶,具有高度特异性和高效性。
Tev蛋白酶的切割位点为5'-G|TATAC-3',其中“|”所示的位置为切割位点。
因此,Tev蛋白酶切割位点的DNA序列为5'-GTTAAC-3'。
Tev蛋白酶的切割位点的序列具有较高的特异性和保守性,因此在进行基因克隆和重组DNA技术时,Tev蛋白酶切割位点的选择非常重要。
在进行DNA片段连接时,通过在DNA的末端引入Tev蛋白酶切割位点,可以使用Tev蛋白酶将DNA 片段剪切开,并通过该切口将不同的DNA片段连接起来。
需要注意的是,Tev蛋白酶切割位点的DNA序列只是其中一种常用的切割位点序列,不同种类的内切酶所识别的切割位点序列也是不同的。
因此,在进行基因克隆和重组DNA技术时,需要选择适合特定目的的内切酶切割位点序列。

分子伴侣表达载体构建及TEV蛋白酶突变体的功能分析的开题报告1. 研究背景分子伴侣是指在细胞内负责帮助蛋白质正确折叠的一类蛋白质。
在生物体内,蛋白质折叠过程中常常会出现一些问题,如果不及时解决,就会导致蛋白质无法正常工作,造成一些严重的疾病。
因此,对分子伴侣的研究具有非常重要的意义。
TEV蛋白酶是一种广泛应用于蛋白质表达和纯化的酶。
通过将TEV蛋白酶识别的酶切位点插入到目标蛋白质的表达载体中,可以用TEV蛋白酶特异性地切割并分离目标蛋白质,提高目标蛋白质的纯度和产量。
因此,对TEV蛋白酶的研究也具有很大的实际意义。
2. 研究目的本项目旨在构建分子伴侣表达载体及TEV蛋白酶突变体,通过功能分析研究两者在蛋白质折叠和分离纯化过程中的作用和机制,为深入研究分子伴侣和TEV蛋白酶的生物学功能提供理论基础和技术手段。
3. 研究内容和方法3.1 分子伴侣表达载体构建本项目将选用pET-28a等广泛应用的质粒作为载体,构建分子伴侣表达载体。
首先,从Escherichia coli MG1655中扩增出chaperonin GroEL和GroES的基因片段,然后将其与载体的多克隆克隆位点连接,形成重组蛋白表达载体。
利用蛋白质表达、纯化和Western blot等技术检测载体构建的成功程度。
3.2 TEV蛋白酶突变体构建和功能分析本项目将构建TEV蛋白酶的突变体,以其对不同的酶切位点的识别和选择性切割能力进行分析。
首先,从原核细胞中扩增出TEV蛋白酶基因片段,并进行突变,形成若干个不同的TEV蛋白酶突变体。
然后,将突变后的TEV蛋白酶与表达载体进行连接,通过蛋白质表达、纯化和Western blot等技术对突变体的识别和选择性切割能力进行分析。
4. 研究意义本项目的研究将对分子伴侣和TEV蛋白酶的生物学功能进行深入研究,为更好地理解细胞内蛋白质折叠和纯化机制提供理论基础和技术手段。
此外,通过构建分子伴侣表达载体和TEV蛋白酶突变体,并对其功能进行分析,可以为生物医药工业领域的蛋白质表达和纯化等方面提供有效手段和技术支持。
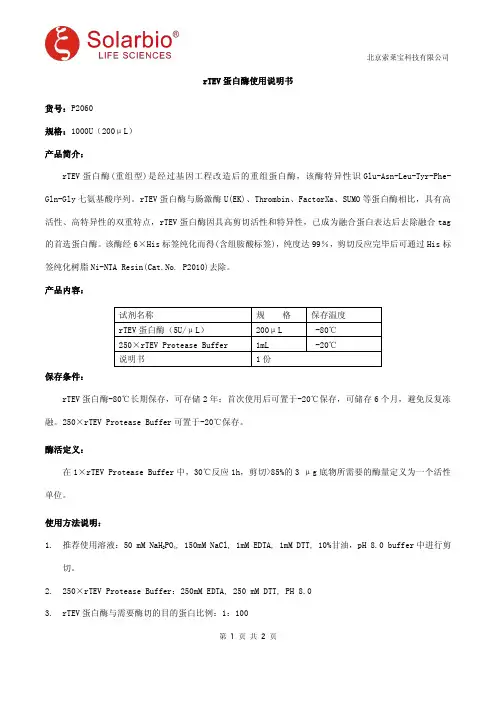
rTEV 蛋白酶使用说明书货号:P2060规格:1000U(200μL)产品简介:rTEV 蛋白酶(重组型)是经过基因工程改造后的重组蛋白酶,该酶特异性识Glu-Asn-Leu-Tyr-Phe-Gln-Gly 七氨基酸序列。
rTEV 蛋白酶与肠激酶U(EK)、Thrombin、FactorXa、SUMO 等蛋白酶相比,具有高活性、高特异性的双重特点,rTEV 蛋白酶因具高剪切活性和特异性,已成为融合蛋白表达后去除融合tag 的首选蛋白酶。
该酶经6×His 标签纯化而得(含组胺酸标签),纯度达99%,剪切反应完毕后可通过His 标签纯化树脂Ni-NTA Resin(Cat.No.P2010)去除。
产品内容:试剂名称规格保存温度rTEV 蛋白酶(5U/μL)200μL -80℃250×rTEV Protease Buffer1mL -20℃说明书1份保存条件:rTEV 蛋白酶-80℃长期保存,可存储2年;首次使用后可置于-20℃保存,可储存6个月,避免反复冻融。
250×rTEV Protease Buffer 可置于-20℃保存。
酶活定义:在1×rTEV Protease Buffer 中,30℃反应1h,剪切>85%的3μg 底物所需要的酶量定义为一个活性单位。
使用方法说明:1.推荐使用溶液:50mM NaH 2PO 4,150mM NaCl,1mM EDTA,1mM DTT,10%甘油,pH 8.0buffer 中进行剪切。
2.250×rTEV Protease Buffer:250mM EDTA,250mM DTT,PH 8.03.rTEV 蛋白酶与需要酶切的目的蛋白比例:1:1004.酶切体系:融合蛋白1000μg 250×rTEV Protease Buffer4μL rTEV 蛋白酶2μL 定容至1000μL定容缓冲液:50mM NaH 2PO 4,150mM NaCl5.酶切条件:在16℃酶切6hr。

TEV Protease产品概述TEV Protease (烟草蚀纹病毒蛋白酶;Tobacco etch virus protease) 是来源于烟草蚀纹病毒(TEV) Nla的重组蛋白酶,此蛋白酶被用来切除纯化后融合蛋白的亲和标签。
TEV蛋白酶具有很强的位点特异性,能够识别EXXYXQ(G/S)的七氨基酸序列(Glu-Asn-Leu- Tyr-Phe- Gln-Gly),最普通的是ENLYFQG,其切割位点在谷氨酰胺和甘氨酸或丝氨酸之间。
该酶在PH 5.5-8.5和4-30℃的广泛范围内皆有活性,使得反应条件的选择可根据目的蛋白的情况而修改。
该酶带有His-sumo Tag经6×His标签纯化,剪切反应完毕后可通过Ni-NTA (产品货号:PAN001)去除。
本蛋白酶来源于大肠杆菌重组表达。
酶活性单位定义在1X TEV Buffer (50 mM Tris-HCl, pH8.0, 0.5 mMEDTA, 1mM DTT) 中,30℃条件下反应 1 小时,能够切割3 µg 的反应底物达 85%以上所需的酶量定义为一个活性单位。
产品溶液组分推荐反应体系不同温度下的参考反应时间:1.4℃反应 16 小时2.20℃反应 6 小时3.30℃反应 2 小时活性测试待测融合蛋白100µg,加入TEV protease 2µl,4℃反应 16 小时,取酶切前后样品SDS-PAGE检测,如右图所示 >90% 融合蛋白被切割。
储存条件长期储存于-80℃,可保存 2 年;或小量分装后保存于-20℃,可保存6 个月,避免反复冻融。
10X TEV Buffer 置于-20℃保存。
包装规格货号规格RPP002-100 100 URPP002-500 500 URPP002-2000 2000 U。

Bac-to-Bac杆状病毒表达系统试剂盒内容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方式产生重组杆状病毒。
此方式基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统要紧包括:*pFastBac捐献质粒的选择,它要能够产生包括目的位点的表达结构,那个目的基因的产生被杆状病毒特意位点启动子操纵。
*一个Ecoli宿主,DH10Bac,包括杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后能够产生重组杆粒。
*一个操纵表达的质粒,包括Gus和/或CAT基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优势:利用那个系统产生重组杆状病毒较传统的同源重组有以下优势:*与利用同源重组产生重组杆状病毒所需的4-6周相较,分辨纯化重组病毒少于两周*减少了从斑点挑选重组病毒DNA所包括亲缘和非重组病毒的概率*能够快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):大量的pFastBac菌体都适于进行Bac-to-Bac表达系统。
选择关于你的需要最适合的菌体。
指南用途:指南提供了一个关于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,利用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮忙你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他能够帮忙你很容易的产生杆状病毒表达你的重组蛋白,可是利用这系统更偏向于有杆状病毒生物学和昆虫表达背景的利用者。

AbstractTobacco etch virus protease (TEVp) is widely utilized for cleavage the fusion tags owing to its stringent sequence specificity. Previously, we constructed the TEVp5M codon variant with increased yield but decreased specific activity. To further improve protein folding and increase the protein expression level of the TEVp,we combined different approaches to obtain new TEV protease with high yield and activity. Cleavage of different fusions absorbed with the corresponding resin using the constructed fusion protein.The results are as follows:1.Three variants were constructed. Based on the TEVp5M codon variant, we created three variants with mutations of K45F, E106G and K45F/E106G.2.Expression level and activity of TEVp variants were investigated. Qualitative analysis of TEVp variants in soluble were determined by SDS-PAGE and quantitative analysis of TEVp variants in soluble showed that as comparison to the TEVp5M codon variant, soluble yield of E106G variant in E. coli BL21(DE3) was increased by 28% , contrary to that of other two variants K45F and K45F/E106G by GFP fluorescence intensities.Qualitative and quantitative analysis of the purified fusion protein H6GST-tevS-eDAL as a TEVp substrate showed that activity of E106G variant on cleaving the designed protein substrate was raised by 32%. Other two variants including K45F and K45F/E106G were less active than the TEVp5M codon variant.3.Five TEVpE105G fusion proteins were constructed. We chose four protein tags including GroEL, GroES, DnaK and MBP to fuse with the E106G variant at N-terminus respectively. The TEVp recognition sequences is placed at the fusion junction of the fused tag and target protein. InfB(1–21) sequence is directly attached to the TEVp5M E106G variant.4.Expression level and activity of TEVp mutant in fusion protein were assessed. DnaK and MBP effectively enhanced soluble production of the TEVp construct and InfB (1–21) sequence decreased solubility of the protein than the His6-tag in E. Coli BL21(DE3) but GroEL and MBP significantly increased the activity of TEVp mutant.5.Supplying rare tRNAs on function of the fusion tag was examined.In E. coli strain Rosetta TM(DE3), InfB(1–21) sequence and MBP effectively enhanced soluble production of the TEVp. InfB(1–21) sequence and GroEL increased highest cleavage activity of TEVp mutant.6. Effect of the TEVp recognition sequences on fusion protein was analyzed.The tevS in the fusion protein MBP-tevS-TEVp-H6 was deleted to generate the fusion MBP-TEVp-H6.We found that deletion of the tevS did not affect soluble expression levels in two in E. coli strains correspondingly but significantly enhanced the activity in the Rosetta TM(DE3).7.Mutant protein with different fusion tag were purified respectively. We analyzed purification and specific activity of different TEVp constructs and determined efficiency of on-resin cleavage of the five fusion proteins.In conclusion, we confirmed that further amino acid mutations in improving protease soluble were influenced by other mutations. Certain fusion tags on improving protein production and quality is dependent with rare tRNAs abundance. In E. coli strain Rosetta TM(DE3),We first identified that GroES faintly increased protein solubility of the TEVp.The current research shows that the strain selection is important for optimization of the fusion tags. Even with assistance of the fusion tag, desirable production and quality of TEVp construct are not combined in the purified TEVp constructs.The constructed fusion protein of TEVp mutant for on-resin cleavage of partial fusion proteins made certain target proteins purified in single step.Key words:Tobacco etch virus protease,mutation,fusion tags,activity,Escherichia coli目录摘要 ................................................................................................................................ I Abstract ........................................................................................................................ III 目录 .............................................................................................................................. V 1 文献综述 . (1)1.1 蛋白重组及融合标签的应用 (1)1.2 TEV蛋白酶及其突变体研究 (2)1.3 大肠杆菌中tRNA丰度对表达外源蛋白影响的研究 (3)1.4 融合蛋白的亲和柱上酶切研究 (4)2 引言 (5)2.1 研究目的和意义 (5)2.2 研究内容 (5)3 材料与方法 (6)3.1 材料 (6)3.1.1 菌株和质粒 (6)3.1.2 试剂 (6)3.1.3 仪器和设备 (6)3.1.4 部分缓冲液的配制 (6)3.1.5 本研究中所需要的引物 (7)3.2 方法 (8)3.2.1 载体构建的相关反应体系 (8)3.2.2 构建烟草蚀斑病毒蛋白酶突变体K45F、E106G和K45F/E106G .. 93.2.3 构建带不同标签的E106G融合表达载体 (9)3.2.4 用于柱上酶切5种融合蛋白底物表达载体的构建 (11)3.2.5 不同TEVp突变体的表达分析 (11)3.2.6 GFP荧光强度检测不同TEVp突变体水溶性表达 (12)3.2.7 不同TEVp突变体的活性分析 (12)3.2.8 带不同标签的E106G融合蛋白的表达及活性分析 (13)3.2.9 融合蛋白的诱导表达纯化及产量测定 (13)3.2.10 纯化的TEVp活性分析 (14)3.2.11 MBP-E106G-H6用于融合蛋白的亲和柱上酶切效率分析 (14)4 结果与分析 (15)4.1 载体构建 (15)4.2 定性定量分析不同TEVp突变体的表达 (16)4.3 定性定量分析不同TEVp突变体的活性 (17)4.4 分析不同标签对E106G蛋白酶表达及活性影响 (17)4.5 分析提高胞内稀有tRNA水平对标签效应的影响 (18)4.6 分析融合蛋白中TEVp识别序列的作用 (19)4.7 带不同标签的E106G产量和活性的分析 (20)4.8 MBP-E106G-H6作为工具酶用于融合蛋白的亲和柱上酶切效率分析 (21)4.8.1 H6GST-tevS-mPrx融合蛋白的亲和柱上酶切 (22)4.8.2 H6GST-tevS-sDAL融合蛋白的亲和柱上酶切 (22)4.8.3 MBP-tevS-eDAL融合蛋白的亲和柱上酶切 (23)4.8.4 H6GST-tevS-mSrx融合蛋白的亲和柱上酶切 (24)4.8.5 GST-tevS-mSR融合蛋白的亲和柱上酶切 (25)5 讨论 (27)5.1 不同TEVp突变体水溶性及活性研究 (27)5.2 不同标签对TEVp表达及活性影响研究 (27)5.3 TEV蛋白酶作为工具酶用于融合蛋白亲和柱上酶切研究 (28)结论 (30)参考文献 (31)致谢 (39)个人简介 (40)1文献综述1.1 蛋白重组及融合标签的应用目前,蛋白重组技术是蛋白质结构和功能研究的重要方法,将目的基因克隆到表达载体并在宿主细胞中生产重组蛋白质[1-7]。

粗糙脉孢菌蛋白表达系统构建研究高染染;刘倩;孙文良;孙志勇;刘浩;田朝光【摘要】旨在将模式丝状真菌粗糙脉孢菌(Neurospora crassa)构建为蛋白质表达系统。
通过真菌杂交技术构建出粗糙脉孢菌六突变缺失菌株 LQ-1(Δ3βG∷Δ2cbh∷Δhis3)作为蛋白表达宿主菌株。
该宿主菌株可以用纤维二糖作为诱导物诱导纤维素酶启动子表达,同时又消除了葡萄糖苷酶蛋白的背景条带,有利于目标蛋白表达纯化。
构建了分别含有粗糙脉孢菌自身强启动子(Pcbh-1、Pcbh-2和 Ptef-1)的3个新的高效表达载体,该载体带有融合标签蛋白 tev-6×his-gfp,能高效方便的筛选阳性转化子,有利于后续目标蛋白纯化。
以纤维素酶GH3-4和CBH-1为例,通过重组表达菌株纤维二糖诱导发酵液进行酶活测定、SDS-PAGE 电泳分析和 Western blotting 检测显示,重组蛋白 GH3-4-GFP 和CBH-1-GFP 成功进行了表达和分泌,分泌水平分别为2.77和2.83 mg/L。
Pcbh-1启动子重组蛋白表达水平最高,说明在纤维二糖诱导体系中启动子 Pcbh-1的启动效率最高,初步建立了粗糙脉孢菌纤维二糖诱导的蛋白质表达体系。
%To demonstrate the potential of the model filamentous fungus Neurospora crassa as a recombinant protein expression system, we used fungal hybrid technology to develop a sextuple gene disruptant LQ-1(Δ3βG∷Δ2cbh∷Δhis3)of it a s the host strain of expressing the protein. The cellobiose was used to induce the expression of cellulase promoter in host strain,which removed the background band of glucosaccharase and was conducive to the expression and purification of target protein. We constructed 3 new efficiently-expressed vectors respectively consisting ofits own strong inducible promoters(Pcbh-1,Pcbh-2 and Ptef-1)from N.crassa. Those vectors had fusion tag protein tev-6×his-gfp and efficiently and conveniently screened positive transformants,which was favourable for the purification of later target protein. Two endogenous cellulase(GH3-4 and CBH-1)were chosen as test proteins for recombinant expression. Then enzymatic activity measured by cellobiose-induced fermentation broth of recombinant strain,SDS-PAGE analysis,and Western blotting indicated that the recombinant proteins GH3-4-GFP and CBH-1-GFP were successfully expressed with secreted levels reaching as high as approximate 2.77 and 2.83 mg/L. The expression of recombinant protein with Pcbh-1 promoter was the highest,suggesting that promoting efficiency of Pcbh-1 in the cellobiose-induced system was the highest,and a protein expression system in cellobiose-induced N. crassa was preliminarily constructed.【期刊名称】《生物技术通报》【年(卷),期】2016(032)007【总页数】10页(P160-169)【关键词】丝状真菌;粗糙脉孢菌;蛋白表达系统;纤维二糖;强启动子【作者】高染染;刘倩;孙文良;孙志勇;刘浩;田朝光【作者单位】天津科技大学生物工程学院教育部工业发酵微生物重点实验室,天津 300457; 中国科学院天津工业生物技术研究所系统微生物工程重点实验室,天津 300308;中国科学院天津工业生物技术研究所系统微生物工程重点实验室,天津 300308;中国科学院天津工业生物技术研究所系统微生物工程重点实验室,天津 300308;中国科学院天津工业生物技术研究所系统微生物工程重点实验室,天津 300308;天津科技大学生物工程学院教育部工业发酵微生物重点实验室,天津300457;中国科学院天津工业生物技术研究所系统微生物工程重点实验室,天津300308【正文语种】中文蛋白质生产是生物技术的重要组成部分,主要包括工业酶和蛋白质类药物抗体疫苗等,发展蛋白质表达系统研究拥有重要的战略意义和巨大的市场需求[1,2]。

tev蛋白酶的等电点tev protease全文共四篇示例,供读者参考第一篇示例:Tev蛋白酶是一种常用的蛋白酶,在生物学和生物工程领域具有广泛的应用。
它是一种内切酶,能够特异性地切割蛋白质中的TEV蛋白酶靶位点,从而实现对目标蛋白的高效纯化和定量分析。
在本文中,我们将重点介绍tev蛋白酶的等电点、结构、功能以及应用。
Tev蛋白酶的等电点通常在pH 6.5左右。
这一点对于在实验室中使用tev蛋白酶进行蛋白纯化和裂解是非常重要的,因为只有在适当的pH条件下tev蛋白酶才能发挥最佳的裂解作用。
知道tev蛋白酶的等电点还可以帮助研究人员设计合适的缓冲液和反应条件,以确保蛋白酶的活性和稳定性。
Tev蛋白酶的结构是一个重要的研究对象。
它是一种酶,由TEV (Tobacco Etch Virus,烟草切花病毒)编码的酶所产生。
Tev蛋白酶的结构由一个N端结构域和一个C端结构域组成,其中N端结构域包含了活性位点和底物结合区,C端结构域则负责底物的识别和结合。
这种结构使得tev蛋白酶能够与底物特异性地结合,并对其进行裂解。
Tev蛋白酶的功能非常多样化。
它在生物学研究中常用于对蛋白质进行定量分析和纯化,因为其具有高度特异性和高效率。
tev蛋白酶还可以作为蛋白重组工程中的工具,用于对融合蛋白进行裂解,从而得到目标蛋白。
在基因工程领域,tev蛋白酶还可以实现对载体中目标基因的定位突变或删除,从而实现特定基因的表达和功能研究。
第二篇示例:Tev蛋白酶(Tobacco Etch Virus Protease,简称Tev protease)是一种常用于蛋白质纯化及蛋白质工程中的重要酶类。
Tev蛋白酶的等电点(tev protease isoelectric point)是重要的性质之一,对其在实验室中的应用起着重要的作用。
Tev蛋白酶的等电点是指该酶在电动力学中的电荷中立点,也就是在pH 值下,蛋白质的带电量等于零的pH 值。

tev蛋白酶的等电点tev protease-概述说明以及解释1.引言1.1 概述在文章中,我将介绍tev蛋白酶的等电点这一重要概念。
tev蛋白酶是一种常用的蛋白酶,广泛应用于蛋白质工程和生物化学领域。
了解其等电点对其功能和稳定性至关重要。
本文旨在探讨tev蛋白酶的等电点及其在生物学上的意义。
通过深入研究tev蛋白酶的等电点,我们可以更好地理解其在蛋白水解中的作用机制,为相关研究和应用提供理论支持。
文章结构部分内容如下:1.2 文章结构本文主要分为引言、正文和结论三个部分。
在引言部分,将对tev蛋白酶进行概述,并介绍文章的结构和目的。
在正文部分,将详细讨论tev 蛋白酶的功能、结构和等电点。
在结论部分,将总结tev蛋白酶的重要性,探讨其等电点对功能的影响,并展望其在未来研究中的发展方向。
整体结构清晰,逻辑性强,旨在全面探讨tev蛋白酶及其等电点的相关内容。
1.3 目的:本文旨在探讨tev蛋白酶的等电点,以深入了解其在生物体内的作用机制和生物活性。
通过研究tev蛋白酶的等电点,我们可以进一步揭示其在生物化学领域的重要性,为相关领域的研究提供新的思路和方向。
同时,我们还将分析tev蛋白酶等电点对其功能的影响,探讨其在生物过程中的生物学意义。
通过本文的研究,我们可以为未来tev蛋白酶等电点研究的发展提供参考和指导,为生物学和医学领域的进步贡献力量。
2.正文2.1 tev蛋白酶的功能:tev蛋白酶是一种特殊的酶,具有高度的特异性和活性。
其主要功能在于识别特定氨基酸序列,并切断蛋白质链,起到降解蛋白质的作用。
tev 蛋白酶通常用于蛋白质纯化和蛋白质工程的领域。
其高效率和高特异性使其成为研究人员最常用的蛋白酶之一。
除了在实验室中的应用外,tev蛋白酶还在生物工程和医学领域中具有重要意义。
通过利用tev蛋白酶对特定蛋白质的裂解作用,可以实现蛋白质的定向改造和修饰,进而创造出具有特定功能的蛋白质药物或生物材料。
tev蛋白酶的等电点tev protease全文共四篇示例,供读者参考第一篇示例:TEV蛋白酶,全称为核酸酶TEV(tobacco etch virus)蛋白酶,是一种来源于植物烟草的内切酶,广泛应用于生物学和生物技术领域。
TEV蛋白酶是一种特异性内切酶,在裂解蛋白质时特异性切割其底物中的TEV酶切位点,因而被广泛用于表达蛋白纯化过程中的切割步骤。
TEV蛋白酶的等电点在pH 7.0左右。
等电点是指蛋白质在电动力学平衡状态时所处的pH值,即蛋白质净电荷为零的pH值。
在等电点之下,蛋白质呈电中性状态,可以减少其与细胞膜或其他蛋白质之间的相互作用,有利于蛋白质的纯化和稳定性。
TEV蛋白酶的等电点为7.0左右,适用于在中性条件下进行蛋白质的切割和纯化。
TEV蛋白酶的应用范围非常广泛,主要用于表达蛋白纯化过程中的切割步骤。
在表达系统中,通常在目的蛋白质的C端附加一个TEV酶切位点序列,然后利用TEV蛋白酶特异性地切割该位点,将目的蛋白质从其载体或其他杂质中解离出来。
TEV蛋白酶的特异性切割作用能够高效、快速地释放出目的蛋白质,避免了其他非特异性切割酶可能引起的附加处理步骤以及目的蛋白质结构的变化。
除了在表达系统中的应用,TEV蛋白酶还可以用于研究蛋白质的结构和功能。
由于TEV蛋白酶的特异性切割作用,可以精确地选择目的蛋白质中的某个位置进行切割,进而实现对蛋白质结构和功能的研究。
TEV蛋白酶的等电点在中性条件下,能够减少对蛋白质结构的影响,有利于保持目的蛋白质的天然构象。
第二篇示例:Tev蛋白酶,也称为tev蛋白酶,是一种高效的内切蛋白酶,具有特异性裁剪TEV(Tobacco etch virus,烟草切花病毒)蛋白的能力。
tev蛋白酶被广泛应用于蛋白质工程和生物化学研究领域,其出色的催化活性和特异性使其成为许多研究人员首选的工具之一。
在本文中,我们将对tev蛋白酶的等电点、结构与功能以及应用进行详细介绍,希望能够对广大科研工作者有所启发。
tev酶切位点氨基酸序列
酶切位点是指在DNA或RNA分子中,特定的核苷酸序列上存在一
种特殊的酶切位点。
这些位点通常由限制性内切酶识别并剪断,从而
产生两个不同长度的DNA片段。
其中,tev(Tobacco Etch Virus)蛋白酶是一种常用的表达标签蛋白裂解酶,在生物技术领域得到广泛应用。
它可以通过对特定氨基酸序列进行水解来将目标蛋白从表达载体中释
放出来。
tev蛋白酶作为一种高效、专一性强且易于操作的裂解剂,在
许多实验室和工业化生产中被广泛使用。
其典型的靶向氨基酸序列为ENLYFQ/S(S/T),其中“/”表示可变位置。
以下是几个常见的tev靶
向氨基酸序列:1. ENLYFQS
2. ENLYFQG
3. ENLYFQA
4. ENLYYQS此外,还有其他类似于tev靶向氨基酸序列的裂解剂,如HRV 3C、PreScission等。
这些裂解剂都具有自身独特的优缺点,并根
据需要选择合适数量和类型以满足实验要求。
总之,在分子生物学和
生物技术领域中,了解各种重要功能元件及其相互作用关系非常重要。
只有深入理解这些概念才能更好地设计和执行相关实验,并取得预期
结果。
HIV蛋白酶可溶性粉
主要成分:利托那韦(RTV)、鞣酸蛋白、进口佐剂。
性状:白色或淡黄色超细粉末。
适应症:主要用于猪的气喘病、传染性胸膜肺炎、乳房炎、猪附红细胞体病、猪红、黄白痢、脑膜炎、病毒性腹泻、肠道感染和产后综合症。
用法用量:治疗量一次量本品50g/瓶拌料250kg,饮水500kg.每天一次,连用2-3天,重症加倍。
规格:50g:利托那韦>=15g
贮存:避光2-8℃,有效期2年。
南京晶鑫生物科技有限公司是一家集研发、生产、销售及服务于一体的省级高新技术产业单位,主要产品有禽用生物制剂、禽用转移因子、禽用干扰素。
晶鑫生物: 整理
中国禽病网。
rTEV蛋白酶说明书
本产品仅供体外研究使用,不得用于临床诊断
描述:
是经过基因工程改造后的重组蛋白酶,它可特异性识别Glu-Asn- Leu-Tyr -Phe-Gln-Gly七氨基酸序列,并高特异性、高活性剪切(剪切位点在Gln-Gly之间)。
TEV蛋白酶经6XHis标签纯化而得(含组胺酸标签),纯度达99%,剪切反应完毕后可通过Ni-NTA Resin去除。
TEV 酶在4℃-30℃温度、pH范围(6.0-8.5)反应条件下均具有活性(见下表)。
活性定义:在1×rTEV Buffer(50 mM,pH8.0, 0.5 mM EDTA,1mM DTT),30℃反应1h,剪切>85%的 3 μg 底物所需要的酶量定义为一个活性单位。
应用:融合蛋白标签剪切去除。
储存:长期储存-70℃,可储存 2 年,-20℃可储存 6 个月。
操作方法
1. 在 EP 管中配制如下反应体系
2. 30℃孵育,在 1、2、4、6 小时分别吸出 30 μl 上述反应液,置于单独的 EP 管中。
3. 向上述 EP 管中加入 30 μl 2×SDS Loading Buffer,置于-20℃。
4. 样品全部反应完毕后,样品煮沸 5 min,取 40 μl 进行SDS-PAGE 分析。
5. 如融合蛋白要求低温处理,可将反应液置于4℃,请延长反应时间,并增加r TEV 酶用量。
TEV酶是一种常用于生物化学和分子生物学领域的特异性蛋白酶,主要用于切割重组蛋白上的特定序列,从而实现对目标蛋白的纯化和分析。
TEV TEV的活性受盐浓度的影响较大,因此在实验过程中需要仔细控制盐浓度。
通常情况下,TEV TEV的酶切反应是在含有一定浓度的NaCl(氯化钠)的缓冲溶液中进行的。
这个浓度一般介于100 mM到300 mM之间,但具体的最佳浓度可能需要根据目标蛋白的特性和实验的具体需求来优化。
过高的盐浓度可能会抑制TEV 酶的活性,因此建议在酶切过程中控制盐浓度在0.5 M以下。
如果实验条件允许,可以通过逐步降低盐浓度或者使用低盐缓冲液来提高TEV 酶的活性。
在实际应用中,建议查阅最新的研究文献或实验协议,以获取关于TEV 酶的最佳盐浓度和使用条件的详细信息。
同时,实验过程中应密切观察酶切反应的进展,并根据需要调整盐浓度,以确保获得最佳的酶切效果。
TEV酶的研究成果与社会发展
TEV酶社会发展
TEV蛋白酶(tobacco etch virus protease)是烟草蚀斑病毒编码的NIa蛋白中27 KD的催化区域。
由于它能特异性识别含有6个氨基酸(ENLYFQ)特定序列的蛋白,并进行酶切,酶切活性较高,且酶切的条件具有宽容性。
因此TEV酶在重组蛋白领域中应用广泛。
TEV酶研究过程与成果
本实验室依据大肠杆菌偏爱密码子和TEV的基因序列,通过重叠PCR的方法成功克隆了TEV基因。
目前对TEV酶的研究主要集中在通过不同的方法提高TEV酶的表达量、精确的活性分析以及对TEV酶进行固定化,其中对于TEV酶的活性检测大部分是通过半定量进行分析,即通过酶切后蛋白的SDS-PAGE上条带的大小和结合蛋白浓度分析软件进行分析。
本实验通过构建pET28b-MBP-his-TEV、
pET28b-MBP-his-ACP-TEV、p ET28b-MBP-ybb R-his-TEV重组载体,成功表达和纯化出目的蛋白,并且通过酶活分析发现ACP蛋白和ybb R 短肽对TEV酶的活性有促进作用,其中ybb R短肽的促进作用较大。
ACP和ybb R标签经修饰后可介导TEV的固定化,精确的酶活分析将为TEV酶的定向固定化研究提供技术支撑,为此,本实验构建了
pBAD24-α,p BAD24-his-MBP-α、p BAD24-his-MBP2-α载体,转化大肠杆菌DH5α,初步发现可以通过α-互补形成的β-半乳糖苷酶的显色反应来间接研究TEV酶的活性,将为用分光光度法定量分析TEV酶
活性奠定基础。