物理化学 第四章 第六节 二组分固-液体系平衡相图2
- 格式:ppt
- 大小:2.43 MB
- 文档页数:21

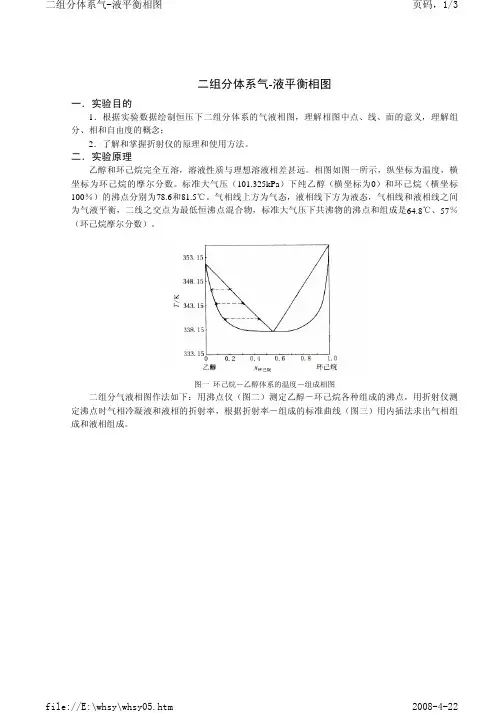
课程名称:大学化学实验(P)指导老师:成绩:_______________实验名称:二组分完全互溶双液系气-液平衡相图实验类型:物性测试同组学生姓名:【实验目的】1.学习测定气-液平衡数据及绘制二组分系统相图的方法,加深理解相律和相图等概念。
2.掌握正确测量纯液体和液体混合物沸点的方法。
3.熟悉阿贝折光仪的原理及操作,熟练掌握超级恒温超的使用和液体折射率的测定。
4.了解运用物理化学性质确定混合物组成的方法。
【实验原理】两种液态物质若能以任意比例混合,则称为二组分完全互溶液态混合物系统。
当纯液体或液态混合物的蒸气压与外压相等时就会沸腾,此时的温度就是沸点。
在一定外压下,纯液体的沸点有确定值,通常说的液体沸点指101.3kPa下的沸点。
对于完全互溶的混合物系统,沸点不仅与外压有关,还与系统的组成有关。
在一定压力下,二组分完全互溶液态混合物系统的沸点与组成的关系可分为三类:(1)液态混合物的沸点介于两纯组分的沸点之间,如苯-甲苯系统;(2)液态混合物有沸点极大值,如丙酮-氯仿系统;(3)液态混合物有沸点极小值,如水-乙醇系统、苯-乙醇系统。
对于第(1)类,在系统处于沸点时,气液两相的组成不相同,可以通过精馏使系统的两个组分完全分离。
第(2)、(3)类是由实际系统与拉乌尔定律产生严重偏差导致。
正偏差很大的系统,如第(3)类,在T-x图上呈现极小值,负偏差很大时,如第(2)类,则会出现极大值。
相图中出现极致的那一点,称为恒沸点,恒沸点温度和组成都是非常重要的平衡数据。
具有恒沸点组成的二组分混合物,在蒸馏时的气相组成和液相组成完全一样,整个蒸馏过程中沸点恒定不变,因此称为恒沸混合物,如要获得两纯组分,则需采取其他方法。
液态混合物组成的分析是相平衡实验的关键。
组分分析常采用折射率法、密度法等物理方法和色谱分析法等。
本实验采用折射率法。
在一定温度下的折射率是物质的一个特征参数,液态混合物的折射率与组成有关,一般呈简单的函数关系。








按固态互溶情况液态完全互溶而固态完全不互溶液态完全互溶而固态部分互溶液态、固态完全互溶1、二组分固液态完全互溶的固-液平衡相图图a Ge(A) -Si(B)系统的熔点-组成图t /℃a0.00.20.40.60.81.0Ge(A)Si(B)x Bs(A+B)l(A+B)••s+lt 1L 1S 1t 2L 2S 2a 液相线固相线HgBr 2 (A)t /℃HgI 2 (B)w B图a 最低熔点的液固相图t /℃d-香芹(A)l-香芹(B)w B图a 最高熔点液固相图2 液态完全互溶而固态完全不互溶固相线l(A+B )EDCl (A+B )+s Bs(A)+l(A+B )s(A)+s(B)0.00.20.40.60.8 1.0邻硝基氯苯(A)对硝基氯苯(B)x B80602040t /℃*A t *Bt邻硝基氯苯(A )-对硝基氯苯(B )系统的熔点-组成图•••共晶线(温度、三个相的组成都不变)液相线(凝固点降低曲线)E 点:液相能存在的最低温度,也是固相A 和B 能同时熔化的最低温度。
a0.00.20.40.60.81.0300250200Sn(A)Pb(B)x Bt /℃CDE350*At *Bt3272320.0110.260.710.96GFSn (A) -Pb(B)熔点••••••l(A+B)l+s β(A+B)s β(A+B)s α(A+B)+s β(A+B)l+ s α(A+B)aCED (1) 具有低共熔点的熔点-组成图CF 为Pb 在Sn 中的溶解度曲线l(A+B)s α(A+B)+s β(A+B)E 点:低共熔点3.固态部分互熔,液态完全互溶系统的相图(2)具有转变温度的熔点—组成图三相平衡线:Ag (A) –Pt (B)系统熔点-组成图0.00.20.40.60.81.0200016008001200Ag(A)Pt(B)w Bt /℃CE*At*Bt961GFl(A+B)l+s β(A+B)s α(A+B)+s β(A+B)s α(A+B)l+ s α(A+B)转变温度的含义:-l E (A+B) +s α(A+B)+ s β(A+B)ECD CF 为α固熔体中Pt 在Ag 中的溶解度曲线s α(A+B)1200 ℃s β(A+B)+ l Ea(1)热分析法原理:将系统加热到熔化温度以上,然后使其徐徐冷却,记录系统的温度随时间的变化,并绘制温度-时间曲线,叫步冷曲线4、热分析法绘制相图——熔点-组成图有三种类型:(2) 由步冷曲线绘制t —x 图0.00.20.40.60.8 1.0邻硝基氯苯(A)对硝基氯苯(B)x B80602040℃*Bt*At τ/ st /℃80602040邻硝基氯苯(A)对硝基氯苯(x Bt /℃l(A+B )l (A+B )+s(B)s(A)+l(A+B )••x B =0.33x B =0.63相图应用举例(1)——结晶分离ClNO2ClNO 2ClClNO2w =0.33w =0.01w =0.66如何分离?邻硝基氯苯对硝基氯苯表:邻、对位硝基氯苯的物理常数邻硝基氯苯(B)系统结晶分离原理示意图0.00.20.40.60.8 1.0邻硝基氯苯(A)对硝基氯苯(B)x B(A+B )送82.2HG ••••结晶分离-精馏分离熔点-组成图沸点-组成图5、二组分形成化合物系统的相图C = S -R -R ´=3 -1 = 2根据生成化合物的稳定性:(1)形成相合熔点化合物(2)形成不相合熔点化合物几个组分相图?w B0.00.20.40.60.81.015001000t /℃1500Mg(A)Si(B)Mg 2Si(C)*At *Bt1430650•••638E 2看成由两个简单低共熔点相图组合而成x B =0.33a 步冷曲线l+s(B)s (C)+ll(A+B)s(A)+s(C)s(C)+ls(C)+s(B)a(1) 形成相合熔点化合物(熔化后液相与固相组成相同)ANa (A) -K(B)熔点-组成图0.00.20.40.60.81.010050-500Na(A)K(B)x Bt /℃H l(A+B)Js(A)+s(C)s(A)+*At Na 2K (C)(2)形成不相合熔点化合物(熔体与固相组成不同)Na 2K(s)Na(s)+熔体[l (Na+K)]在熔点以上,转晶反应同时消失C(s)降温a二组分系统相图小结(1)二组分相图的基本类型—按相互溶解度分类ABt/℃*At *Bt (a)二组分液态(或固态)完全互ABt /℃*At *Bt (b)二组分液态(或固态)完全不互溶类型*Bt具有转变温度的熔点—组成图生成相合熔点化合物系统二组分固态完全不互溶,液态完全互溶二组分固态部分互溶,液态完全互溶生成不相合熔点化合物系统。
湖南师范大学化学化工学院College of Chemistry and Chemical EngineeringHunan Normal University物理化学实验报告实验题目:二组分固-液相图的测绘姓名:xxx学号:xxxxxxxxxxxx年级:xxx班级:sss实验日期:2016年4月8日一、实验目的(1)了解固-液相图的基本特点与常规测量方法的基本原理(2)用热分析法(步冷曲线法)测绘铅-锡二元金属相图(3)了解常规测温技术并学会铂电阻温度计的使用和标定二、实验基本原理(1) 二组分固-液相图(Phase Diagram of a Binary Solid-Liquid System)研究多相平衡体系的状态如何随浓度、温度、压力变化,并用图形表示出来,这种图形称为相图(Phase Diagram)。
以体系所含物质的组成为自变量,温度为应变量所得到的T-x图是常见的一种相图之一。
图2.6-1(a)是具有简单最低共熔点(the minimum eutectic point)的相图。
在相图的高温区为均匀的液相L区,下面是三个两相共存区。
而两个互不相溶的固相A、B和液相L三相平衡共存现象则是固-液相图最基本的特点。
图2.6-1 简单底共熔点固-液相图(a)及其步冷曲线(b)(2)热分析法和步冷曲线(Thermal Analytical Method and Cooling Curves)相图的测绘方法很多,其中热分析法是绘制相图最常用、也是最经典的实验方法之一。
其基本原理是,当体系缓慢而均匀的冷却(或加热)时,如果体系内部不发生相变化,则温度随时间均匀地改变;当体系内部有相变化时,在温度—时间图上出现转折点或水平线段。
图2.6-1(b)为与图2.6-1 (a)标示的三个组成相对应的步冷曲线。
步冷曲线(I)表示的是,将纯B液体冷却至纯B的凝固点TB以下时的步冷曲线。
由于在一定压力下,单组分的两相平衡体系自由度为零,所以当体系温度冷却到凝固点TB时,体系将保持恒定温度TB直到样品完全凝固,既从有第一颗固相析出开始到液相完全凝固这整个过程温度都不变化,因此,在曲线步冷曲线上出现一个水平段,然后再继续下降。