脐带间充质干细胞
- 格式:ppt
- 大小:89.00 KB
- 文档页数:12


脐带间充质干细胞分离培养操作细则一、样本接收1.观察运输箱的温度是否符合要求,采集瓶有无渗漏。
2.查看客户信息是否与交接表一致。
3.样本采集瓶外表面喷酒精擦拭消毒,并粘贴样本编码,填写样本接收记录,传入洁净区准备制备。
二、脐带间充质干细胞分离与接种1)准备耗材试剂:10cm培养皿、15ml离心管、50ml离心管、离心管架、10ml 移液管、T75培养瓶、离心管架、无尘布、50ml注射器针头、封口膜、灭菌止血钳、灭菌镊子、灭菌剪刀、废液缸、无血清干细胞培养基(常温复温)、生理盐水、75%酒精(已过滤)。
2)仪器设备准备及预热:电动移液枪、生物安全柜、离心机3)将75%酒精喷到台面,用无尘布擦拭台面,包括侧面及玻璃。
4)将生物安全柜开紫外30min通风10min,样本喷酒精擦拭,放入生物安全柜中,电动移液枪、移液管、离心管、离心管架喷酒精擦拭放入生物安全柜中,无菌棉球放入到广口瓶中加75%酒精放入生物安全柜中。
50ml、15ml离心管放到离心管架上,10cm皿5-7个。
将装有灭菌器械的灭菌盒喷酒精擦拭放入生物安全柜中。
5)取5个10cm皿依次摆开,1,2,4,5号皿依次加入适量的生理盐水,3号皿加入适量的已过滤的75%酒精。
拿出灭菌盒中已灭菌的止血钳,将脐带从保存瓶中取出放到第一个皿里,并取适量样本保存液留样送检支原体。
使用两个止血钳将脐带在第一个皿里清洗尽量去除脐带外表面的血污以及动静脉的血液和血凝块,将脐带转移至2号皿中,同样的方法再次清洗一次并测量其长度。
6)将清洗干净的脐带转移到装有已过滤75%酒精的3号皿中浸泡1min左右(不要超过两分钟),计时结束后,将脐带转移至4号皿中,同样的洗涤方法去除酒精。
清洗结束后将脐带剪成1-2cm短节,放入5号皿中,再次洗涤尽量去除血管内的血污。
再次拿两个10cm皿,加入适量的生理盐水,去一皿的盖子加少许盐水湿润底部及可。
7)将1-2cm的脐带小段转移到新的皿里,用带齿口的镊子取一段脐带,将脐带展开,再按血管走势剔除脐带的两条动脉,一条静脉。

脐带间充质干细胞新生儿脐带组织——脐带间充质干细胞脐带间充质干细胞(Mesenchymal Stem Cells,MSCs)是指存在于新生儿脐带组织中的一种多功能干细胞,它能分化成许多种组织细胞,具有广阔的临床应用前景。
脐带间充质干细胞的特性:间充质干细胞是干细胞的一种,因能分化为间质组织而得名,具有亚全能分化潜能,在特定的体内外环境下,能够诱导分化成为多种组织细胞。
间充质干细胞具有干细胞的共性,即自我更新、多向分化和归巢的能力。
脐带间充质干细胞的分化能力:间充质干细胞具有向多种类型细胞分化的能力,可以分化为神经、心脏、肝脏、骨、软骨、肌腱、脂肪、上皮等多种细胞。
这种多向分化的能力给人类多种疾病的治疗提供了重要的原材料。
脐带间充质干细胞的取材:脐带间充质干细胞来源于新生儿脐带华通氏胶,取材方便,体外增殖能力强。
一根脐带提取的间充质干细胞的数量相当于成人5000毫升骨髓中的间充质干细胞数量,且质量优、活性高、更纯净,可多次使用,是理想的间充质干细胞来源。
脐带间充质干细胞的分离培养:1. 取新鲜健康脐带,用PBS冲洗干净后,用剪刀镊子剔去血管,剥出里面的华氏胶组织。
2. 将所得组织充分剪碎至1 mm3大小,加入α-MEM培养液置于37℃,5%的CO2培养箱培养,培养液中含10% FBS,100U/ml 青霉素,100U/ml链霉素。
3. 脐带组织培养5-7天后,可见有部分细胞从组织块周围爬出,形态呈细小的梭形,4. 一周后,细胞开始迅速增殖,形成大小不等的细胞集落,待细胞长满后,用0.25%胰蛋白酶消化传代。
间充质干细胞临床应用美国FDA已批准了近60项临床试验,主要包括以下几个方面:1)造血干细胞移植:增强造血功能;促使造血干细胞移植物的植入;治疗移植物抗宿主病。
2)组织损伤的修复:骨、软骨、关节损伤、心脏损伤;肝脏损伤;脊髓损伤和神经系统疾病。
3)自身免疫性疾病:系统性红斑狼疮、硬皮病、炎性肠炎等。

人脐带间充质干细胞操作规范一、人脐带间充质干细胞的分离和培养1.准备4~5个培养皿,打开放在超净台中,将消毒过的平剪×1,弯剪×2,有齿镊子×4,放入超净台,紫外照射30 min,通风10 XXX;2.在1#、3#和4#号培养皿倒入25 ml生理盐水,在2#培养皿倒入25 ml酒精;3.将盛放脐带的器皿用酒精消毒外表面后放入超净台,用弯嘴钳取出脐带放入1#培养皿,清洗残留血渍,用第2把弯嘴钳配合挤出脐带血管内的积血。
4.将脐带转移至2#培养皿,完全浸泡,计时1 XXX;5.将脐带转移至3#培养皿,用平剪剪成3 cm左右的小段,清洗脐带内的积血(如果积血较多,可再次转入另一加盐水的培养皿);6.用有齿镊子分离2根动脉和1根静脉,剥离华尔通氏胶,放入4#培养皿。
7.将剥离的胶体转移至50 ml离心管中,2000 rpm离心5 min。
8.弃上清液,将胶体倒入干净的培养皿中,用小剪刀将其剪成糊状并转移至50 ml离心管中;9.以0.5 ml/瓶的量将胶体构造块接种至T75培养瓶,每瓶插手4 ml脐带有血清培养液(DMEM/F12 + 10% FBS + 1% L-Glutamine + 1% MEM NEAA + 10 ng/mlbFGF),水平摇晃培养瓶使组织块分布均匀;10.第2天观察是否有污染,每3天换一次液,并观察细胞爬出情况(过程中须注意平稳地拿放培养瓶,避免组织块发生移动);11.培养14天左右,倒去上清培养液,加心理盐水(3 ml/瓶)洗濯,用0.25%胰酶(2 ml/瓶)消化下爬出细胞及构造块,并用上清培养液(1 ml/瓶)终止消化;12.收集细胞及组织块悬液,2000 rpm离心5 min;13.弃上清液,插手适当心理盐水混匀,用70 μm滤网过滤去除构造块,即得到P0代脐带间充质干细胞;614.细胞计数,按10/瓶接种,每瓶插手10 ml脐带无血清培养液UltraCULTURE + 2% XXX 1% Glutamine + 1% MEM NAA),每3天换一次液。

比较不同培养基培养脐带间充质干细胞1 资料与方法1.1 一般资料经产妇知情同意,采集足月剖宫产健康胎儿脐带,无菌情况下放入含有抗生素的生理盐水中,4C保存,6h内无菌处理。
1.2 脐带的分离和原代培养植块法分离脐带:用止血钳及剪刀无菌取胎儿脐带4~5cm,D-hank's 液充分洗涤,去除脐静脉及动脉内的新鲜血液,分离并去除脐带外膜组织和血管组织,获得脐带wharton 胶。
将其剪碎至1mm31织块,使用吸管将组织块逐一植入T75培养瓶底,密度20〜25块/瓶为宜,组织小块在瓶底要分布均匀,倒置放入37 C,体积分数为5%CO饱和湿度培养箱内。
3〜5h 后待组织块粘附牢固正向放置到超净台内,加入适量含10%台牛血清的DMEM/F1培养基,正向放入体积分数为5%CO饱和湿度培养箱内。
72h后换液,一般5~7d 可有间充质干细胞爬出。
1.3 脐带间充质干细胞在不同培养体系的体外扩增将原代细胞完全爬出后,在IMDM、DMEM/F1(2 不含酚红)、StemProRMSC SFM 三种培养体系中传代培养,在生长过程中进行形态学观察。
1.4流式细胞仪表型检测取生长状态良好的P4代细胞,消化并计数,以每管1X 106个细胞,分别加入10 u l单克隆抗体CD73 CD34 CD45 CD105 HLA-DRHLA-ABC及阴性对照lgG1 -PE、阳性对照lgG1-FITC,室温避光孵育30min, PBS洗涤两次,室温300g, 5min。
PBS重悬后上流式细胞仪。
1.5 cck-8 法检测细胞活性取生长状态良好的P4 代细胞,调整细胞浓度至0.2 X 105/ml,加入96孔板。
每孔90卩l放在37C、体积分数为5%CO饱和湿度培养箱内培养。
7d内每日上午10:00取出96孔板用与原来孔内相同培养基100卩l换液后加入cck-8溶液,继续孵育1h。
用酶标仪波长450nm测定各孔OD 值。
以OD直代表细胞的相对数量,绘制细胞生长曲线。

脐带间充质干细胞制备原理一、概述脐带间充质干细胞(Wharton's jelly mesenchymal stem cells,WJ-MSCs)是一种来源于新生儿脐带的干细胞。
与其他来源的干细胞相比,WJ-MSCs具有易于获取、无伦理争议、低免疫原性和多向分化潜能等优点,因此在临床应用中具有广泛的前景。
本文将就WJ-MSCs制备原理进行详细介绍。
二、脐带间充质干细胞的来源脐带是连接胎盘和新生儿的管道,其中包含了丰富的干细胞资源。
在脐带中,除了血液造血干细胞外,还存在着一种特殊类型的干细胞——脐带间充质干细胞。
这种干细胞主要存在于脐带Wharton's jelly (WJ)中,与周围组织隔离。
三、WJ-MSCs制备方法1. 脐带获取制备WJ-MSCs首先需要获取新生儿脐带组织。
通常情况下,在新生儿出生后不久即可进行采集。
采集过程中需要注意消毒和无菌操作。
2. 分离WJ组织将采集到的脐带组织进行分离,去除血管和外层膜等部分,得到WJ组织。
WJ组织是一种透明的胶状物质,通常呈现出白色或浅黄色。
3. 制备单细胞悬液将WJ组织切成小块,并加入胶原酶等消化酶进行消化。
消化后,用PBS等缓冲液洗涤多次,最后制备成单细胞悬液。
4. 培养和扩增将制备好的单细胞悬液接种在干细胞培养基中,并放置于37℃、5% CO2的培养箱内进行培养和扩增。
在培养过程中需要定期更换培养基,并对干细胞进行观察和评估。
5. 鉴定和纯化经过一段时间的培养,可以通过流式细胞术等方法对干细胞进行鉴定和纯化。
通常情况下,WJ-MSCs表达CD73、CD90、CD105等特征性标志物,并且不表达CD34、CD45等血液细胞特征性标志物。
6. 冻存经过纯化和鉴定后,WJ-MSCs可以进行冻存。
在冻存过程中需要使用特殊的冻存液,并在低温下保存。
四、WJ-MSCs的应用前景WJ-MSCs具有广泛的应用前景。
目前已经有多项临床试验显示,WJ-MSCs可以用于治疗多种疾病,如心血管疾病、神经系统疾病、肝脏疾病等。

(一)1.Sections of 8–10 cm of umbilical cords, which are routinely discarded, were internally washed with phosphate-buffered saline (PBS), supplemented with 3% penicillin/streptomycin (Invitrogen-Gibco, Grand Island, NY, ) and immediately immers ed in Dulbecco ’s modi fied Eagle ’s medium- low glucose (DMEM-LG; Invitrogen-Gibco) supplemented with 10% fetal bovine serum (FBS; Invitrogen-Gibco) and 3% penicillin/streptomycin (Invitrogen-Gibco). All samples were processed within 12 –15 h after collection.2. UCs were fil led with 0.1% collagenase (Sigma-A ldrich, St. L oui s, /sigma-aldrich/home.h tml) in PBS and incuba ted at 37°C for 20 min. Each UC was washed wi th proli feration medium, and the detach ed cell s were harvested after gentl e mass age of the UC. Cells were centr ifuged at 300 g for 10 min, resus -pended in prolifera tion medium, and seeded in 25-cm^ 2 flasks at a densi ty of 5 × 10^7 cells per ml.After 24 h of incubation, non-adherent cells were removed, and culture medi um was replace d every 3 days.(二)HuMSCs were prepared as previously described.8 Wharton's jelly was processed within 24 hours of collection and cut into pieces of about 1 mm3 for culture. These pieces were placed in 24-well plates and cultured in DMEM supplemented with 10% fetal bovine serum (FBS), 5 ng/ml EGF, 5 ng/ml basic fibroblast growth factor, 100 U/ml penicillin and 100 mg/ml streptomycin, and 1 μg/ml amphoterin B. The culture plate was placed in an incubator with saturated humidity at about 37°C containing 5% (v/v) CO2. The medium was changed every three days and the cells were passaged when they reaching 70% confluence. Adherent cells were recovered by treatment with 0.25% trypsin for 3 to 5 minutes then centrifuged.(三) 脐带间充质干细胞的分离:脐带自手术台取下后,浸入含抗生素的生理盐水中,4 ℃保存,在操净台内取出脐带,用D-PBS冲洗净脐动脉和脐静脉内的残余血液,用止血钳和剪刀剔除上述血管,将脐带剪成1 mm^3大小的组织块后放入200 mL 蓝盖试剂瓶,加入质量/ 体积比为0.1%的Ⅱ型胶原酶30 mL,置于恒温振荡仪内持续消化6 h ,100 目筛网过滤收集细胞。

脐带间充质干细胞概述医学实验班70080103王雪彤脐带是胎儿时期连接母体与胎儿的索状结构,其外被羊膜,内含2条脐动华尔通氏脉、1条脐静脉,在动静脉之间含有特殊的胚胎粘液样结缔组织胶(WhartonpsJelly),从华尔通氏胶分离得到的基质细胞即为人脐带间充质干细胞(HUMSCs)。
1人脐带间充质干细胞(HUMSCs)的形貌分析:倒置显微镜下观察人脐带间充质干细胞贴壁生长,为形态相对均一的梭形细胞,呈平行排列生长或旋涡状生长,低密度时较扁平,密度增加趋于融合时细胞变细长。
扫描电镜下观察呈长条状纤维样,细胞膜表面不光滑,有小结节状物,细胞无明显突起,细胞间无网络状连接。
透射电镜观察核大,不规则,核仁明显,常染色质多,异染色质少,胞浆少。
胞质内细胞器较少,以粗面内质网和线粒体为主,内有大量游离核糖体,部分细胞可见内质网月中胀。
植块法培养获得的人脐带间充质干细胞(X200)例如三代细胞的形态学特征一一人体脐带间充质干细胞离体培养后,培养至第三代。
第三代人脐带间充质干细胞以均一长梭形的细胞为主,细胞周边有较多的丝状伪足,见图1,2;并形成毗邻细胞之间的网状连接,见图3;细胞核较大,核膜清晰,含两三个核仁,核质比较小,见图4。
2人脐带间充质干细胞(HUMSCs)的生物学特性:HUMSCs既非胚胎干细胞又非成体干细胞,是别于两者之间的一类新的多能问充质细胞,它们之间既有联系又有差异。
根据国际细胞疗法间充质与组织干细胞委员会(theMesenchymalandTissueStemCellCommitteeoftheInternation2alSocietyforCellul arTherapy)制定的最低标准,脐带间充质干细胞(MSCs)需满足以下条件:1)MSCs在标准培养条件下呈贴壁生长;2)MSCs表达CD105,CD73和CD90,不表达CD45,CD34,CD14或CD11b,CD79a或CD19和HLA2DR;3)MSCs在体外至少能向成骨细胞、脂肪细胞和软骨细胞分化。

脐带血间充质干细胞的分离培养和鉴定概述脐带血间充质干细胞(Wharton’s jelly mesenchymal stem cells, WJ-MSCs)是一类来源于脐带的干细胞。
WJ-MSCs具有较强的增殖能力、多向分化潜能、免疫调节功能等,是目前研究领域中备受关注的干细胞类型之一。
在该文档中,我们将介绍如何从脐带血样中分离出WJ-MSCs,并进行相关的细胞培养和鉴定。
分离过程脐带血样获取首先需要从人体获得脐带血样。
脐带血样一般可以在婴儿出生后通过脐带穿刺等方式获取。
获取脐带血样需要得到母亲的同意,并通过相关机构进行规范化处理。
分离WJ-MSCs脐带血样获取后,需要将其中的WJ-MSCs进行分离。
具体分离步骤如下: 1.将脐带血样转移至离心管中; 2. 加入相同体积的PBS,并轻轻混合; 3. 通过低速离心分离脐带血样中的血细胞等成分; 4. 取下沉后的WJ组织,加入胶原酶等酶类消化物进行消化,离心分离细胞; 5. 通过细胞培养等方式扩增细胞数量。
细胞培养在分离得到WJ-MSCs之后,需要进行相关的细胞培养。
具体培养步骤如下:1. 将分离得到的WJ-MSCs转移至新的培养皿中; 2. 加入含有10% FBS的DMEM低糖培养基; 3. 定期更换培养基,并记录生长状况。
鉴定方法确定分离的细胞为WJ-MSCs的方法很多,常用的方法如下: #### 形态学鉴定通过显微镜观察细胞形态、吸附能力等,判断细胞是否符合WJ-MSCs的特征。
免疫学鉴定通过使用针对WJ-MSCs标记的分子抗体(如CD73、CD90等)对细胞进行标记,并使用流式细胞仪等方法进行检测。
活力检测通过MTT法、细胞增殖实验等,检测WJ-MSCs是否具备较强的增殖能力。
多向分化鉴定通过对WJ-MSCs进行分化培养,如脂肪细胞培养、软骨细胞培养等,检测WJ-MSCs是否显示多向分化的潜能。
结论通过脐带血样的分离,可以获得WJ-MSCs,并通过相关的培养和鉴定方法,确定其为WJ-MSCs,并进一步应用于生物医学实验中,具有潜在的临床应用前景。

1.制备:使用生理盐水充分洗涤脐带,并剪成小段。
去除动脉和静脉,撕取华通胶至少8ml。
充分剪碎后平分至4瓶已加25ml完全培养基的175cm2培养瓶中。
静置培养7天。
第8天根据生长情况,进行换液、传代。
2.换液:根据细胞生长情况与培养基颜色决定全量换液或半量换液。
用去头移液管吸弃半量或全量旧培养基,更换移液管,于培养瓶的非细胞培养面缓慢加入等量新培养基。
3.传代:每瓶加0.25%胰酶3ml,待细胞变圆后轻拍瓶壁,每瓶加终止液(2%FBS+a-MEM)10ml,吸出细胞悬液至2支50ml离心管中,各培养瓶每瓶加10ml 生理盐水,吹洗汇入50ml离心管中。
1200rpm,离心6min,弃上清。
合并沉淀至1管,加40ml生理盐水再次离心洗涤,沉淀用10ml完全培养基重悬,经细胞筛过滤,5ml完全培养基冲洗筛网,计数。
根据细胞数量铺瓶,使细胞浓度为1~2×104/ml,置37℃、5%CO2培养箱中培养。
4.收获:每瓶加入3ml0.25%胰酶,37℃消化1min,加入终止液10ml/瓶,收集所有液体到50ml离心管中,再每瓶加10ml生理盐水,轻柔吹打后汇入50ml离心管中。
1200转/min离心6min,弃上清,细胞沉淀用16ml生理盐水悬浮,混匀取1ml做计数和流式检测。
加生理盐水至40ml,取500μl上清做内毒素检测,1200rpm,离心6min。
弃上清,离心沉淀用2.5mlFBS悬浮,再缓慢加入2.5ml 冻存母液,混匀后分装到冻存管中,每管1ml。
冻存细胞数应控制在2~5×106/ml 范围内。
利用程序降温盒放置-80℃医用冰箱中过夜后转至液氮罐。
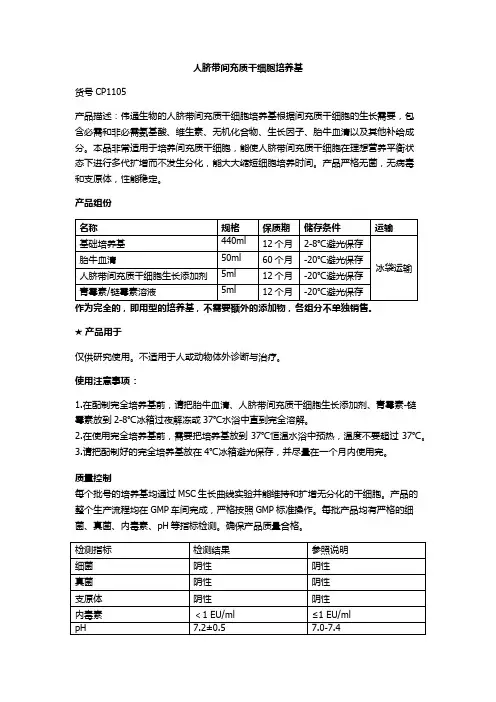
人脐带间充质干细胞培养基
货号CP1105
产品描述:伟通生物的人脐带间充质干细胞培养基根据间充质干细胞的生长需要,包
含必需和非必需氨基酸、维生素、无机化合物、生长因子、胎牛血清以及其他补给成分。
本品非常适用于培养间充质干细胞,能使人脐带间充质干细胞在理想营养平衡状
态下进行多代扩增而不发生分化,能大大缩短细胞培养时间。
产品严格无菌,无病毒
和支原体,性能稳定。
产品组份
★产品用于
仅供研究使用。
不适用于人或动物体外诊断与治疗。
使用注意事项:
1.在配制完全培养基前,请把胎牛血清、人脐带间充质干细胞生长添加剂、青霉素-链
霉素放到2-8℃冰箱过夜解冻或37℃水浴中直到完全溶解。
2.在使用完全培养基前,需要把培养基放到37℃恒温水浴中预热,温度不要超过37℃。
3.请把配制好的完全培养基放在4℃冰箱避光保存,并尽量在一个月内使用完。
质量控制
每个批号的培养基均通过MSC生长曲线实验并能维持和扩增无分化的干细胞。
产品的整个生产流程均在GMP车间完成,严格按照GMP标准操作。
每批产品均有严格的细菌、真菌、内毒素、pH等指标检测。
确保产品质量合格。
伟通生物保留旗下技术文档的所有权利,未经伟通生物公司书面允许,本文档任何部分不得转载或用于其他用途。
人脐带间充质干细胞国际细胞治疗协会定义的标准人脐带间充质干细胞国际细胞治疗协会定义的标准1. 引言人脐带间充质干细胞(Wharton's jelly-derived mesenchymal stem cells,WJ-MSCs)是一种被广泛研究和应用的干细胞资源。
作为这个领域的重要组成部分,人脐带间充质干细胞国际细胞治疗协会(International Society for Cell & Gene Therapy)制定了一系列标准来定义人脐带间充质干细胞,这些标准不仅对于科学研究具有重要意义,同时也对于临床应用和治疗效果的评估至关重要。
2. WHO 推行的初衷和原则人脐带间充质干细胞国际细胞治疗协会的标准旨在确保干细胞的质量和安全性,以便更好地应用于细胞治疗领域。
这些标准不仅限定了干细胞的来源和特性,还包括细胞处理和存储的要求等。
通过制定这些标准,国际细胞治疗协会为临床研究和细胞治疗的发展提供了指导。
3. 人脐带间充质干细胞定义的关键指标根据国际细胞治疗协会的定义,人脐带间充质干细胞可以通过以下几个关键指标来判断:a. 来源:主要来源于脐带的Wharton's jelly组织,这是一种丰富而易获得的干细胞来源。
b. 表面标记:表达特定的免疫表面标记,如CD73、CD90、CD105等,并且不表达CD34、CD45等造血干细胞标记。
c. 多向分化潜能:具有分化为多种细胞类型的潜能,如骨、脂肪、软骨等。
d. 免疫抑制能力:具有调节免疫功能,可以抑制免疫反应和自身免疫性疾病等。
e. 活力和增殖能力:繁殖能力强,能够长时间维持干细胞特性。
4. 临床应用和治疗效果评估根据人脐带间充质干细胞的定义标准,科研人员和临床医生可以更好地评估细胞治疗的效果和潜在风险。
这些标准也为细胞治疗产品的质量控制和监管提供了依据,确保细胞治疗的安全性和可行性。
5. 对于干细胞研究和应用的启示人脐带间充质干细胞国际细胞治疗协会定义的标准,不仅适用于人脐带间充质干细胞,也为其他干细胞类型的研究和应用提供了借鉴。
脐带间充质干细胞制备存储标准脐带间充质干细胞(Wharton's Jelly Mesenchymal Stem Cells,WJ-MSCs)是一种来源于脐带的多潜能干细胞,具有广泛的临床应用前景。
为了确保脐带间充质干细胞的制备和存储质量,制定脐带间充质干细胞制备存储标准非常重要。
脐带间充质干细胞的制备和存储标准应包括以下几个方面:1.取材标准:脐带是脐带间充质干细胞的主要来源,因此在制备和存储过程中需要确保脐带的质量。
取材时,应确保脐带来自经过筛选和检测的健康母亲,脐带的无菌处理应符合相关规定。
2.分离和培养标准:脐带间充质干细胞的分离和培养是制备过程中的关键步骤。
应采用符合相关规定的分离和培养方法,确保脐带间充质干细胞能够获得最佳生长和增殖环境。
3.鉴定标准:在制备过程中,需要对脐带间充质干细胞进行鉴定。
鉴定标准可以包括表面标记物的检测、多向分化潜能的检测等指标,以确保制备的细胞具有干细胞的特性。
4.冻存标准:为了确保脐带间充质干细胞的长期保存,应采用合适的冻存方法和条件。
冻存标准可以包括冷冻液的选择、冷冻速率的控制、冷冻样品的保存温度等指标。
5.质量控制标准:脐带间充质干细胞的制备和存储过程中应进行严格的质量控制。
质量控制标准可以包括细胞数目的检测、细胞活力的检测、无菌检测等项目,以确保制备的细胞符合质量要求。
在制定脐带间充质干细胞制备存储标准时,需要参考国内外相关的法规和标准。
同时,制定标准时需要考虑到国内的实际情况和相关研究的最新进展。
制定标准应充分结合实际情况和科学研究,确保标准的可行性和科学性。
脐带间充质干细胞的制备和存储标准对于保证脐带间充质干细胞的质量和应用的安全性具有重要意义。
符合标准的脐带间充质干细胞可以应用于临床医学领域,对于治疗一些疾病和促进组织再生具有重要的作用。
因此,制定脐带间充质干细胞制备存储标准是当务之急,对于推动相关领域的研究和应用具有重要的意义。
小鼠脐间带充质干细胞培养方法引言充质干细胞(me se nc h ym al st em ce ll s,M SC s)是一类具有多向分化潜能的多能干细胞,具有广泛的应用前景。
在生物医学领域,小鼠脐间带充质干细胞是一种重要的来源之一。
本文将介绍小鼠脐间带充质干细胞的培养方法,帮助研究人员更好地利用这一珍贵的细胞资源。
原料与试剂准备1.小鼠脐带组织2.DM EM/F12培养基3.胎牛血清(F BS)4.细胞培养袋5.1×PB S缓冲液步骤1.小鼠脐带的处理(1)准备一个无菌操作台,并在工作区上喷洒酒精消毒剂,手套等工具也需要经过灭菌处理。
(2)取出小鼠脐带组织,置于无菌的1×P BS缓冲液中,用剪刀剪碎细胞片段。
(3)将小鼠脐带组织片段转移到细胞培养袋中。
(4)加入适量的DME M/F12培养基,保证组织片段被完全浸润。
(5)将细胞培养袋密封,并置于37°C恒温培养箱中,进行消化和悬浮培养,时间约为4-6小时。
2.细胞的收获和培养(1)将消化后的细胞悬液通过100μm的细胞滤网过滤,去除大颗粒残渣。
(2)将滤液离心,去除上清液,沉淀的细胞用DM EM/F12培养基洗涤。
(3)将洗涤后的细胞沉淀用适量的D MEM/F12培养基重新悬浮。
(4)将细胞悬液转移到细胞培养瓶中,每瓶加入适量的培养基和10%的F BS。
(5)将细胞培养瓶放置于37°C恒温培养箱中,进行培养。
(6)每2-3天更换一次培养基,保持细胞的健康生长。
3.细胞的传代与冻存(1)当细胞达到80-90%的密度时,将培养瓶内的细胞用1×P BS缓冲液洗涤。
(2)用胰酶对细胞进行消化,停止细胞的生长。
(3)加入适量的DME M/F12培养基,将细胞悬液转移到新的细胞培养瓶中。
(4)将细胞培养瓶放置于恒温培养箱中继续培养。
4.脐带间充质干细胞的鉴定(1)使用流式细胞仪对培养的小鼠脐带间充质干细胞进行免疫鉴定。