鸡胚原代细胞培养
- 格式:doc
- 大小:40.00 KB
- 文档页数:6

鸡胚原代细胞的培养{能力目标}·了解鸡胚的发育过程。
·掌握鸡胚原代细胞制备及培养技术。
{实验器材}(1)Hank's液、含10%~20%血清的细胞培养液、碘酊棉、酒精棉、0.25%胰酶。
(2)超净工作台或生物安全柜、细胞培养瓶、吸尔球、灭菌吸管、平皿、毛吸管、离心管、剪刀、小镊子、培养箱、倒置显微镜。
{实验内容及操作步骤}一、鸡胚的孵育受精鸡胚放在蛋托上,大头朝上,人温箱培养。
在温箱底部放上一盘水,将温度调至37.8℃即可。
二、鸡胚的发育过程(1)观察方法:将9~12日龄的鸡胚取出,放人平皿中进行观察。
(2)鸡胚的发育:要采用鸡胚进行细胞培养时,应对鸡胚的发育有一个初步了解。
鸡胚的发育是由受精卵开始的,它在通过输卵管时,已开始分裂,当产卵时已在卵黄上部形成一层细胞,名为胚盘,在适宜的条件下胚盘继续分裂生长。
在发育过程中由卵黄和卵白中获取养料和水分,由于胚体与卵黄分开的缘故,胚胎只通过卵黄带与卵黄相连。
发育的早期形成三个胚层,即外胚层、中胚层和内胚层,由此形成胚胎的各个器官和组织。
一般孵育至第3d出现尿囊,为直肠腹侧部分的膨出物,尿囊膜是由内胚层和中胚层构成的。
至第4~5d胚体为羊膜、尿囊膜及绒毛膜层包被。
羊膜系由外胚层和中胚层组成,开始时紧贴于胚体上,后来腔内逐渐充满羊水。
尿膜在生长发育的过程中,与绒毛膜相连而成绒毛尿囊膜,此膜为三层细胞组成。
外层为外胚层,内层为内胚层,中间为中胚层细胞,其中血管甚多有两条主动脉自卵黄囊延伸到此膜中,与此并行有两条主静脉,汇流成一较大的尿囊静脉。
绒毛尿囊膜系鸡胚的呼吸器官,位于壳膜之内。
此膜生长发育很快,第10d己包围了整个鸡胚,此时鸡胚己出现羽毛,呼吸道的发育在第12~15d之间出现。
'胚胎体积逐渐增大时,胚胎腔外体液亦日趋减少,孵出小鸡时已无胚胎腔外体液。
在发育早期,尿囊液及羊水的成分与生理盐水溶液相差无几,12d后羊水的蛋白含量及黏稠度增加,尿囊腔积累了肾脏的排泄物,因此,在12d或13d 后,尿囊液由于尿酸盐的存在,使原来透明的液体呈现混浊。

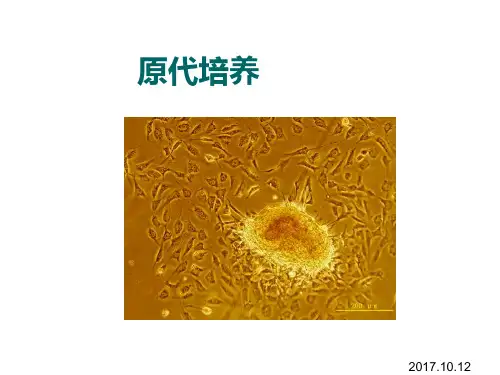



鸡胚原代细胞培养鸡胚原代细胞培养细胞是一微小而完整的生命单位,它组成各种生物体并生长、繁殖。
在生命体外,如果提供类似生物体内的环境条件,细胞也能生长繁殖。
要使每个细胞都能从人造环境中获得营养物质,必须将组织块分散成单个细胞。
组织培养法是目前培养病毒应用最广的一种方法,其优点是:一般没有隐性感染,没有免疫抵抗力,便于选择易感细胞,实验条件易于控制,成本便宜,经济适用。
组织培养法多应用于病毒的分离、鉴定、病毒感染细胞的机制、生产疫苗和抗原等。
很多组织,包括鸡胚,各种动物的肾脏组织,人胎羊膜细胞或流产胎儿组织等均可作组织培养的来源。
细胞来源的选择,主要是根据细胞对病毒的敏感性而定。
组织培养的方法中以单层细胞培养是最常用的方法,它又有原代和次代细胞培养、二倍体细胞株和传代细胞系三种类型。
原代培养是指将动物机体的各种组织从机体中取出,经各种酶(常用胰蛋白酶)、螯合剂(常用EDTA)或机械方法处理,分散成单细胞,置合适的培养基中培养,使细胞得以生存、生长和繁殖的过程。
本试验介绍原代细胞的鸡胚成纤维细胞培养方法。
(一)实验目的了解单层细胞培养方法(二)实验材料1、10日龄鸡胚。
2、1640培养基(含20%小牛血清),0.25%胰酶,Hank’s液,碘酒。
3、无菌组织培养瓶、吸管、滴管、剪子、镊子、超净工作台、CO2培养箱、蒸水器、纯水器(生物级)、滤器、真空泵、高压灭菌锅、培养箱(调整至37℃),培养瓶、青霉素瓶、小玻璃漏斗、平皿、吸管、移液管、纱布、手术器械、血球计数板、离心机、水浴箱(37℃)。
(三)实验方法1、用碘酒消毒鸡卵气室端外壳,并将鸡胚直立于卵架上。
以镊子将小鸡取出放在无菌培养皿内,去头,爪、内脏和骨骼,用Hanks氏溶液洗2-3次。
2、用小剪在小烧瓶内将鸡胚剪成小块(1~2mm3),加Hankr 氏溶液(约10ml)冲洗2-3次,静置1~2分钟,用毛细吸管吸去液体,依同法再洗涤2次,将血球充分洗去。


鸡胚原代细胞的培养[实验目的]掌握鸡胚原代细胞培养操作的基本程序,观察单层细胞生长情况。
[实验材料]9~10日龄鸡胚,Hank`s液(已含0.5%乳蛋白水解物),0.25%胰蛋白酶,NaHCO,双抗,3牛犊血清,手术剪,眼科镊,培养皿,细胞瓶,三角瓶,玻璃珠(置于三角瓶内),漏斗,纱布(置于漏斗中),30ml注射器,10ml注射器,塞子若干,蛋座,水浴锅。
[实验内容及操作程序]1、配液在Hank`s液中加入青、链霉素,使其含量为青霉素1000IU/ml,链霉素100ug/ml。
胰蛋白酶用含有青链霉素的Hank`s液(简称H液)按1:9比例稀释。
用7.5%NaHCO调整pH至7.2~7.4(玫瑰红色)。
32、取胚及剪碎将胚蛋气室端向上竖直于蛋座上,用碘酊消毒气室,以镊子击破卵壳并弃之,注意不能让蛋壳碎屑掉入气势内,撕破卵膜并揭之,继撕破绒尿膜、羊膜,用镊子夹住或勾住鸡胚脖子部位,取出胚胎于平皿中。
剪去头部、翅爪及内脏,用H 液洗去体表血液。
用灭菌剪刀剪碎鸡胚,使其成为约1mm3大小的碎块,用H液小心洗涤2次。
3、消化将洗涤好的胚胎碎块转移入三角瓶中,尽量不要让组织块沾到平皿壁上,按组织块量约3~5倍胰酶,加上瓶塞,37℃水浴约20min左右,每隔5min轻轻摇动1次。
待液体变混而稍稠,中止消化。
4、分散取出三角瓶后静置1min,让组织块下沉后轻轻倒去胰酶,塞好瓶塞,用力振摇三角瓶,以使细胞分散下来。
加入H液,轻轻振荡,待组织块下沉后,通过漏斗中的纱布将H液过滤于细胞瓶中,小心不让组织块一并倒出。
继续用力振摇三角瓶,加H液过滤,重复两次,最后一次连同组织块一起倒入漏斗。
5、加入血清在过滤好的细胞悬液中加入牛犊血清,使血清含量为10%。
塞好瓶塞,轻摇细胞瓶混匀。
6、分装将加入血清的细胞悬液分装至各个细胞瓶中,约占细胞瓶容积的10%左右。
塞紧瓶塞,将细胞瓶横卧,瓶上注明组别、日期,置37℃温箱培养。
4h后细胞可贴附于瓶壁,每隔24h观察一次,24~36h生长成单层细胞,此时可吸取培养液,更换维持液,并接种病毒。



鸡胚成纤维细胞的原代培养171850044生拔钱诗晨一、背景知识1.1原代培养与传代培养1.1.1原代培养是指直接从生物体取材(细胞、组织或器官)进行的第一次培养(中途不分割培养物、不更换培养物的生长器皿)。
1.1.2传代细胞培养分割细胞培养物进行的再配养注:细胞培养的代不是指细胞分裂次数,而是指培养的次数1.2细胞体外培养要求的条件✓无菌✓适宜温度:哺乳动物细胞36.5℃ 0.5℃,植物细胞原生质体25℃左右✓生理渗透压✓适宜酸碱度:7.2-7.4✓气体:95%空气+5%二氧化碳✓培养基:提供水、各种有机营养(糖、氨基酸、维生素等)及无机盐、生长调节因子等1.3培养细胞生长类型悬浮型:培养时不黏附于支持物之上。
而呈现悬浮生长的细胞。
贴壁型:培养时需要黏附于一定固相支持物表面才能很好生长的细胞。
又称黏附依赖型细胞(分如下四类)✧成纤维细胞:胞体呈梭形或不规则三角形,中央有卵圆形核,胞质突起,生长时呈放射状。
✧上皮型:细胞呈扁平不规则多角形,中央有圆形核,细胞彼此紧密相连成单层膜。
✧游走型:呈散在生长,一般不连成片,胞质常突起,呈活跃游走或变形运动,方向不规则。
此型细胞不稳定,有时难以和其他细胞相区别。
在一定条件下,如培养基化学性质变动等,它们也可能成纤维细胞形态。
✧多形型:是一些形态上不规则的细胞。
细胞一般分胞体和胞突两部分,胞体呈不规则多边形,胞突呈细长丝状。
如神经元和神经胶质细胞1.4原代细胞培养的一般办法1.4.1植块培养法直接将组织块接入培养皿底部,待组织块贴牢在底部后再加入培养基培养的方法1.4.2离散细胞培养法用酶消化组织,使细胞之间连接破坏,将组织离散成单细胞悬液进行培养的方法注:原代培养中的植块培养法与组织培养不是一回事;植物组织培养又叫离体培养,指从植物体分离出符合需要的组织、器官或细胞、原生质体等,通过无菌操作,在人工控制条件下进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。
鸡胚原代细胞培养鸡胚原代细胞培养[实验材料]9~10日龄鸡胚,Hank"s液50mL,0.5%水解乳蛋白液或MEM培养液20mL(含犊牛血清1mL,双抗0.2mL,pH7.2),O.25%胰蛋白酶5mL、7%NaHC031mL,手术剪,镊子,灭菌的培养皿,50mL三角瓶,滴管若干,链霉素小空瓶若干(加入细胞悬液培养用),高压灭菌塞子若干,培养盘,蛋座,95%酒精,水浴锅。
[实验容及操作程序]1.配液制备细胞前先在Hnak"s液中加青、链霉素,使其含量为青霉素100IU/mL,链霉素100μg/mL,用7%NaHC03调整pH至7.2~7.4,将胰蛋白酶调整pH7.6(玫瑰红色)。
置37℃水浴锅中预热备用。
2. 取胚及剪碎将胚蛋气室端向上直立于蛋座上,用碘酊消毒气室,以镊子击破卵壳并弃之,撕破卵膜揭之,继撕破绒尿膜、羊膜,取出胚胎于灭菌平皿中。
剪去头部、翅爪及脏,用Hank"s液(简称H液)洗去体表血液,移人灭菌三角瓶中,用灭菌剪刀剪碎鸡胚,使成为约1mm3大小的碎块,加5mL H液轻摇,静止1~2min,使其组织块下沉。
吸去上层悬液,依同法再洗2次,至上悬液不混浊为止,吸干H液留组织。
3.消化自水浴锅取出预热的胰酶,按组织块量约3~5倍加入三角瓶中,1个鸡胚约需5mL胰酶,三角瓶上加塞,以免CO2挥发及污染。
37℃水浴约20min 左右,每隔5min轻轻摇动1次,由于胰酶作用,使细胞与细胞之间的氨基和羧基游离,待液体变混而稍稠,此是再轻摇可见组织块悬浮在液体而不易下沉时,则需中止消化,如再继续消化下去可破坏细胞膜而不易贴壁生长,如果消化不够,则细胞不易分散。
4.洗涤取出三角瓶后静置1min,让组织块下沉后,吸去胰酶液,用10mL Hank"s液反复轻洗3次,以洗去胰酶,吸干上清液,留组织块。
5.吹打加2mL含血清的0.5%水解乳蛋白营养液或:MEM培养液,以粗口吸管反复吹吸数次,使细胞分散,此时可见营养液混浊即为细胞悬液。
鸡胚原始生殖细胞的分离培养与转基因研究的开题报告开题报告:鸡胚原始生殖细胞的分离培养与转基因研究一、研究背景鸡是世界上人类重要的畜禽之一,鸡蛋的生产和养殖已成为现代畜牧业的重要组成部分。
鸡的性成熟和繁殖是兽医学和畜牧学研究的重要方向。
而鸡胚原始生殖细胞是鸟类生殖发育研究中的重要组成部分,也是鸡的性成熟和后代繁殖的关键细胞。
因此,鸡胚原始生殖细胞的分离培养和转基因研究对鸡的养殖和生产具有重要意义。
二、研究目的本研究旨在通过对鸡胚原始生殖细胞的分离、培养和转基因研究,探索鸡的早期生殖发育和性细胞的形成机制,并进一步深入了解鸡的繁殖生物学,为提高鸡的生产效益和质量水平提供理论和实践基础。
三、研究内容1. 鸡胚原始生殖细胞的分离和培养方法的优化。
对已有的文献资料进行调研,了解各种鸡胚原始生殖细胞的分离培养方法,总结其优缺点,并优化建立一种简易、高效、稳定的鸡胚原始生殖细胞的分离和培养方法。
2. 鸡胚原始生殖细胞的转基因技术的研究。
通过利用CRISPR/Cas9基因编辑技术和表达载体介导系统,探究鸡胚原始生殖细胞内特定基因的生物功能和调控机制,为研究鸡的性发育和生殖生物学提供新思路。
3. 鸡胚原始生殖细胞的功能和特性的研究。
通过研究鸡胚原始生殖细胞的增殖、分化、凋亡、染色体组成等生物学特性,探讨其在鸟类性发育和生殖发育中的作用和重要性。
四、研究方法1. 分离和培养鸡胚原始生殖细胞。
采用组织分离法和细胞培养技术,选用适宜的培养基和生长因子等添加物,建立起高效、稳定的鸡胚原始生殖细胞的体外培养方法。
2. CRISPR/Cas9基因编辑技术和表达载体介导系统。
通过文献查阅和实验操作,学习并尝试利用CRISPR/Cas9基因编辑技术和表达载体介导系统,对鸡胚原始生殖细胞进行基因编辑和转基因操作。
3. 细胞生物学和分子生物学方法。
通过细胞增殖、分化、凋亡、染色体组成等生物学特性的检测和实验操作,探讨鸡胚原始生殖细胞的生物功能和特性。
鸡胚原代细胞培养
[实验材料]
9~10日龄鸡胚,Hank"s液50mL,0.5%水解乳蛋白液或MEM培养液
20mL(内含犊牛血清1mL,双抗0.2mL,pH7.2),O.25%胰蛋白酶5mL、7%NaHC031mL,手术剪,镊子,灭菌的培养皿,50mL三角瓶,滴管若干,链霉素小空瓶若干(加入细胞悬液培养用),高压灭菌塞子若干,培养盘,蛋座,95%酒精,水浴锅。
[实验内容及操作程序]
1.配液制备细胞前先在Hnak"s液中加青、链霉素,使其含量为青霉素
100IU/mL,链霉素100μg/mL,用7%NaHC03调整pH至7.2~7.4,将胰蛋白酶调整pH7.6(玫瑰红色)。
置37℃水浴锅中预热备用。
2. 取胚及剪碎将胚蛋气室端向上直立于蛋座上,用碘酊消毒气室,以镊子击破卵壳并弃之,撕破卵膜揭之,继撕破绒尿膜、羊膜,取出胚胎于灭菌平皿中。
剪去头部、翅爪及内脏,用Hank"s液(简称H液)洗去体表血液,移人灭菌三角瓶中,用灭菌剪刀剪碎鸡胚,使成为约1mm3大小的碎块,加5mL H液轻摇,静止1~2min,使其组织块下沉。
吸去上层悬液,依同法再洗2次,至上悬液不混浊为止,吸干H液留组织。
3.消化自水浴锅内取出预热的胰酶,按组织块量约3~5倍加入三角瓶中,1个鸡胚约需5mL胰酶,三角瓶上加塞,以免CO2挥发及污染。
37℃水浴约20min 左右,每隔5min轻轻摇动1次,由于胰酶作用,使细胞与细胞之间的氨基和羧基游离,待液体变混而稍稠,此是再轻摇可见组织块悬浮在液体内而不易下沉时,
则需中止消化,如再继续消化下去可破坏细胞膜而不易贴壁生长,如果消化不够,则细胞不易分散。
4.洗涤取出三角瓶后静置1min,让组织块下沉后,吸去胰酶液,用10mL Hank"s
液反复轻洗3次,以洗去胰酶,吸干上清液,留组织块。
5.吹打加2mL含血清的0.5%水解乳蛋白营养液或:MEM培养液,以粗口
吸管反复吹吸数次,使细胞分散,此时可见营养液混浊即为细胞悬液。
静置1min,使未冲散的组织块下沉后,小心地将细胞悬液吸出1mL于20mL营养液中,此液细胞数约50万~70万/mL。
如需大量细胞,可继续加营养液冲打,一个鸡胚约可做100mL细胞悬液。
6.细胞计数取上述细胞悬液0.5mL加入0.1%结晶紫一柠檬酸(0.1mol/L)
溶液2mL,置室温或37℃温箱中5~10min,充分振动混合后,用毛细管吸取滴人血细胞计数板内,在显微镜下计数。
计数方法按白细胞计数法,计算四角大格内完整细胞的总数。
如3~5个聚集在一起,则按1个计算,然后将细胞总数按下法换算成每毫升中的细胞数。
细胞数/mL=4大格细胞总数/4×10 000×稀释倍数
例如:4大格的细胞总数为284个,而稀释倍数为5(0.5mL染色液),则每毫升细胞悬液的细胞数为284/4×10 000×5=3.5×104个。
7.稀释按照每毫升50万~70万个细胞密度的标准,将细胞悬液用营养液稀释之。
(计数时,可见到大部分细胞完整分散,3~5个细胞成堆,且细胞碎片很少,说
明消化适度;如分散细胞少,则消化不够;如细胞碎片多,则消化过度。
)
活细胞计数法取2%台盼蓝溶液1滴,细胞悬液1滴,混合计数,活细胞不着色,死细胞呈蓝色。
8.分装培养分装于链霉素瓶中,每瓶约1mL,瓶口橡皮塞要塞紧。
不合适者弃去,以免漏气造成污染或C02跑掉而营养液变碱。
将细胞瓶横卧于培养盘中,于瓶上面划一直线,以表示直线的对侧面为细胞在瓶内的生长位置。
瓶上注明组别、日期,置37℃温箱培养,4h后细胞即可贴附于瓶壁,24~36h生长成单层细胞,此时可吸去培养液,更换维持液,并接种病毒。
附:细胞培养所需的常用培养基与试剂
1.Hank’s液配制
原液甲
NaCl 8g
KCl 2g
MgSO4·7H20 2g
MgCl2·6H20 2g
2.8%CaCl2 100mL
双蒸水加至1 000mL
先将固体成分加于800mL双蒸水中,加温到50~60℃加速溶解,再加入CaCl2溶液,最后加双蒸水补足到1 000mL。
加氯仿2mL,摇匀后于4℃贮存。
原液乙
Na2HPO4·2H20 1.2g
KH2PO4·2H20 1.2g
葡萄糖20g
0.4%酚红lOOmL
双蒸水加:1 000mL
将上列各物混合后使其溶解,加氯仿2mL,摇匀后于4℃贮存。
Hank"s工作液
原液甲1份
原液乙1份
双蒸水18份
工作液分装100mL,或500mL盐水瓶中,115~C灭菌10min,使用前以7%NaHCO3调节
pH至0 7.2~7.6。
2.0.4%酚红溶液配制
酚红0.4g
0.1%NaOH溶液11.28mL
将酚红置于研钵中,加磨边缓缓加NaOH溶液,直到所有颗粒完全溶解,置于至
lOOmL量杯中,最后加双蒸水至lOOmL,摇匀后,保存于4℃冰箱内备用。
3. 0.5%乳蛋白水解物溶液配制
乳蛋白水解物5g
Hank"s液l 000mL
将乳蛋白水解物放入1 000mL Hank"s液中,待完全溶解后,摇匀分装于lOOmL 的盐水瓶中,每瓶95mL,115℃lOmin灭菌,4℃贮存备用。
4.营养液(生长液)配制
O.5%乳蛋白水解物95mL
犊牛血清5mL
青霉素、链霉素lmL
将上述溶液混合后,以7%NaHCO3适量调节pH到7.2~7.4。
维持液按上述方法,加
犊牛血清2.5mL即成。
5.MEM培养液MEM培养基一袋,加1 000mL双蒸水,过滤除菌或高压灭菌,分装于100ml盐水瓶中,每瓶90ml,用前以7%NaHC03调pH到7.2~7.4,并加10%犊牛血
清。
6.双抗配制
青霉素100万IU
链霉素1g
Hank"s液100mL
将青、链霉素溶解于:100mL Hank"s溶液中,此为双抗溶液,无菌操作,分装小瓶,每瓶:lmL,内含有青霉素IIU,链霉素10000μg,低温冻结保存。
使用时每100mL营养液中加双抗lmL,即每mL营养液中含青霉素100IU,链霉素
100gμg。
7. 7%NaHCO3溶液配制
NaHCO3 7g
双蒸水100mL
将NaHC03溶于双蒸水中,置水浴锅中加热溶解,115℃10min灭菌后,无菌操作分装
小瓶,每瓶lmL,4℃保存。
8. 0.25%胰蛋白酶配制
胰蛋白0.25g
Hang’s液100mL
将胰蛋白酶溶于Hank"s液中,待完全溶解后,用0.2μm滤膜过滤,检验无菌后才能使用。
无菌分装小瓶,每瓶5mL,低温冻结保存。
使用时,以7%NaHC03调节pH到7.6-7.8。