2019年初中化学学业水平考试总复习第九单元溶液第2课时溶解度及溶解度曲线练习(1)
- 格式:doc
- 大小:382.50 KB
- 文档页数:7

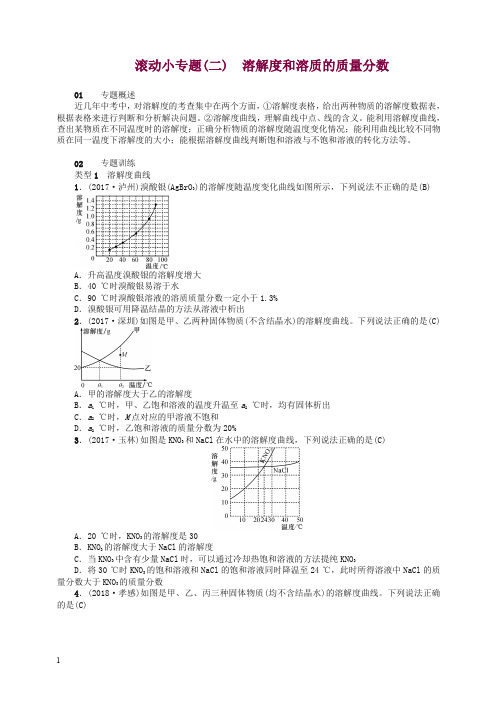
滚动小专题(二) 溶解度和溶质的质量分数01专题概述近几年中考中,对溶解度的考查集中在两个方面,①溶解度表格,给出两种物质的溶解度数据表,根据表格来进行判断和分析解决问题。
②溶解度曲线,理解曲线中点、线的含义。
能利用溶解度曲线,查出某物质在不同温度时的溶解度;正确分析物质的溶解度随温度变化情况;能利用曲线比较不同物质在同一温度下溶解度的大小;能根据溶解度曲线判断饱和溶液与不饱和溶液的转化方法等。
02专题训练类型1溶解度曲线1.(2017·泸州)溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是(B)A.升高温度溴酸银的溶解度增大B.40 ℃时溴酸银易溶于水C.90 ℃时溴酸银溶液的溶质质量分数一定小于1.3%D.溴酸银可用降温结晶的方法从溶液中析出2.(2017·深圳)如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确的是(C)A.甲的溶解度大于乙的溶解度B.a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出C.a2℃时,M点对应的甲溶液不饱和D.a2℃时,乙饱和溶液的质量分数为20%3.(2017·玉林)如图是KNO3和NaCl在水中的溶解度曲线,下列说法正确的是(C)A.20 ℃时,KNO3的溶解度是30B.KNO3的溶解度大于NaCl的溶解度C.当KNO3中含有少量NaCl时,可以通过冷却热饱和溶液的方法提纯KNO3D.将30 ℃时KNO3的饱和溶液和NaCl的饱和溶液同时降温至24 ℃,此时所得溶液中NaCl的质量分数大于KNO3的质量分数4.(2018·孝感)如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
下列说法正确的是(C)2A .甲和丙的溶解度相等B .在t 2 ℃时,将28 g 甲物质加入到50 g 水中,充分溶解后所得溶液的质量为78 gC .将t 2 ℃时,甲的饱和溶液降温到t 1℃,有晶体析出D .将t 1℃时,甲、乙、丙三种物质的饱和溶液升温至t 2 ℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>乙>丙5.(2017·重庆A 卷)两个烧杯中分别盛装X 、Y 的饱和溶液,两支试管中分别装有NaOH 和NH 4NO 3固体,向两支试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是(D)A .Y 的溶解度曲线为b 曲线B .降温可使X 的饱和溶液变浑浊C .X 的饱和溶液从t 2 ℃降温到t 1 ℃,溶质的质量分数变大D .t 3 ℃时,X 、Y 的饱和溶液质量相等,则溶剂质量X >Y6.如图是甲、乙两种物质的溶解度曲线。


课题2溶解度第1课时饱和溶液判断正误:(在括号内打“√”或“×”)(1)饱和溶液就是不能再溶解任何物质的溶液()(2)析出晶体后的溶液是该晶体在该温度下的饱和溶液()(3)同种溶质的饱和溶液,一定比它的不饱和溶液的浓度大()(4)升温能使接近饱和的KNO3溶液变成饱和溶液()(5)在一定温度下,使固体物质的饱和溶液变为不饱和溶液最可靠的方法是加入溶质或蒸发溶剂()(6)通常采取降温结晶的方法得到食盐()[核心知识]1.饱和溶液三要素:一定温度、一定量溶剂、不能再继续溶解该溶质。
2.一般情况下饱和溶液与不饱和溶液的转化关系:不饱和溶液饱和溶液注意:Ca(OH)2在上述过程中温度的改变方向相反。
3.结晶方法:(1)蒸发结晶(蒸发溶剂);(2)降温结晶(冷却热饱和溶液)。
[易错点拨]溶液中如果没有溶质固体存在,溶液可能饱和,也可能不饱和。
1.下列关于溶液的说法正确的是 ()A.将饱和溶液升温后一定变为不饱和溶液B.溶液一定是混合物C.稀溶液一定是不饱和溶液D.饱和溶液所含溶质一定比不饱和溶液多2.如,将红砂糖倒入一杯开水中,充分溶解。
能作为判断砂糖水是饱和溶液的依据是()A.砂糖水颜色很深B.砂糖水味道很甜C.砂糖溶解得很快D.砂糖固体有剩余3.能将不饱和KCl溶液变为饱和KCl溶液的方法是()A.升高温度B.加水C.加KCl固体D.倒出部分溶液4.下列关于海水晒盐原理的分析正确的是 ()A.利用阳光照射,使海水升温可得到食盐B.利用海风降温可析出食盐晶体C.利用海水在阳光下发生分解反应可制得食盐D.利用阳光和风力使水分蒸发可得到食盐5.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中(如所示),欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是()A.生石灰B.氯化钠C.硝酸铵D.氢氧化钠6.将50 ℃的硝酸钠饱和溶液降温到20 ℃,有晶体析出(晶体中不含水)。
下列有关量中没有发生改变的是()A.溶液的质量B.溶液中溶质的质量C.溶液中溶剂的质量D.溶液中溶质的质量与溶液的质量比7.在萝卜上挖一个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,向倒出的食盐水中加足量食盐使之饱和(设温度不变),则食盐水的质量 ()A.增加B.减小C.不变D.无法判断8.某次蔗糖溶解实验过程如所示,不考虑水分蒸发,下列判断错误的是()A.②中溶液是饱和溶液B.③中溶液一定是不饱和溶液C.若要判断③中溶液是否饱和,可在烧杯中加入少量蔗糖D.③中溶液的溶质质量大于②中溶液的溶质质量9.20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解,然后分别称量剩余NaCl的质量。


第2课时 溶解度及溶解度曲线考点一 饱和溶液与不饱和溶液例1 (2012·德州中考)室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%),另一瓶为10%的溶液,下列实验操作中,无法区分这两种溶液的是( )A.加一定量水B.加入少量硝酸钾固体C.略降低温度D.室温时蒸发少量水A【思路分析】 在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液是该物质的饱和溶液;还能继续溶解的溶液,为该物质的不饱和溶液;硝酸钾的溶解度随温度的降低而减小,硝酸钾的饱和溶液降温后,会析出晶体,据此进行判断。
1.(2018·淄博中考)在20 ℃时,某固体物质(不含结晶水)的水溶液,经历如下变化B下列说法你认为正确的( )A.溶液甲是饱和溶液B.20 ℃时,该固体物质的溶解度是40 gC.溶液丙若蒸发10 g水,析出的晶体一定大于4 g D.溶液乙溶质的质量分数小于溶液丙溶质的质量分数考点二 溶解度溶解度的几组数据:例2 (2012·德州中考)以下是有关CO2在某些溶剂中的溶解度(单位:mL/g)①一个标准大气压时CO2②CO在水中的溶解度(单位:mL/g)2请根据数据分析:(1)影响CO 2的溶解度的因素有_________、_____和_____。
(2)根据CO 2在水中的溶解度表,简单说明外界条件是如何影响气体溶解度的?______________________________________________________________________。
溶剂种类温度压强由图中数据可知二氧化碳的溶解度随温度的升高而减小,随压强的增大而增大(3)打开汽水瓶有CO2气体溢出,说明瓶中的压强_____(填“大于”“小于”或“等于”)瓶外大气压强。
(4)如果用排水集气法收集CO2时,可采取___________的措施。
大于排热水收集【思路分析】 (1)根据题中提供的第一个表格可分析出溶溶解度的影响,根据第二个表格可分析出压强剂和温度对CO2溶解度的影响。
九年级化学下册:课题二溶解度同步测试一、单选题(共15题;共30分)1.下列关于溶液的叙述中正确的是()A. 饱和溶液降温后一定能析出晶体B. 饱和溶液升温后一定能析出晶体C. 溶液只有达到饱和后才有可能析出晶体D. 溶液不达到饱和也能析出晶体2.温度不变时,向一定量的饱和硝酸钾溶液中加入少量硝酸钾固体,则此饱和溶液的质量A. 增加B. 减少C. 不变D. 无法确定3.在配制硝酸钾溶液的过程中,下列操作不能加快硝酸钾溶解速率的是()A. 将水的温度从20℃升高到60℃B. 将硝酸钾固体研磨成粉末C. 在加入硝酸钾的同时不断搅拌D. 增大压强4.下列关于二氧化碳的认识中,不正确的是A. 在地窖、枯井内二氧化碳的含量比较高B. 二氧化碳在水中溶解的量跟压强成反比C. 温室效应与空气中二氧化碳的含量有关D. 可用二氧化碳制作碳酸饮料5.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是()A. 氢氧化钠B. 生石灰C. 浓硫酸D. 硝酸铵6.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法正确的是()A. 甲的溶解度比乙的溶解度高B. 在t1℃时,甲溶液和乙溶液的溶质质量分数相等C. 在t1℃时,100g甲物质的饱和溶液中溶质的质量是25gD. 在t2℃时,欲将N点的甲物质溶液变为饱和溶液可采用恒温蒸发水的方法7.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述一定正确的是( )A. 甲的溶解度大于乙的溶解度B. 10 ℃时甲、乙两溶液的质量分数相等C. 30 ℃时甲的饱和溶液的质量分数为60%D. 降低温度可使接近饱和的甲溶液变成饱和溶液8.比较食盐和蔗糖在水中的溶解性,必须控制的条件是()A. 温度相同B. 水的质量相等C. 食盐和蔗糖质量相等D. 食盐和蔗糖颗粒大小相同9.20℃时,往50g硝酸钾溶液中加5g硝酸钾晶体搅拌后,尚有部分晶体未溶解,稍加热后晶体全部溶解,下列说法正确的是()A. 搅拌后,加热前一定是饱和溶液B. 搅拌后,加热前一定是不饱和溶液C. 加热后一定是饱和溶液D. 加热后一定是不饱和溶液10.如图所示曲线分别表示X、Y、Z三种物质的溶解度曲线。
第2课时溶解度及溶解度曲线姓名:________ 班级:________ 限时:______分钟1.(2019·易错题)下列有关溶液的说法正确的是( )A.不饱和溶液转化为饱和溶液溶质的质量分数一定变大B.同种溶质的饱和溶液一定比其不饱和溶液溶质的质量分数大C.饱和溶液转化为不饱和溶液,溶液的质量一定增大D.饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变2.(2018·上海模拟改编)如图是恒温下模拟海水晒盐的过程示意图,根据图示判断正确的是( )A.甲烧杯的溶液可能是饱和溶液B.乙烧杯的溶液一定是饱和溶液C.丙和丁溶液中溶质质量分数相同D.甲、乙烧杯中的溶液溶质的质量分数可能相同3.(2018·宁波中考)20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。
记录数据如下表:实验小组第一组第二组第三组第四组水的质量/g50 50 50 50 所取NaCl的质量/g15 20 25 30剩余NaCl的质量/g0 2 7 12下列说法错误的是( )A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaClB.用蒸发的方法可以使不饱和溶液变成饱和溶液C.第二组所得溶液的溶质与溶剂的质量比为9∶25D.相同温度下,NaCl在水里的溶解度与水的质量无关4.(2017·威海中考)小龙同学在工具书中查到NaOH在水和酒精中的溶解度(如表所示)。
通过分析她得出以下结论,其中不正确的是( )温度20 ℃40 ℃水109 g 129 g酒精17.3 g 40 gA.温度和溶剂种类对NaOH的溶解度都有影响B.NaOH易溶于水,也易溶于酒精C.40 ℃时,40 g NaOH溶解在100 g酒精中能达到饱和D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多5.(2018·东营模拟)硫酸钠是一种重要的化工原料,其溶解度曲线如图所示。
巧用溶解度曲线在九年级化学第九单元第 2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。
利用溶解度曲线可以解决很多的问题技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
×100%,溶解度S越大质量分数越大。
(质量分数最大的2、某温度下某饱和溶液的质量分数=S100g+S是该温度下的饱和溶液)特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效法)×100%3、线上的点及线下的点表示的溶液的质量分数=S纵S纵+100g技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B的质量分数为。
(3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。
此时溶液C中氯化钾的质量分数为。
溶解度曲线的规律试题原型右图是a、b两种固体物质的溶解度曲线。
(1)从图中你能获得的信息是(答出两条即可):_____________________________________________;_____________________________________________。
(2)40℃时,a物质的饱和溶液中溶质和溶剂的质量比是________。
解析本题主要考查溶解度和溶解度曲线意义。
40℃时a物质的溶解度为60g,则该温度下,a物质饱和溶液中溶质与溶剂的质量比为60g﹕100g=3﹕5。
答案(1)a、b两种物质的溶解度随温度的升高而增大;30℃时a、b两种物质的溶解度相等(或30℃以上时,a物质的溶解度比b物质的溶解度大;或30℃以下时,a物质的溶解度比b物质的溶解度小;或30℃时,a、b两种物质的溶解度均为40g等,只要合理即可) (2)3﹕5变式题1固体物质R在水、乙醇两种溶剂中的溶解度曲线如右图所示。
下列说法正确的是( )A.物质R在水中的溶解度大于在乙醇中的溶解度B.t1℃时,物质R在水中和在乙醇中的溶解度都为2gC.将t2℃时物质R在水中的饱和溶液降温至t1℃,有晶体析出D.物质R在水中的溶解度与在乙醇中的溶解度相比较,前者受温度变化影响很小解析t2℃时,物质R在水和乙醇中的溶解度相同,温度低于t2℃时,物质R的溶解度在水中比在乙醇中要小,温度高于t2℃时,物质R的溶解度在水中比在乙醇中要大,A错误;t1℃时,物质R在水中的溶解度为2g,而在乙醇中的溶解度大于2g,B错误;在水中,物质R的溶解度随温度的升高而明显增大,因此将t2℃时物质R在水中的饱和溶液降温至t1℃,会有晶体析出,C正确;物质R在水中的溶解度与在乙醇中的溶解度相比较,后者受温度变化影响较小,D错误。
答案C变式题2 下图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:(1)t2℃时,A、B、C三种物质的溶解度大小关系是____________。
第2课时溶解度及溶解度曲线
姓名:________ 班级:________ 限时:______分钟
1.(2019·易错题)下列有关溶液的说法正确的是( )
A.不饱和溶液转化为饱和溶液溶质的质量分数一定变大
B.同种溶质的饱和溶液一定比其不饱和溶液溶质的质量分数大
C.饱和溶液转化为不饱和溶液,溶液的质量一定增大
D.饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变
2.(2018·上海模拟改编)如图是恒温下模拟海水晒盐的过程示意图,根据图示判断正确的是( )
A.甲烧杯的溶液可能是饱和溶液
B.乙烧杯的溶液一定是饱和溶液
C.丙和丁溶液中溶质质量分数相同
D.甲、乙烧杯中的溶液溶质的质量分数可能相同
3.(2018·宁波中考)20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。
记录数据如下表:
下列说法错误的是( )
A.20℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
4.(2017·威海中考)小龙同学在工具书中查到NaOH在水和酒精中的溶解度(如表所示)。
通过分析她得出以下结论,其中不正确的是( )
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃时,40 g NaOH溶解在100 g酒精中能达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,析出的晶体前者比后者多
5.(2018·东营模拟)硫酸钠是一种重要的化工原料,其溶解度曲线如图所示。
下列说法正确的是( )
A.硫酸钠的溶解度随温度升高而增大
B.30℃时硫酸钠饱和溶液的质量分数为40%
C.40℃时硫酸钠的溶解度约为50 g
D.50℃时硫酸钠饱和溶液降温后一定饱和
6.(2017·临沂中考)甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是( )
A.20℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B.将40℃时甲的一定量饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.40℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液7.(2018·扬州中考)KNO3与KCl的溶解度曲线如图所示。
下列说法正确的是( )
A.KNO3的溶解度比KCl的溶解度大
B.t1温度下的KCl的饱和溶液升温至t2,有晶体析出
C.A点所表示的KCl饱和溶液溶质的质量分数为29%
D.冷却热的KNO3饱和溶液可获得KNO3晶体
8.(2018·咸宁中考)在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。
下列说法错误的是( )
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
9.(2018·济南商河二模)如图是甲、乙两种不含结晶水的固体物质的溶解度曲线。
根据图示判断,下列有关说法中,不正确的是( )
A.在t1℃时,甲物质的饱和溶液升温到t2℃时,溶液不变浓
B.将t1℃时,乙物质的饱和溶液升温,会析出晶体
C.在t2℃时,160 g甲物质的饱和溶液中含有甲60 g
D.在t2℃时,乙溶液的溶质质量分数小于甲溶液的溶质质量分数。