最新中学化学竞赛辅导课件+《有机化学部分》word版本
- 格式:ppt
- 大小:879.00 KB
- 文档页数:61

第四节二烯烃分子中含有两个或两个以上碳碳双键的不饱和烃称为多烯烃。
二烯烃的通式为C n H2n-2。
一、二烯烃的分类和命名依据二烯烃中两个双键的相对位置的不同,可将二燃烃分为三类:1、累积二烯烃两个双键与同一个碳原子相连接,即分子中含有C=C=C结构的二烯烃称为累积二烯烃。
例如:丙二烯 CH2=C=CH2。
2、隔离二烯烃两个双键被两个或两个以上的单键隔开,即分子骨架为C=C-(C)n-C=C 的二烯烃称为隔离二烯烃。
例如,1、4-戊二烯 CH2=CH-CH2-CH=CH2。
3、共轭二烯烃两个双键被一个单键隔开,即分子骨架为C=C-C=C的二烯烃为共轭二烯烃。
例如,1,3-丁二烯 CH2=CH-CH=CH2。
本节重点争辩的是共轭二烯烃。
二烯烃的命名与烯烃相像,选择含有两个双键的最长的碳链为主链,从距离双键最近的一端经主链上的碳原子编号,词尾为“某二烯”,两个双键的位置用阿拉伯数字标明在前,中间用短线隔开。
若有取代基时,则将取代基的位次和名称加在前面。
例如:CH2=C(CH3)CH=CH2 2-甲基-1,3-丁二烯CH3CH2CH=CHCH2CH(CH2)4CH3 3,6-十二碳二烯二、共轭二烯烃的结构1,3-丁二烯分子中,4个碳原子都是以SP2杂化,它们彼此各以1个SP2杂化轨道结合形成碳碳σ键,其余的SP2杂化轨道分别与氢原子的S轨道重叠形成6个碳氢σ键。
分子中全部σ键和全部碳原子、氢原子都在一个平面上。
此外,每个碳原子还有1个末参与杂化的与分子平面垂直的P轨道,在形成碳碳σ键的同时,对称轴相互平行的4个P轨道可以侧面重叠形成2个π键,即C1与C2和C3与C4之间各形成一个π键。
而此时C2与C3两个碳原子的P轨道平行,也可侧面重叠,把两个π键连接起来,形成一个包含4个碳原子的大π键。
但C2-C3键所具有的π键性质要比C1-C2和C3-C4键所具有的π键性质小一些。
像这种π电子不是局限于2个碳原子之间,而是分布于4个(2个以上)碳原子的分子轨道,称为离域轨道,这样形成的键叫离域键,也称大π键。



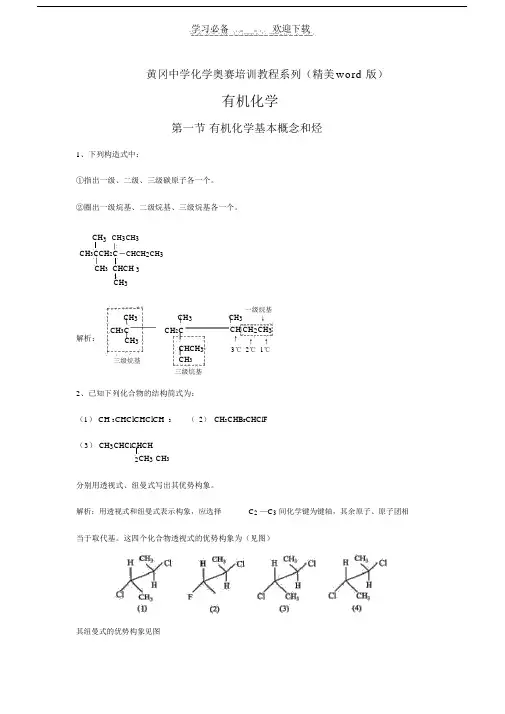
学习必备 欢迎下载黄冈中学化学奥赛培训教程系列(精美 word 版)有机化学第一节 有机化学基本概念和烃1、下列构造式中:①指出一级、二级、三级碳原子各一个。
②圈出一级烷基、二级烷基、三级烷基各一个。
CH 3 CH 3CH 3 CH 3CCH 2C CHCH 2CH 3CH 3 CHCH 3CH 3CH 3 CH 3 CH 3 一级烷基↓解析: CH 3CCH 2CCH CH 2CH 3CH 3CHCH 3↑ ↑ ↑3℃ 2℃ 1℃三级烷基CH 3三级烷基2、已知下列化合物的结构简式为: (1) CH 3CHClCHClCH 3 ( 2) CH 3CHBrCHClF( 3) CH 3CHClCHCH2CH 3 CH 3分别用透视式、纽曼式写出其优势构象。
解析:用透视式和纽曼式表示构象,应选择C 2 —C 3 间化学键为键轴,其余原子、原子团相当于取代基。
这四个化合物透视式的优势构象为(见图)其纽曼式的优势构象见图3、( 2000 年广东省模拟题)用烃 A 分子式为C10H16,将其进行臭氧化后,水解得到HCHO 和 A 催化加氢后得烃B, B 化学式为 C10H20,分子中有一个六元环,用键线式写出A,B 的结构。
解析:从 A 催化加氢生成的 B 的化学式可推知,原 A 分子中有两个C=C 键和一个六元环。
从水解产物可知, C1与 C6就是原碳环连接之处HCHO 的羰基,只能由C3支链上双键臭氧化水解生成。
所以 A 的结构为, B 的结构为。
4、下列化合物若有顺反异构,写出异构体并用顺、反及E、 Z 名称命名。
5、(河南省98 年竞赛题)写出符合C6H10的所有共轭二烯烃的异构体,并用E—Z命名法命名。
解析:6、用化学方法鉴别下列化合物:CH 3CH2CH2CH3,CH 3CH 2CH=CH 2, CH 3CH 2C≡ CH 。
解析:( 1)用 Br 2, CH 3CH 2CH=CH 2与 CH 3CH2 C≡ CH 可褪色, CH 3CH 2CH 2CH 3不反应。


第 1 页 共 6 页第七章 醛、酮一、结构、分类和命名醛和酮都是含有羰基官能团的化合物。
当羰基与一个羟基和一个氢原子相结合时就是醛,醛基的简写为-CHO 。
若羰基与两个烃基相结合,就是酮,酮分子中的羰基叫做酮基。
醛、酮的通式为:醛: 酮:结构:醛、酮羰基中的碳原子为SP 2杂化,而氧原子则是末经杂化的。
碳原子的三个SP 2杂化轨道相互对称地分布在一个平面上,其中之一与氧原子的2P 轨道在键轴方向重叠构成碳氧σ键。
碳原子末参加杂化的2P 轨道垂直于碳原子三个SP 2杂化轨道所在的平面,与氧原子的另一个2P轨道平等重叠,形成π键,即碳氧双键也是由一个σ键和一个π键组成。
由于氧原子的电负性比碳原子大,羰基中的π电子云就偏向于氧原子,羰基碳原子带上部分正电荷,而氧原子带上部分负电荷。
分类:根据烃基的不同可以分为脂肪醛酮、芳香醛酮。
根据羰基的个数可以分为一元醛酮、多元醛酮。
命名:普通命名法:醛的命名与醇的习惯命名法相似,称某醛。
如:CH 3CH 2OH CH 3CHO 乙醇 乙醛CH 3CH (CH 3)CH 2OH CH 3CH (CH 3)CHO异丁醇 异丁醛脂肪酮则按酮基所连接的两个烃基而称为某(基)某(基)酮。
例如:CH 3OCH 3 CH 3COCH 3甲醚 二甲酮CH 3OCH 2CH 3 CH 3COCH 2CH 3甲乙醚 甲乙酮系统命名法:选择含有羰基的最长碳链作为主链,称为某醛或某酮。
由于醛基是一价原子团,必在链端,命名时不必用数字标明其位置。
酮基的位置则需用数字标明,写在“某酮”之前,并用数字标明侧链所在的位置及个数,写在母体名称之前。
例如:CH 3CH (CH 3)CHO CH 3CH 2COCH (CH 3)CH 2CH 32-甲基丙醛 4-甲基-3-已酮CH 3CH ═CHCHO CH 3CH (CH 3)CH ═CHCOCH 32-丁烯醛 5-甲基-3-已烯-2-酮环已基甲醛 3-甲基环已酮3-苯丙烯醛 1-苯-2-丁酮醛酮命名时习惯上还采用希腊字母α、β、γ等,α碳指与醛基或酮基直接相连的碳原子。

第二节 羰基酸一、分类和命名分子中既含有羰基又含有羧基的化合物称为羰基酸。
根据所含的是醛基还是酮基,将其分为醛酸和酮酸。
羰基酸的命名与醇酸相似,也是以羧酸为母体,羰基的位次用阿拉伯数字或用希腊字母表示。
如:OHC ─COOH CH 3COCOOH CH 3COCH 2COOH乙醛酸 丙酮酸 3-丁酮酸(β-丁酮酸)二、化学性质酮酸具有酮和羧酸的一般性质,如与氢或亚硫酸氢钠加成、与羟胺生成肟、成盐和酰化等。
由于两种官能团的相互影响,α-酮酸和β-酮酸又有一些特殊的性质。
(一)α-酮酸的性质1、脱羧和脱羰反应在α-酮酸分子中,羰基与羧基直接相连,由于羰基和羧基的氧原子都具有较强的吸电子能力,使羰基碳与羧基碳原子之间的电子云密度降低,所以碳碳键容易断裂,在一定条件下可发生脱羧和脱羰反应。
α-酮酸与稀硫酸或浓硫酸共热,分别发生脱羧和脱羰反应生成醛或羧酸。
RCOCOOH + 稀H 2SO 4 RCHO + CO 2↑ RCOCOOH + 浓H 2SO 4 RCOOH + CO ↑ 2、氧化反应α-酮酸很容易被氧化,托伦试剂就能其氧化成羧酸和二氧化碳。
RCOCOOH + [Ag(NH 3)2]+ RCOONH 4 + Ag ↓(二)β-酮酸的性质 在β-酮酸分子中,由于羰基和羧基的吸电子诱导效应的影响,使α-位的亚甲基碳原子电子云密度降低。
因此亚甲基与相邻两个碳原子间的键容易断裂,在不同的反应条件下,能发生酮式和酸式分解反应。
1、酮式分解β-酮酸在高于室温的情况下,即脱去羧基生成酮。
称为酮式分解。
RCOCH 2COOH RCOCH 3 + CO 2↑ 2、酸式分解β-酮酸与浓碱共热时,α-和β-碳原子间的键发生断裂,生成两分子羧酸盐。
称为酸式分解。
RCOCH 2COOH + 40℅NaOH RCOONa + CH 3COONa三、乙酰乙酸乙酯及酮式-烯醇式互变异构现象1、乙酰乙酸乙酯的制备在醇钠的催化作用下,两分子乙酸乙酯脱去一分子乙醇生成乙酰乙酸乙酯,此反应称为克莱森酯缩合反应。



第十一章 有机含氮化合物第一节 硝基化合物一、分类、命名法硝基(NO 2-)取代烃分子中的氢原子所成的化合物称为硝基化合物。
硝基是它的官能团。
按烃基的不同,硝基化合物可分为:脂肪族硝基化合物(RNO 2),例如:CH 3NO 2 硝基甲烷、CH 3CH 2NO 2 硝基乙烷。
芳香族硝基化合物(Ar-NO 2),例如: 硝基苯 β-硝基萘根据硝基所连的碳原子的不同,硝基化合物可分为:伯硝基化合物,例如: CH 3CH 2NO 2 硝基乙烷。
仲硝基化合物,例如:CH 3CH(NO 2)CH 3 2-硝基丙烷叔硝化化合物,例如: 2-甲基-2-硝基丙烷 根据硝基的个数,硝基化合物可分为:一元硝基化合物,例如: CH 3CH 2NO 2 硝基乙烷。
多元硝基化合物,例如:NO 2CH 2CH 2NO 2 二硝基乙烷命名硝基化合物时以烃为母体,硝基作为取代基,例如:2,2-二甲基-4-硝基戊烷 2-硝基-4-氯苯甲酸2,4,6-三硝基甲苯(TNT)2,4,6-三硝基苯酚(苦味酸)二硝酸乙二酯 二、物理性质脂肪族硝基化合物多数是油状液体,芳香族硝基化合物除了硝基苯是高沸点液体外,其余多是淡黄色固体,有苦仁气味,味苦。
不溶于水,溶于有机溶剂和浓硫酸(形成 盐)。
硝基具有强极性,所以硝基化合物是极性分子,有较高的沸点和密度。
随着分子中硝基数目的增加,其熔点、沸点和密度增大、苦味增加,对热稳定性减少,受热易分解爆炸(如TNT 是强烈的炸药)。
多数硝基化合物有毒,在贮存和使用硝基化合物时应注意。
三、化学性质1、 还原反应硝基化合物易被还原,芳香族硝基化合物在不同的还原条件下得到不同的还原产物。
例如在NO 2NO 2NO 2CH 3CH 3CH 3C NO 2CH 3CH 3CH 3CH C CH 2CH 3NO 2Cl COOHNO 2CH 3NO 2NO 2NO 2NO 2NO 2OH NO 2CH 2NO 2CH 2O O酸性介质中以铁粉还原,最后生成芳香族伯胺;在中性条件中以锌粉还原得到氢化偶氮化合物;在碱性条件中以锌粉还原得到联苯胺。
高中化学竞赛大学有机化学课件6(附加条款版)高中化学竞赛大学有机化学课件6一、引言化学竞赛作为高中阶段学生提高化学素养、培养化学思维的重要途径,一直受到广泛关注。
有机化学作为化学竞赛的重要组成部分,对于参赛选手来说至关重要。
本课件旨在帮助高中化学竞赛选手更好地掌握大学有机化学知识,提高竞赛成绩。
二、有机化学基本概念1.有机化合物:含有碳元素的化合物,通常与生命活动密切相关。
2.有机反应:有机化合物在一定条件下发生的化学变化,包括合成、分解、取代、加成等。
3.有机化合物结构:碳原子之间的成键方式,包括单键、双键、三键以及环状结构等。
4.有机化合物的分类:根据分子结构、官能团、反应类型等不同特点进行分类。
三、有机化学基本反应1.烷烃的卤代反应:烷烃与卤素单质在光照条件下发生取代反应,卤代烷。
2.烯烃的加成反应:烯烃与卤素单质、水、卤化氢等发生加成反应,卤代烷、醇等化合物。
3.炔烃的加成反应:炔烃与卤素单质、水、卤化氢等发生加成反应,卤代烷、醛、羧酸等化合物。
4.醇的氧化反应:醇在酸性条件下与氧化剂如酸性高锰酸钾、铬酸等反应,醛、酮等化合物。
5.醛、酮的还原反应:醛、酮与还原剂如氢气、锂铝氢化剂等反应,醇。
6.羧酸的酯化反应:羧酸与醇在酸性条件下反应,酯。
7.芳香烃的取代反应:芳香烃在一定条件下与取代基发生取代反应,取代芳香烃。
四、有机化学合成策略1.反应途径的选择:根据目标产物的结构特点,选择合适的反应途径。
2.反应条件的优化:通过调整反应温度、压力、催化剂等条件,提高反应产率和选择性。
3.保护基的应用:在合成过程中,通过引入保护基,保护敏感官能团,提高反应可控性。
4.反应顺序的安排:合理安排反应顺序,避免不必要的副反应,提高合成效率。
五、有机化学竞赛实例分析1.合成题目分析:分析题目所给的反应物和产物,确定反应类型和合成路线。
2.反应机理探讨:根据反应类型,推导反应机理,理解反应过程。
3.实验操作注意事项:分析实验操作步骤,注意实验安全,提高实验技能。