全国高中生化学竞赛专题辅导有机化学一同分异构现象
- 格式:ppt
- 大小:5.73 MB
- 文档页数:150

第五章 卤代烃烃分子中一个氢或几个氢被卤素取代所生成的化合物叫卤代烃。
一般用RX 表示,常见卤代烃是指氯代烃、溴代烃和碘代烃。
一、分类、命名和同分异构体根据烃基的不同,将卤代烃分为脂肪族卤代烃和芳香族卤代烃。
按卤素直接连接的碳原子不同,可以将卤代烃分为:伯卤代烃、仲卤代烃和叔卤代烃,分别以1ºRX 、2ºR 2CHX 、3ºR 3CX 表示。
如:伯卤代烃:卤素原子所连的碳原子是伯碳原子。
如:CH 3CH 2Cl仲卤代烃:卤素原子所连的碳原子是仲碳原子。
如:(CH 3)2CHCl叔卤代烃:卤素原子所连的碳原子是叔碳原子。
如:(CH 3)3CCl根据卤代烃分子中卤原子数目不同,卤代烃又可分为一卤代烃和多卤代烃。
简单卤代烃,可根据卤素所连烃基名称来命名,称卤某烃。
有时也可以在烃基之后加上卤原子的名称来命名,称某烃基卤。
如:CH 3Br CH 2=CHCl CH 3CHICH 3溴甲烷 氯乙烯 碘异丙烷甲基溴 乙烯基氯 异丙基碘复杂的卤烃采用系统命名法,选择含有卤素的最长的碳链作主链,根据主链碳原子数称“某烷”,卤原子和其它侧链为取代基,主链编号使卤原子或取代基的位次最小。
例如: CH 3CHClCH(CH 3)2 2-氯-甲基丁烷CH 3CHBrCH 2CH 2CHBrCH(CH 2CH 3)2 2,5-二溴-6-乙基辛烷不饱和卤代烃的主链编号,要使双键或叁键位次最小。
例如:CH 2═CHCH 2CH 2Cl 4-氯-1-丁烯CH 3CBr ═CHCH ═CH 2 4-溴-1,3-戊二烯卤代芳烃一般以芳烃为母体来命名,如: 邻-氯乙苯 1-溴-6-甲萘 间-溴甲苯二、卤代烃的制备1、烷烃的卤代烷烃在紫外光照射或高温条件下,可以直接发生卤代而生成卤代烃,产物为一元和多 元卤代烃的混合物,如: CH 3CH 3 + Cl 2 CH 3CH 2Cl + HCl CH 3CH 2Cl + Cl 2 CH 3CH Cl 2 + CH 2ClCH 2Cl + HCl2、由不饱和烃制备不饱和烃可与卤素、卤化氢发生加成制备卤代烃。

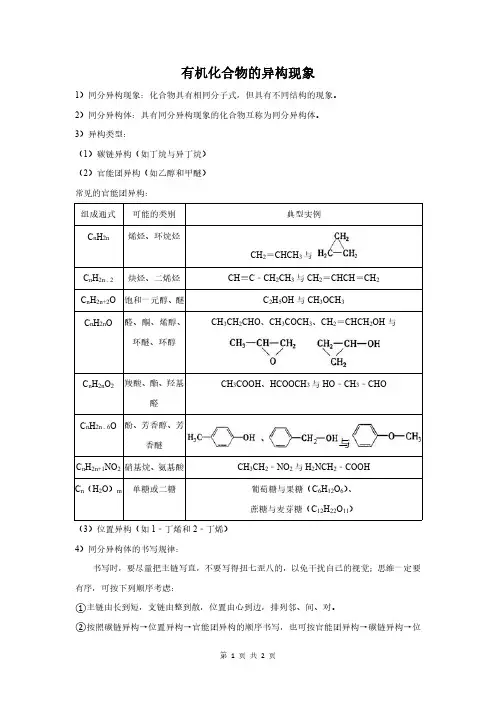
有机化合物的异构现象1)同分异构现象:化合物具有相同分子式,但具有不同结构的现象。
2)同分异构体:具有同分异构现象的化合物互称为同分异构体。
3)异构类型:(1)碳链异构(如丁烷与异丁烷)(2)官能团异构(如乙醇和甲醚)常见的官能团异构:组成通式可能的类别典型实例C n H 2n 烯烃、环烷烃CH 2=CHCH 3与C n H 2n ﹣2炔烃、二烯烃CH ≡C ﹣CH 2CH 3与CH 2=CHCH =CH 2C n H 2n+2O 饱和一元醇、醚C 2H 5OH 与CH 3OCH 3C n H 2n O 醛、酮、烯醇、环醚、环醇CH 3CH 2CHO 、CH 3COCH 3、CH 2=CHCH 2OH 与C n H 2n O 2羧酸、酯、羟基醛CH 3COOH 、HCOOCH 3与HO ﹣CH 3﹣CHOC n H 2n ﹣6O 酚、芳香醇、芳香醚C n H 2n+1NO 2硝基烷、氨基酸CH 3CH 2﹣NO 2与H 2NCH 2﹣COOH C n (H 2O )m 单糖或二糖葡萄糖与果糖(C 6H 12O 6)、蔗糖与麦芽糖(C 12H 22O 11)(3)位置异构(如1﹣丁烯和2﹣丁烯)4)同分异构体的书写规律:书写时,要尽量把主链写直,不要写得扭七歪八的,以免干扰自己的视觉;思维一定要有序,可按下列顺序考虑:①主链由长到短,支链由整到散,位置由心到边,排列邻、间、对。
②按照碳链异构→位置异构→官能团异构的顺序书写,也可按官能团异构→碳链异构→位置异构的顺序书写,不管按哪种方法书写都必须防止漏写和重写。
(烯烃要注意“顺反异构”是否写的信息啊)③若遇到苯环上有三个取代基时,可先定两个的位置关系是邻或间或对,然后再对第三个取代基依次进行定位,同时要注意哪些是与前面重复的。
5)同分异构体数目的判断方法:(1)记忆法:记住已掌握的常见的异构体数。
例如:①凡只含一个碳原子的分子均无异构;②丁烷、丁炔、丙基、丙醇有2种;③戊烷、戊炔有3种;④丁基、丁烯(包括顺反异构)、C8H10(芳烃)有4种;⑤己烷、C7H8O(含苯环)有5种;⑥C8H8O2的芳香酯有6种;⑦戊基、C9H12(芳烃)有8种。

有机化合物的同分异构构造异构是指分子式相同,而分子中原子相互连接的次序不同的一种异构现象,包括碳胳异构、位置异构和官能团异构。
构造相同,但分子中原子在空间的排列方式不同引起的异构现象称为立体异构(stereoisomerism)。
分子中原子在空间的不同排列方式形成了不同的构型或构象,所以立体异构又分为构型异构与构象异构。
例如顺-2-丁烯与反-2-丁烯这种顺反异构即属于构型异构,丁烷的不同构象和环已烷的不同构象都属于构象异构构型异构不仅包括顺、反异构,对映异构也属于构型异构,对映异构的分子式相同,构造也相同,只是构型不同。
现在可以把异构现象归纳为:顺反异构由于双键不能自由旋转,所以当两个双键碳原子各连有两个不同的原子或基团时,可能产生两种不同的空间排列方式。
例如2-丁烯:(I) 顺-2-丁烯(II) 反-2-丁烯(沸点3.7 ℃)(沸点0.88 ℃)两个相同基团(如I 和II中的两个甲基或两个氢原子)在双键同一侧的称为顺式,在异侧的称为反式。
这种由于分子中的原子或基团在空间的排布方式不同而产生的同分异构现象,称为顺反异构,也称几何异构。
通常,分子中原子或基团在空间的排布方式称为构型,因此顺反异构也是构型异构,它是立体异构中的一种。
需要指出的是,并不是所有的烯烃都有顺反异构现象。
产生顺反异构的条件是除了σ键的旋转受阻外(双键或环),还要求两个双键碳原子上分别连接有不同的原子或基团。
也就是说,当双键的任何一个碳原子上连接的两个原子或基团相同时,就不存在顺反异构现象了。
例如,下列化合物就没有顺反异构体。
当与双键相连的两个碳原子上连有相同的原子或基团时,例如上面的(I)和(II),可采用顺反命名法。
两个相同原子或基团处于双键同一侧的,称为顺式,反之称为反式。
书写时分别冠以顺、反,并用半字线与化合物名称相连。
例如:顺- 2 -戊烯反- 2 -戊烯当两个双键碳原子所连接的四个原子或基团均不相同时,则不能用顺反命名法命名,而采用Z, E-命名法。

《有机化合物的结构》同分异构现象《有机化合物的结构——同分异构现象》在有机化学的广阔领域中,同分异构现象就像是一座神秘而迷人的迷宫,吸引着无数科学家不断探索和研究。
同分异构现象是指具有相同分子式但结构不同的化合物之间的关系。
这一概念对于理解有机化合物的性质、反应以及在生命科学、材料科学等众多领域中的应用都具有至关重要的意义。
让我们先来了解一下同分异构现象的基本类型。
同分异构主要分为构造异构和立体异构两大类。
构造异构,简单来说,就是由于原子在分子中的连接顺序和方式不同而产生的异构现象。
其中包括碳链异构、位置异构和官能团异构。
碳链异构,就好比搭建积木。
同样数量的积木,可以搭建成不同形状的结构。
比如分子式为 C₅H₁₂的戊烷,就有正戊烷、异戊烷和新戊烷三种不同的结构。
这是因为碳原子的连接顺序不同,形成了直链、支链等不同的碳链骨架。
位置异构则是官能团在碳链上的位置不同导致的。
比如 C₃H₇Br,溴原子可以连接在1 号碳或者2 号碳上,从而形成两种不同的化合物。
官能团异构,就像是不同的零部件组合成不同的机器。
例如乙醇(C₂H₅OH)和二甲醚(CH₃OCH₃),它们的分子式都是C₂H₆O,但由于官能团的不同,一个是醇羟基,一个是醚键,性质也就大不相同。
而立体异构则是由于分子中原子在空间的排列方式不同而产生的异构现象。
这其中又包括顺反异构和对映异构。
顺反异构常见于含有双键的有机化合物中。
以 2-丁烯为例,如果两个相同的基团在双键的同一侧,就是顺式结构;在双键的两侧,就是反式结构。
这两种结构的物理性质和化学性质往往存在一定的差异。
对映异构则更加微妙和复杂。
就像我们的双手,看似一模一样,但却无法完全重合。
在有机化合物中,如果一个分子与其镜像不能重合,就会产生对映异构。
这种异构体在生理活性、药物研发等方面有着重要的影响。
比如某些药物只有其中一种对映体具有药效,而另一种可能是无效甚至有害的。
同分异构现象对于有机化合物的性质有着显著的影响。

配合物基础知识1、配合物的通式可表示为:L为配体——提供π电子或孤电子对的分子或离子。
可以是单原子配体也可以是多原子配体。
M为中心原子或中心离子——接受配体提供电子的合适空轨道。
x为配位数,若L为单原子配体,则L的数目为x;若L为n个原子的配体,则L的数目=x/n。
a为电荷数,是M的电荷+x L的电荷的代数和。
若a=0,则ML x为配位分子。
a≠0,为配位离子,亦称其为配合物的内界。
“a—”时是配位阴离子;“a+”时是配位阳离子。
配位阴、阳离子再与带异性电荷的离子结合形成配合物,这种带异性电荷的离子称为配合物的外界。
例如:[Ag(NH3)2]OH [Cu(H2O)4]SO4Na3[Ag(S2O3)2]中心体配位体配位数中心体配位体配位数内界外界外界内界配位阳离子配位阴离子2、命名:配位阳离子——某-化(酸)-配位离子名称配位阴离子——作酸根处理,配位离子名称-酸-某配位离子的命名:配位数-配位体名称-合-中心体名称(氧化数-以罗马数表示) 氢氧化二氨合银(Ⅰ) 硫酸四水合铜(Ⅱ) 二硫代硫酸根合银(Ⅰ)酸钠配体的名称:CO羰基O2双氧N2双氮NO亚硝基(NO失去1e—给中心体形成NO+,再用N原子上孤对电子与中心体形成共价键,NO+与CO为等电子体),如Fe(CO)5五羰基合铁。
配体有多种时,无机配体-有机配体;阴离子-阳离子-中性分子;有桥键“μ-”;一个配体用多个π电子作配体用“ηx-” O—HHFe(CO)3(NO)2PtCl3(CH2=CH2)—[(NH3)3Co—O—Co(NH3)3]3+O—NOA B CA.二亚硝基三羰基合铁(—Ⅱ)B.三氯乙烯合铂(Ⅱ)离子C.二(μ-羟)[μ-亚硝酸根(O,N)]二[三氨合钴(Ⅲ)]离子3、常见的一些配位体——配体为多原子时,红字表示的原子往往是配位原子单齿配位体F—、Cl—、Br—、I—、C N—、—S CN、—N CS(异硫氰酸根)、—O H、—N O2、—O NO (亚硝酸根)、CH3CO O—、SO32—、S2O32—、H2O、N H3、C O(羰基)、N O(亚硝酰基)CH3N H2、C5H5N(吡啶,py)、CO(NH2)2(尿素)双齿配位体H2N—CH2CH2—N H2(乙二胺,缩写en)、H2N—CH2—CO O—、—O OC—CO O—(联吡啶,缩写bpy)(8—羟基喹啉根)多齿配位体H2N—CH2—CH2—N H—CH2—CH2—N H2、(二亚乙基三胺,三齿)CH2CO O—N—CH2CO O—(氨基三乙酸根,缩写NTA,四齿)CH2CO O——O OCCH2CH2CO O—N—CH2—CH2—N(乙二胺四乙酸根,缩写EDTA,六齿)—O OCCH2CH2CO O—4、过渡金属的配合物(ML x)英国化学家N.V.西德维奇将G.N.路易斯的八隅律扩展到过渡元素的配合物中——有效原子序数规则(EAN)或称九轨道规则(过渡金属原子(n—1)d、ns、np)。

同分异构体
高乃群高级教师
1几何异构体:因双键或成环碳原子的单键不能自由旋转而引起的异构体称为几何异构体,也称为顺反异构体。
2互变异构体:因分子中某一原子在两个位置迅速移动而产生的官能团异构体称为互变异构体。
互变异构体是一种特殊的官能团异构体。
3立体异构体:分子中原子或原子团互相连接次序相同、但空间排列不同而引起的异构体称为立体异构体。
4同分异构体:分子式相同而结构不同的化合物称为同分异构体,也称为结构异构体。
5同分异构现象:分子式相同而结构不同的现象称为同分异构现象。
6价键异构体:因分子中某些价键的分布发生了改变,与此同时也改变了分子的几何形状,从而引起的异构体称为价键异构体。
7位置异构体:官能团在碳链或碳环上的位置不同而产生的异构体称为位置异构体。
8构型异构体:因键长、键角、分子内有双键、有环等原因引起的立体异构体称为构型异构体。
一般来讲,构型异构体之间不能或很难互相转换。
9官能团异构体:因分子中所含官能团的种类不同所产生的异构体称为官能团异构体。
10构造异构体:因分子中原子的连结次序不同或者键合性质不同引起的异构体称为构造异构体。
11构象异构体:仅由于单键的旋转而引起的立体异构体称为构象异构体。
有时也称为旋转异构体。
由于旋转的角度可以是任意的,单键旋转360˚可以产生无数个构象异构体。
通常以稳定的有限几种构象来代表它们。
12旋光异构体:因分子中没有反轴对称性而引起的具有不同旋光性能的立体异构体称为旋光异构体。
13碳架异构体:因碳架不同产生的异构体称为碳架异构体。

第十章对映异构按结构不同,同分异构现象分为两大类。
一类是由于分子中原子或原子团的连接次序不同而产生的异构,称为构造异构。
构造异构包括碳链异构、官能团异构、位置异构及互变异构等。
另一类是由于分子中原子或原子团在空间的排列位置不同而引起的异构,称为立体异构。
立体异构包括顺反异构、对映异构和构象异构。
一、偏振光和物质的旋光性1、偏振光和物质的旋光性光是一种电磁波,光在振动的方向与其前进的方向垂直。
普通光的光波是在与前进方向垂直的平面内,以任何方向振动。
如果使普通光通过一个尼科尔棱镜,那么只有和棱镜的晶轴平行振动的光才能通过。
如果这个棱镜的晶轴是直立的,那么只有在这个垂直平面上振动的光才能通过,这种只在一人方向上振动的光称为平面偏振光,简称偏振光。
实验证明,当偏振光通过葡萄糖或乳酸等物质时,偏振光的振动方向会发生旋转。
物质使偏振光的振动方向发生旋转的性质称为旋光性。
具有旋光性的物质称为旋光性物质,或光活性物质。
旋光性物质使偏振光的振动方向旋转的角度,称为旋光度,用α表示。
如果从面对光线入射方向观察,使偏振光的振动方向顺时针旋转的物质称右旋体,用“+”表示,而使偏振光的振动方向逆时针旋转的物质,称左旋体,用“—”表示。
2、旋光度和比旋光度旋光性物质的旋光度和旋光方向可用旋光仪来测定。
旋光度的大小和方向,不仅取决于旋光性物质的结构和性质,而且与测定时溶液的浓度(或纯液体的密度)、盛液管的长度、溶剂的性质、温度和光波的波长等有关。
一定温度、一定波长的入射光,通过一个1分米长盛满浓度为1g•ml-1旋光性物质的盛液管时所测得的旋光度,称比旋光度,用[α]tλ表示。
所以比旋光度可用下式求得:式中C是旋光性物质溶液的浓度,即1毫升溶液里所含物质的克数;L为盛液管的长度,分米。
在一定的条件下,旋光性物质的比旋光度是一个物理常数。
测定旋光度,可计算出比旋光度,从而可鉴定末知的旋光性物质。
例如。
某物质的水溶液浓度为5g/100ml,在1分米长的盛液管内,温度为20℃,光源为钠光,用旋光仪测出旋光度为-4.64º。


2024高中化学竞赛高等有机化学目录•绪论•有机化学基础知识•烃类化合物•烃的衍生物•有机合成与反应机理•有机化学在日常生活中的应用•备考策略与技巧PART01绪论有机化学定义研究有机化合物的结构、性质、合成、反应机理及其应用的科学。
有机化合物特点种类繁多、结构复杂、性质各异。
有机化学与日常生活塑料、橡胶、纤维、染料、药物等。
有机化学概述030201通过竞赛选拔出对有机化学有浓厚兴趣和天赋的学生,为他们提供进一步深造的机会。
选拔优秀化学人才促进化学教育改革增强学生综合素质推动高中化学教育的改革和创新,提高化学教育的质量和水平。
培养学生的创新精神、实践能力和团队协作精神,提高学生的综合素质。
030201竞赛目的与意义系统学习基础知识掌握有机化学的基本概念、理论和方法,建立扎实的基础知识体系。
强化实验技能训练通过实验掌握有机化合物的合成、分离、纯化和鉴定等实验技能。
阅读相关文献和资料阅读有机化学领域的经典著作、学术论文和科普文章,了解最新研究进展和成果。
参加学术交流和讨论积极参加学术讲座、研讨会和小组讨论等活动,与同行交流学习心得和体会。
学习方法与策略PART02有机化学基础知识原子结构与化学键原子结构掌握原子的电子排布、原子半径、电离能等基本概念,理解元素周期表中元素的性质递变规律。
化学键深入理解离子键、共价键(σ键和π键)的形成及性质,了解氢键的形成及其对物质性质的影响。
分子极性理解分子的极性与化学键极性的关系,掌握判断分子极性的方法。
03分子构象与构型理解分子的构象与构型的概念,掌握判断分子构象与构型的方法。
01分子结构掌握有机化合物中常见的分子结构类型,如链状、环状、芳香族等,理解分子结构与性质的关系。
02分子间作用力了解分子间作用力的类型,如范德华力、氢键等,理解它们对物质物理性质的影响。
分子结构与分子间作用力有机化合物分类与命名有机化合物分类掌握有机化合物的分类方法,如按碳骨架分类、按官能团分类等。

有机化学中的同分异构现象及同分异构体有机化学中,同分异构指的是分子式相同但结构不同的化合物现象。
同分异构体则是指这些化合物,它们的分子式相同,但是它们的化学性质和物理性质可能有明显的差异。
同分异构现象的产生原因是因为有机化合物的分子由于其碳原子的能力可以形成不同的连接方式,从而导致分子结构和化学性质上的差异。
其中比较常见的同分异构现象包括:
1.位置异构:分子中相同的官能团在分子中的位置不同。
2.链异构:分子中的碳骨架有不同的长度或不同的分支方式。
3.功能异构:分子中的官能团种类相同,但在官能团内部的键的连接方式不同。
4.对映异构:分子中存在非对称碳原子,使得分子具有左右手对称性质,形成手性异构体。
同分异构体常常会导致化学反应的不同,例如一些药物的同分异构体具有不同的药理作用,因此在药物研发和制造中需要特别注意。
此外,同分异构体还广泛应用于工业和生物化学领域。
1/ 1。
高中化学竞赛专题讲座之七有机化学胡征善一、同分异构现象(一)等效氢原子法确定同分异构体数目等效氢原子:化学环境完全相同(核磁共振氢谱同一个波峰)的氢原子。
1.一取代物的确定某有机化合物一取代物的种数== 该有机化合物分子中等效氢原子的种数。
等效氢原子数的判定方法:(1)同一碳原子上的氢原子;(2)同一碳原子上所连甲基上的所有氢原子;(3)处于镜面对称位置上的氢原子。
2.二取代物的确定(取代基相同)(1)先确定所给有机化合物分子中等效氢原子的种数;(2)在不同的位置上进行一取代,并确定这些一取代物分子中等效氢原子种数;(3)确定第二个取代基在一取代物分子上取代的数目,并注意避免重复计算的情况。
1.蒽有3种等效氢原子,金刚烷有2种等效氢原子;21位上;X等效氢原子数9种3种其一取代物9种3种1212 33 31212然后将—X 分别放在β位、2位(为了避免重复,另一取代基不能再连在α位、1位)上;3种最后将—X 分别放在γ位(为了避免重复,另一取代基不能再连在α位、β位)上;其一取代物 1种 所以:蒽的二取代物(取代基相同)有9+5+1==16种同分异构体;金刚烷的二取代物(取代基相同)有3+3 == 6种。
若考虑顺反异构,金刚烷还另加2种顺反(几何)异构体: 顺式 反式同理可求:苯、萘、蒽、并四苯、并五苯……二取代物(取代基相同)的同分异构体数目有: ② 当苯环数为偶数时1.原子次序(1)原子:原子序数大的排在前面,同位素质量数大的优先。
几种常见原子的优先次序为:I >Br >Cl >S >P >O >N >C >D >H(2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。
常见的烃基优先次序为:(CH 3)3C —>(CH 3)2CH —>CH 3CH 2—>CH 3—(3)不饱和基团:将双键或三键拆开,如: C=O C —O 再依(2)作比较。
故O—X 2 1 22 3 2 H X H X H X X H HX H X H X X H有:—C CH >—CH=CH 2>(CH 3)2CH — 2.某些有机化合物的命名(1)几何异构A .当双键(或环)碳原子的每个碳原子上所连2个基团不相同时,可用顺反表示。
有机化学中的同分异构现象1.有机化学中的构造异构构造异构体按照其结构的特点又可以进一步细分为以下三种常见的类型:碳链异构、位置异构和官能团异构。
碳链异构是指由于分子中碳链形状不同而产生的异构现象。
这种异构体的数量随着分子中碳原子数的增加快速增加,构成数量庞大的有机化合物。
具有1-3个碳原子的烷烃没有构造异构体,而4个碳原子的烷烃包含正丁烷和异丁烷两种异构体。
戊烷包含3种构造异构体,己烷的异构体有5种,庚烷有9种,癸烷有75种。
新戊烷正戊烷异戊烷2,2-二甲基丁烷己烷2-甲基戊烷3-甲基戊烷2,3-二甲基丁烷位置异构是指由于取代基或官能团在碳链上或碳环上的位置不同而产生的异构现象。
这种异构现象普遍存在于烯烃、炔烃、醇、酚、酮等具有官能团的有机化合物中。
例如,1-丁烯2-丁烯1-丁炔2-丁炔OHOHOO3-戊酮1-丁醇2-丁醇2-戊酮ClOHCl OH4-氯苯酚3-氯苯酚官能团异构是指由于分子中官能团的不同而产生的异构现象。
单烯烃与环烷烃、炔烃与二烯烃、醇与醚、醛与酮、烯醇与酮、酯和羧酸、酚和芳香醇等都属于官能团异构。
例如,O OHCHO O OOOOHCOOHCOOCH 3环戊烷1-戊烯1,3-丁二烯2-丁炔甲乙醚1-丙醇丙酮丙醛1,3-戊二酮4-羟基-3-戊烯酮丁酸丙酸甲酯OHOH苯甲醇对甲苯酚2. 有机化合物的立体异构现象1874年,年轻的物理化学家范霍夫(J. H. Van ’t Hoff )和勒贝尔(J. A. Le Bel )根据有机分子的旋光性等实验事实,分别独立地发表论文提出碳的四价是指向四面体的四个顶点,即碳原子的四面体理论,打破了有机分子的平面结构理论,开创了有机分子立体结构的先河。
以碳原子的四面体理论为基础的现代立体化学理论已经有了高度的发展和更加丰富的内涵。
立体异构体主要包括构象异构、几何异构和光学异构三大类。
几何异构现象主要发生在环烷烃和烯烃分子中,光学异构则主要发生在具有手性特征的分子中,主要包括对映异构和非对映异构两类异构体。