普通化学习题与解答第二章
- 格式:doc
- 大小:1.04 MB
- 文档页数:18

普通化学习题与解答第二章第二章普通化学习题与解答一、选择题1. 下列哪个是粘度最小的物质?A. 黄铜B. 液态氧C. 水银D. 橄榄油2. 一种固体物质在室温下不导电,也不溶于水以及醇类溶剂,属于下列哪一类物质?A. 镁B. 铜C. 木炭D. 锌3. 下列哪种金属在室温下是液态的?A. 铁B. 银C. 铝D. 汞4. 完全燃烧1g甲烷所需的氧气体积为V1,完全燃烧1g乙烷所需的氧气体积为V2,则下列关系正确的是:A. V1 = V2B. V1 < V2C. V1 > V2D. 无法确定5. 下列哪种化合物是无机化合物?A. 葡萄糖B. 甲烷C. 乙醇D. 二氧化碳二、填空题1. 化学元素周期表上有多少个元素?2. 氧元素的原子序数是多少?3. 氮元素的化学符号是什么?4. 分子式C6H12O6代表着哪种有机化合物?5. 有机化合物在室温下一般是__(固体/液体/气体)。
三、解答题1. 简述中性溶液的特征以及如何制备中性溶液。
中性溶液的特征是指其酸性和碱性的浓度相等,pH值为7。
要制备中性溶液,可以采取以下两种方法:方法一:将酸性溶液与碱性溶液缓慢地滴加到一个容器中,直到酸碱浓度相等,pH值为7时停止滴加。
方法二:使用酸碱指示剂,如酚酞,将酸性溶液和碱性溶液逐滴混合,颜色由红变成无色,表示达到中性。
2. 请解释为什么在实验室中要用称量瓶来称量固体物质。
在实验室中用称量瓶来称量固体物质主要是为了保证称量结果的准确性和精确性。
称量瓶具有较小的容量,可以减少气体的容积,不会因固体粉末的散落而产生较大的误差。
此外,称量瓶具有较好的密封性能,可以防止固体物质与外界环境的接触,避免水分、氧气等物质对固体的影响,保持固体的质量稳定。
3. 简述无机化合物与有机化合物的区别,并给出两个具体的例子。
无机化合物是指由无机元素组成的化合物,其化学性质相对稳定,大多数无机化合物是金属离子与非金属离子之间的化合物,常见的无机化合物有氯化钠(NaCl)、硫酸铜(CuSO4)等。

2023新人教版高一化学课后习题答案第二章第一节选择题1.D2.A3.B4.C5.B6.A7.D8.C9.A10.B第二节解答题1. 什么是化学键?化学键的种类有哪些?化学键是指两个或多个原子之间通过共用电子或者转移电子而形成的牢固的联系。
化学键的种类有离子键、共价键和金属键。
离子键是由电子转移形成的,并且通常在金属与非金属之间形成。
共价键是由电子共享形成的,并且通常在非金属与非金属之间形成。
金属键是由金属原子间的电子云形成的。
2. 什么是离子键?离子键的特点是什么?离子键是由电子转移形成的化学键。
离子键的特点是:•通常在金属与非金属之间形成;•电子从金属原子转移到非金属原子,形成带正电荷的离子和带负电荷的离子;•离子之间通过静电引力相互吸引,形成牢固的连接。
3. 什么是共价键?共价键的特点是什么?共价键是由电子共享形成的化学键。
共价键的特点是:•通常在非金属与非金属之间形成;•电子成对地在原子之间共享,形成共用电子对;•共价键可以是单键、双键或者三键;•共价键的强度通常比离子键弱。
4. 解释一下以下化学式中的键的类型和性质:H2O、NaCl、CH4。
•H2O:其中的键类型为共价键。
H2O是水分子的化学式,其中两个氢原子和一个氧原子通过共用电子形成共价键。
水分子是极性分子,由于氧原子比氢原子的电负性更大,因此水分子中的氧原子带负电荷,氢原子带正电荷。
•NaCl:其中的键类型为离子键。
NaCl是氯化钠的化学式,其中钠离子和氯离子通过电子转移形成离子键。
钠离子带正电荷,氯离子带负电荷。
由于正负电荷之间的静电引力,钠离子和氯离子紧密连接。
•CH4:其中的键类型为共价键。
CH4是甲烷的化学式,其中碳原子和四个氢原子通过共用电子形成共价键。
甲烷是非极性分子,碳原子和氢原子的电负性相近,因此甲烷中的化学键没有电荷分布不均匀的情况。
5. 什么是全球气候变暖?全球气候变暖的原因是什么?全球气候变暖是指地球气候系统的气温整体上升的现象。


普通化学第一章 习题答案1. 答案(1-)(2-)(3+)(4-)2. 答案(1c )(2d )(3a )(4d )(5abd )(6ad )(7d )(8d )3. 答案(1)燃烧前后系统的温度(2)水的质量和比热(3)弹式量热计热容4..答案:根据已知条件列式 K C g K g J g molg mol J b )35.29659.298](120918.4[5.0122100032261111-+⨯⋅⋅-=⨯⋅⋅⨯----- C b =849J.mol -15.答案:获得的肌肉活动的能量=kJ mol kJ mol g g8.17%3028201808.311=⨯⋅⨯⋅--6. 答案:设计一个循环 3× )(2)(32s Fe s O Fe →×3→)(243s O Fe )(3s FeO ×2(-58.6)+2(38.1)+6p q =3(-27.6) 17.166)1.38(2)6.58()6.27(3-⋅-=----=mol kJ q p7.答案:由已知可知 ΔH=39.2 kJ.mol -1 ΔH=ΔU+Δ(PV )=ΔU+P ΔVw ‘=-P ΔV= -1×R ×T = -8.314×351J = -2.9kJ ΔU=ΔH-P ΔV=39.2-2.9=36.3kJ8.下列以应(或过程)的q p 与q v 有区别吗? 简单说明。
(1)2.00mol NH 4HS 的分解NH 4HS(s) NH 3(g)+H 2S(g) (2)生成1.00mol 的HCl H 2(g)+Cl 2(g) 2HCl(g) (3)5.00 mol CO 2(s)(干冰)的升华CO 2(s)CO 2(g) (4)沉淀出2.00mol AgCl(s) AgNO 3(aq)+NaCl(aq) AgCl(s)+NaNO 3(aq)9.答案:ΔU-ΔH= -Δ(PV )=-Δn g RT (Δn g 为反应发生变化时气体物质的量的变化) (1)ΔU-ΔH=-2×(2-0)×8.314×298.15/1000= - 9.9kJ(2)ΔU-ΔH=-2×(2-2)×R ×T= 0(3)ΔU-ΔH=-5×(1-0)×8.314×(273.15-78)/1000= -8.11kJ (4)ΔU-ΔH=-2×(0-0)×R ×T= 010.(1)4NH 3(g)+3O 2(g) = 2N 2(g) +6H 2O(l) 答案 -1530.5kJ.mol -1(2)C 2H 2(g) + H 2(g) = C 2H 4(g) 答案 -174.47kJ.mol -1 (3)NH 3(g) +稀盐酸 答案 -86.32kJ.mol -1 写出离子反应式。





第二章 化学反应的基本原理和大气污染1、是非题(对的在括号内填“+”号,错的填“-”号)(1)r S ∆ 为正值的反应均是自发反应。
(-) (2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡,则各反应物和生成物的分压或浓度分别保持原有定值。
(-)(3)对反应系统122()()()(),(298.15)131.3r m C s H O g CO g H g H K kJ mol θ-+=+∆= 。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
(-) (4)上述(3)中反应达到平衡后,若升高温度,则正反应速率v (正)增加,逆反应速率v (逆)减小,结果平衡向右移动。
(-)(5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
(-) (6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的rmG θ∆。
(+)(7)在常温常压下,空气中的N 2 和O 2 能长期存在而不化合生成NO 。
且热力学计算表明22()()2()N g O g NO g +=的(298.15)0r m G K θ∆ ,则N 2 和O 2混合气必定也是动力学稳定系统。
(+)(8)已知4CCl 不会与2H O 反应,但422()2()()4()CCl l H O l CO g HCl aq +=+的1(298.15)379.93r m G K kJ mol θ-∆=- ,则必定是热力学不稳定而动力学稳定的系统。
(+)2、选择题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是 (b )(a )低温高压 (b )高温低压 (c )低温低压 (d )高温高压 (2)某温度时,反应22()()2()H g Br g HBr g +=的标准平衡常数2410K θ-=⨯,则反应2211()()()22HBr g H g Br g =+的标准平衡常数K θ等于 (b )(a )21410-⨯ (b (c )2410-⨯ (3)升高温度可以增加反应速率,最主要是因为 (b )(a )增加了分子总数(b )增加了活化分子的百分数 (c )降低了反应的活化能 (d )促使平衡向吸热方向移动(4)已知汽车尾气无害化反应221()()()()2NO g CO g N g CO g +=+的(298.15)0r m H K θ∆≤,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是 ( c) (a )低温低压 (b )高温高压 (c )低温高压 (d )高温低压(5)温度升高而一定增大的量是 (bc )(a ) r m G θ∆ (b )吸热反应的平衡常数K θ(c )液体的饱和蒸气压 (d )反应的速率常数k(6)一个化学反应达到平衡时,下列说法中正确的是 ( a) (a )各物质的浓度或分压不随时间而变化(b )r m G θ∆=0(c )正、逆反应的速率常数相等(d )如果寻找到该反应的高效催化剂,可提高其平衡转化率3、填空题(1)对于反应: 1223()3()2();(298)92.2r m N g H g NH g H K kJ mol θ-+=∆=-若升高温度(约升高100 K),则下列各项将如何变化(填写:不变,基本不变,增大或减小。

第2章 化学反应的基本原理与大气污染1. 答案 〔1-〕〔2-〕〔3-〕〔4-〕〔5-〕〔6+〕〔7+〕〔8+〕2. 答案1b 2b 3b 4c 5bcd 6a3. 〔1〕答案:基本不变,基本不变,增大减小, 增大 增大 〔2〕〔3〕答案:氟里昂,NO X 、HCl ;CO 2;NO X 和SO 24. 答案:〔d 〕>〔c 〕>〔e 〕>〔a 〕>〔b 〕原因是气体熵>液体>固体 分子量大的熵大5. 〔1〕溶解少量食盐于水中。
答案:正 〔2〕活性炭外表吸附氧气。
答案:负 (1) 碳与氧气反应生成一氧化碳。
答案:正6. 答案:由定义可知Fe 2O 3的1.2.742)15.298(--=∆mol kJ K G m f θ1.7.77)15.298(--=∆mol kJ K G m r θ=3),15.298(43O Fe K G m f θ∆-4),15.298(32O Fe K G m f θ∆),15.298(43O Fe K G m f θ∆=31[(-77.7)+4(-742.2)]=-1015.5kJ.mol -1 7.答案:查表 水的1.129.237)15.298(--=∆mol kJ K G m f θ过程的1.429.0)129.237()7.236()15.298(-=---=∆mol kJ K G mr θ>0 所以在298.15K 的标准态时不能自发进行.8. (查表时注意状态,计算时注意乘系数)11..)15.298(--∆K mol J K S m r θ1.)15.298(-∆molkJ K G m r θ〔1〕)(4)()(4)(32432g H s O Fe l O H s Fe +=+ 307.7 -66.9 〔2〕)()()(2)(22g H aq Zn aq H s Zn +=+++ -23.0 -147.06 〔3〕)(2)()()(22aq OH aq Ca l O H s CaO -++=+ -184.3 -26.9 〔4〕)(21)()(2l Br s Ag s AgBr += -51.4 96.99.答案: (1) SnO 2 =Sn +O 2 (2) SnO 2 +C =Sn + CO 2(3) SnO 2 +2H 2 =Sn +2H 2O 〔g 〕11..)15.298(--K mol J K S m θ 52.3 51.55 205.138 52.3 5.74 51.55 213.74 52.3 2×130.684 51.55 2×188.8251.)15.298(-∆molkJ K H m f θ-580.7 0 0 -580.7 0 0 -393.509 -580.7 00 2×(-241.818)11..)15.298(--∆K mol J K S m r θ (1)204.388 (2)207.25(3)115.5321.)15.298(-∆mol kJ K H m r θ (1) 580.7 (2)187.191(3)97.064 Tc>)15.298()15.298(K S K H m r m r θθ∆∆ (1)2841K 903K(3)840K(温度最低,合适)10.答案: C 12H 22O 11(s)+12O 2(g)=12CO 2(g) +11H 2O(l))K 15.298(S m r θ∆11..)15.298(--K mol J K S m θ 360.2 205.138 213.74 69.91 =11×69.91+12(213.74-205.138)-360.2=512.0341.)15.298(-∆molkJ K H m f θ-2225.5 0 -393.509 -285.83=∆)15.298(K H m r θ-5640.738=+∆)3715.273(K G m r θ-5640.738-310.15×(512.034÷1000)=-5799.54kJ.mol -1()15.298(K G mr θ∆=-5796.127 kJ.mol -1 温度对反应的标准吉布斯函数变有影响,但由于该反应的熵变相对于焓变小(绝对值),故变化不大) 做的非体积功= 5799.54kJ.mol -1×30%×3.8/342=19.33 kJ 11.答案: 查表11..)15.298(--K mol J K S m θ197.674 130.684 186.264 188.825)K 15.298(S m r θ∆=-214.6371.)15.298(-∆mol kJ K H m f θ-110.525 0 -74.81-241.818=∆)15.298(K H mr θ-206.103 ≈∆)523(K G m r θ)15.298(K H m r θ∆-523K ×)K 15.298(S m r θ∆=〔-206.103〕-523K ×〔-206.103÷1000〕= -93.85 kJ.mol -158.21523314.81000)85.93(523)523()523(ln =⨯⨯--=⨯∆-=K R K G K K m r θθ937.9303.2/58.2158,211035.21010⨯====e K θ12. 答案:设平衡时有2Xmol 的SO 2转化 2SO 2〔g 〕+O 2〔g 〕=2SO 3〔g 〕起始 n/mol 8 4 0n 〔始〕=12mol平衡时n/mol 8-2x 4-x 2xn 〔平衡〕=〔12-x 〕mol根据PV=nRT T V 一定时(平衡)(始)(平衡)始)P P n n =(2203001212=-x 2x=6.4molS O2的转化率=6.4/8=80%=⨯=))(())(())((22223θθθθpO p p SO p p SO p K eqeq eq )1002208.88.0()1002208.86.1()1002208.84.6(22⨯⨯⨯⨯(注意在计算时可不用先计算分压,列综合算式更方便计算)13.答案:该反应是可逆反应,需要H 2的量包括反应需要的量1mol 和为维持平衡需要xmol 〔最少量〕)()()()())(())((222222H n S H n H p S H p p H p p S H p K eqeq eq eq eq eq ===θθθ=x 0.1=0.36 x=2.78mol需要H 2的量=1+2.78=3.78mol(注:该反应是反应前后气体分子数不变的,在标准平衡常数表达式中系统的总压和标准压力在计算时可以在分式中消去,否则在计算时必须知道平衡时总压才能根据平衡常数计算.) 14.在不同温度时反应的标准平衡常数值如下: T/K θ1Kθ2K9731.472.38 0.6181073 1.81 2.00 0.9051173 2.15 1.67 1.2871273 2.481.49 1.664答:反应3的标准平衡常数 θθθ213K K K = 〔如上〕(因为随温度的升高平衡常数增大,故是吸热反应)15.答案:利用公式211212))(15,298(ln T RT T T K H K K m r ⨯-∆=θθθ求θ2K代入数据50015.298314.8)15.298500(100031.92109.4ln 162⨯⨯-⨯-=⨯θK =-15.03 θ2K =1603.15109.4⨯⨯-e =1.4×101016.答案:查数据计算)g (O H )g (CO )g (H )g (CO 222+=+11..)15.298(--K mol J K S m θ213.74 130.684 197.674 188.825)K 15.298(S m r θ∆=42.075J.mol -1.K -11.)15.298(-∆mol kJ K H m f θ-393.509 0 -110.525 -241.818=∆)15.298(K H m r θ41.166kJ.mol -1≈∆)873(K G m r θ)15.298(K H m r θ∆-873)15.298(K S m r θ∆⨯=41.166kJ.mol -1-873K ×0.042075kJ.mol -1.K -1=4.434 kJ.mol -1=∆-=RT K G K K m r )873()873(ln θθ873314.81000434.4⨯⨯-=-0.6154.061.0==-e K θ=Q )/)()(/)(()/)()(/)((222θθθθp H p p CO p p O H p p CO p =1271277676⨯⨯=0.358(Q<K 0 所以反应正向进行)=∆m r G Q RT K G m r ln )873(+∆θθK QRT ln ==8.314×873ln(0.358/0.54)=-2982.9J.mol -1=-2.98kJ.mol -1因为m r G ∆<0 所以此条件下反应正向进行17.答案:吕·查德里原理判断是正确的。
第一章 热化学与能源1. 是非题(对的在括号内填“+”号,错的填“-”号)(1)已知下列过程的热化学方程式为:则此温度时蒸发1mol 6()UF l ,会放出热30.1kJ 。
(-)(2)在定温定压条件下,下列两个生成液态水的化学方程式所表达的反应放出的热量是一相同的值。
(-)(3)功和热是在系统与环境之间的两种能量传递方式,在系统内部不讨论功和热。
(+)(4)反应的H ∆就是反应的热效应。
(-)2、选择题(将所有正确答案的标号填入空格内)(1)在下列反应中,进行1mol 反应时放出热量最大的是 (c)(2)通常,反应热的精确的实验数据是通过测定反应或过程的哪个物理量而获得的。
(d) (a )H ∆ (b )p V ∆ (c )P q (d )V q (3)下列对功和热的描述中,正确的是 (a)(a )都是途径函数,无确定的变化途径就无确定的数值 (b )都是途径函数,对应于某一状态有一确定值 (c )都是状态函数,变化量与途径无关(d )都是状态函数,始终态确定,其他值也确定(4)在温度T 的标准状态下,若已知反应2A B →的标准摩尔反应焓,1r m H θ∆,2222221()()()22()()2()H g O g H O l H g O g H O l +=+=166()();30.1r m UF l UF g H kJ molθ-=∆=422242224222422()()2()()2()()()2()()2()()()2()()2()3()()()()2()2a CH l O g CO g H O gb CH g O g CO g H O gc CH g O g CO g H O ld CHg O g CO g H O l +=++=++=++=+与反应2A C →的标准摩尔反应焓,2r m H θ∆,则反应4C B →的标准摩尔反应焓,3r m H θ∆与,1r m H θ∆及,2r m H θ∆的关系为,3r m H θ∆= (d) (a )2,1r m H θ∆+,2r m H θ∆ (b ),1r m H θ∆—2,2r m H θ∆ (c ),1r m H θ∆+,2r m H θ∆ (d )2,1r m H θ∆—,2r m H θ∆(5)对于热力学可逆过程,下列叙述正确的是 (abd )(a )变化速率无限小的过程 (b )可做最大功的过程 (c )循环过程(d )能使系统与环境完全复原的过程(6)在一定条件下,由乙二醇溶液、冰、水蒸气、氮气和氧气组成的系统中含有 (ad ) (a )三个相 (b )四个相 (c )三种组分 (d )四种组分 (e )五种组分*(7)一只充满氢气的气球,飞到一定高度即会爆炸,这取决于一定高度上的 (d ) (a )外压 (b )温度 (c )湿度 (d )外压和温度 (8)下述说法中,不正确的是 (d)(a )焓只有在某种特定条件下,才与系统反应热相等 (b )焓是人为定义的一种具有能量量纲的热力学量 (c )焓是状态函数(d )焓是系统能与环境进行交换的能量3、填空题使可燃样品(质量为1.000g )在弹式量热计内完全燃烧,以测定其反应热,必须知道:(1) 弹式量热计内吸热介质(通常为水)质量和比热容; (2) 钢弹组件的总热容b C ; (3) 反应前后系统的温度。
化学必修1第二章课后习题参考答案第二章第一节P29习题:1、②⑧;①④;⑤;⑥;⑦⑩;⑨2(1)从酸的强度上来讲:HCl、H2SO4、HNO3是强酸;H3PO4是中强酸;而H2S为弱酸。
(2)从酸的氧化性强弱来分:浓H2SO4、HNO3是强氧化性酸;而H2S是强还原性酸。
(3)从电离的H离子个数来分:HCl、HNO3是一元酸;H2SO4、H2S是二元酸;H3PO4是三元酸。
(4)从酸中是否含有氧元素来分:H2SO4、HNO3、H3PO4是含氧酸;而HCl、H2S为无氧酸。
3、混合物,首先是它们中的组份在一定条件下,不互相反应。
(1)固-固类(2)固-液类(3)固-气类(例空气和灰尘)(4)液-液类(例如油和水)(5)气-液类(例如河水中溶解的氧气)(6)气-气类(例如空气);如果从组成分类有:单质和单质;单质和化合物;化合物和化合物;有机物和无机物;如果从元数分类:有二元;三元;四元;五元等等。
4、略7.胶体区别于其他分散系得本质特征是胶体粒子的大小在1~100nm范围。
胶体的应用,例如明矾净水、豆浆加石膏成豆腐、静电除尘、江河入海口易形成沙洲、血液透析、饱和氯化铁溶液用于应急性止血等。
第二章第二节P33习题:1.水溶液熔融状态电离阴阳离子阳离子 H+阴离子 OH-金属离子或铵根离子酸根离子 H+ + OH-=H2O2.两种电解质在溶液中相互交换离子的反应生成难溶物、易挥发物质、弱电解质3.C 4.C 5.C 6.B 7.D8、(1)NaOH= Na++OH- (2) CuCl2=Cu2++2Cl-(3)Fe2(SO4)3 =2 Fe3++3SO42-(4)Ba(NO3)2= Ba2++2NO3-9、(1)Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42-+Ba2+=BaSO4↓(2)2Al+3Hg(NO3)2=3Hg+2Al(NO3)3,2Al+3Hg2+=3Hg+2Al3+(3)2HCl+Na2CO3= 2NaCl +H2O+ CO2↑,2H++CO32-= H2O+ CO2↑(4)不起反应,因为不符合离子反应发生的条件。
普通化学习题与解答第二章在化学的学习旅程中,第二章往往是一个关键的阶段,它为我们进一步理解化学世界的奥秘奠定了基础。
这一章通常涵盖了一系列重要的概念、原理和相关的习题。
让我们先来看看物质的分类。
物质可以分为纯净物和混合物。
纯净物又可细分为单质和化合物。
单质是由同种元素组成的纯净物,比如氧气(O₂)、铁(Fe)。
化合物则是由不同种元素组成的纯净物,像水(H₂O)、二氧化碳(CO₂)。
理解物质的分类对于后续的学习至关重要,因为它影响着我们对化学反应和化学性质的判断。
接着,化学变化和物理变化也是第二章的重点。
化学变化意味着有新物质生成,比如铁在潮湿的空气中生锈,生成了新的物质铁锈。
而物理变化只是物质的状态、形状等发生改变,但其本质成分不变,比如水的蒸发,从液态变成气态,还是水分子。
在做相关习题时,要仔细分析变化前后物质的成分是否发生了改变。
化学反应中的质量守恒定律也是必须掌握的内容。
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
这个定律在解决很多化学计算问题时非常有用。
比如,已知某化学反应中反应物的质量,通过质量守恒定律就能算出生成物的质量。
在做习题时,常常会遇到这样的题目:给出一个化学反应的方程式,然后让我们判断它属于哪种基本反应类型。
基本反应类型包括化合反应、分解反应、置换反应和复分解反应。
化合反应是“多变一”,分解反应是“一变多”,置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,复分解反应则是两种化合物相互交换成分生成另外两种化合物。
例如,氢气和氧气反应生成水,这是化合反应;水通电分解成氢气和氧气,就是分解反应;铁和硫酸铜反应生成铜和硫酸亚铁,属于置换反应;盐酸和氢氧化钠反应生成氯化钠和水,属于复分解反应。
再来说说元素符号和化学式的书写。
元素符号要记住常见元素的符号,比如氢(H)、氧(O)、碳(C)等。
化学式的书写要根据元素的化合价来确定原子的个数比。
比如,氧化铁(Fe₂O₃)中,铁元素显+3 价,氧元素显-2 价,根据化合价交叉法就能写出化学式。
普通化学习题与解答第二章第二章的普通化学涵盖了诸多重要的知识点,下面我们就通过一些典型的习题来加深对这些知识的理解和掌握。
首先来看这样一道题:在一定温度下,将 2 mol A 气体和 3 mol B 气体通入一密闭容器中发生反应:A(g) + 3B(g) ⇌ 2C(g) + xD(g),若5 min 时达到平衡,此时测得生成了 1 mol C,且反应前后压强之比为5∶6。
则下列说法正确的是()A x 的值为 1B 反应开始至平衡时,A 的平均反应速率为 02 mol/(L·min)C B 的转化率为 40%D 平衡时 B 的浓度为 15 mol/L我们来逐步分析这道题。
首先,根据反应前后压强之比为 5∶6,设反应前气体的总物质的量为 5n,反应后气体的总物质的量为 6n。
因为反应前后气体的物质的量发生了变化,所以可以通过化学计量数来计算。
反应前 A 气体为 2 mol,B 气体为 3 mol,总物质的量为 5 mol。
反应后生成了 1 mol C,根据化学方程式可知,生成 C 的物质的量与消耗A 的物质的量之比为 2∶1,所以消耗 A 的物质的量为 05 mol,剩余 A的物质的量为 15 mol。
消耗 B 的物质的量为 15 mol,剩余 B 的物质的量为 15 mol。
生成 D 的物质的量为 05x mol。
则有 5∶(2 + 3) = 5∶6,解得 x = 2,A 选项错误。
A 的平均反应速率= 05 mol÷(2 L×5 min) = 005 mol/(L·min),B 选项错误。
B 的转化率= 15 mol÷3 mol×100% = 50%,C 选项错误。
平衡时 B 的浓度= 15 mol÷2 L = 075 mol/L,D 选项错误。
接下来看另一道题:在一个固定体积的密闭容器中,加入 2 mol A 和 1 mol B 发生反应:2A(g) + B(g) ⇌ 3C(g) + D(g),达到平衡时,C 的浓度为 w mol/L。
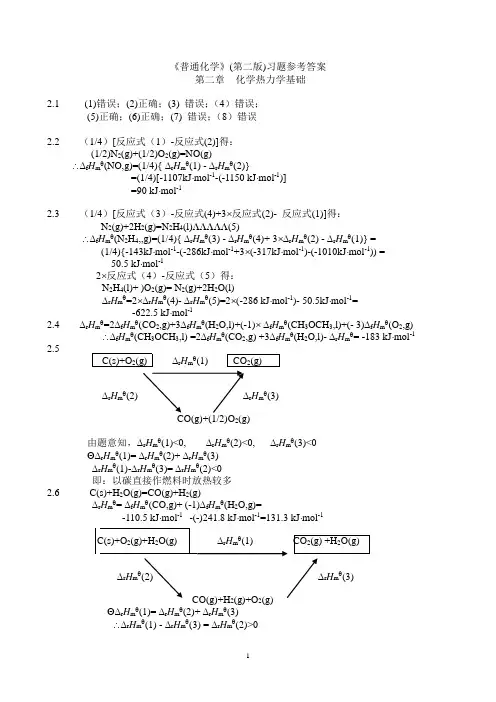
二章 稀溶液的依数性 首 页难题解析学生自测题学生自测答案章后习题答案难题解析 [TOP]例 2-1 已知异戊烷C5H12的摩尔质量M = 72.15 g·mol -1,在20.3℃的蒸气压为77.31 kPa 。
现将一难挥发性非电解质0.0697g 溶于0.891g 异戊烷中,测得该溶液的蒸气压降低了2.32 kPa 。
(1)试求出异戊烷为溶剂时Raoult 定律中的常数K ; (2)求加入的溶质的摩尔质量。
解 (1)AA B AB BA B BMm n n n n n n X=≈+=BB A 0AAB 0B 0ΔKb b M p Mm n px p p ====K = p0MA对于异戊烷有 K = p0MA = 77.31 kPa×72.15 g·mol -1 =5578 kPa·g·mol -1 = 5.578 kPa·kg·mol -1(2)AB B B Δm M m KKb p ==11AB Bmolg 188kg10000.891kPa 32.2g 0697.0molkg kPa 578.5Δ--⋅=⨯⋅⋅=⋅=m p m KM例2-2 一种体液的凝固点是-0.50℃,求其沸点及此溶液在0℃时的渗透压力(已知水的Kf=1.86 K·kg·mol -1,Kb=0.512K·kg·mol -1)。
解 稀溶液的四个依数性是通过溶液的质量摩尔浓度相互关连的,即RTK T K T K p b ∏≈===ff bb B ΔΔΔ因此,只要知道四个依数性中的任一个,即可通过bB 计算其他的三个依数性。
B f fbK T=∆11-ff B kgmol 269.0molkg K 86.1K 500.0Δ-⋅=⋅⋅==k T bK138.0kgmol 269.0molkg K 512.0Δ-1-1B b b =⋅⨯⋅⋅==b k T故其沸点为100+0.138 = 100.138℃ 0℃时的渗透压力 RT b cRT B ≈=∏ = 0.269mol·L -1×8.31J·K -1·mol -1×273K= 0. 269mol·L-1×8.31kPa·L·K-1·mol-1×273K= 610 kPa例2-3 按溶液的凝固点由高到低的顺序排列下列溶液:① 0.100mol·kg-1的葡萄糖溶液② 0.100mol·kg-1的NaCl溶液③ 0.100mol·kg-1的尿素溶液④ 0.100mol·kg-1的萘的苯溶液解这里要考虑多种因素:溶剂的凝固点、溶剂的摩尔凝固点降低常数、溶液的质量摩尔浓度、溶质是电解质还是非电解质。
第二章 化学反应的基本原理和大气污染1、是非题(对的在括号内填“+”号,错的填“-”号)(1)r S ∆ 为正值的反应均是自发反应。
(-) (2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡,则各反应物和生成物的分压或浓度分别保持原有定值。
(-)(3)对反应系统122()()()(),(298.15)131.3r mC s H O g CO g H g H K kJ mol θ-+=+∆=。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
(-) (4)上述(3)中反应达到平衡后,若升高温度,则正反应速率v (正)增加,逆反应速率v (逆)减小,结果平衡向右移动。
(-)(5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
(-)(6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的rmG θ∆。
(+)(7)在常温常压下,空气中的N 2 和O 2 能长期存在而不化合生成NO 。
且热力学计算表明22()()2()N g O g NO g +=的(298.15)0r mG K θ∆,则N 2 和O 2混合气必定也是动力学稳定系统。
(+)(8)已知4CCl 不会与2H O 反应,但422()2()()4()CCl l H O l CO g HCl aq +=+的1(298.15)379.93r m G K kJ mol θ-∆=-,则必定是热力学不稳定而动力学稳定的系统。
(+)2、选择题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是 (b )(a )低温高压 (b )高温低压 (c )低温低压 (d )高温高压 (2)某温度时,反应22()()2()H g Br g HBr g +=的标准平衡常数2410K θ-=⨯,则反应2211()()()22HBr g H g Br g =+的标准平衡常数K θ等于 (b )(a )21410-⨯ (b (c )2410-⨯ (3)升高温度可以增加反应速率,最主要是因为 (b )(a )增加了分子总数(b )增加了活化分子的百分数 (c )降低了反应的活化能 (d )促使平衡向吸热方向移动(4)已知汽车尾气无害化反应221()()()()2NO g CO g N g CO g +=+的(298.15)0r m H K θ∆≤,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是 ( c) (a )低温低压 (b )高温高压 (c )低温高压 (d )高温低压(5)温度升高而一定增大的量是 (bc )(a ) r m G θ∆ (b )吸热反应的平衡常数K θ(c )液体的饱和蒸气压 (d )反应的速率常数k(6)一个化学反应达到平衡时,下列说法中正确的是 ( a) (a )各物质的浓度或分压不随时间而变化(b )r m G θ∆=0(c )正、逆反应的速率常数相等(d )如果寻找到该反应的高效催化剂,可提高其平衡转化率3、填空题(1)对于反应: 1223()3()2();(298)92.2r mN g H g NH g H K kJ mol θ-+=∆=- 若升高温度(约升高100 K),则下列各项将如何变化(填写:不变,基本不变,增大或减小。
)r m H θ∆: 基本不变 r m S θ∆: 基本不变 r m G θ∆: 增大 K θ: 减小v(正): 增大 v (逆): 增大 (2)对于下列反应:12()()2();(298)172.5r mC s CO g CO g H K kJ mol θ-+=∆=。
若增加总压力或升高温度或加入催化剂,则反应速率常数k (正)、k (逆)和反应速率v (正)、v (逆)以及标准平衡常数K θ、平衡移动的方向等将如何?分别填人下表中。
(3)造成平流层中臭氧层破坏的主要物质有 CFC 、哈龙、N 2O 、NO 、CCl 4、CH 4等;主要的温室气体有 CO 2、CH 4、N 2O 、CFC 、O 3等 ;形成酸雨的大气污染物主要是 SO 2、NO x 等 。
4、不用查表,将下列物质按其标准m S θ(298K)值由大到小的顺序排列,并简单说明理由。
(a)K(s) (b)Na(s) (c)Br 2(1) (d) Br 2 (g) (e)KCl(s)解:m S θ(298K )值由大到小的顺序为2()()d Br g >2()()c Br l >()()e KCl s >()()a K s >()()b Na s说明 (1)同一物质2Br 气态时的熵大于液态时的;(2)一般(相对分子质量相近时)液体的熵大于固体物质的熵; (3)一般说来,当温度和聚集状态相同时,分子或晶体结构较复杂(内部微观粒子较多)的物质的熵大于分子或晶体结构较简单(内部微观粒子较少)的物质的熵。
K(s)和Na(s)的原子结构属同一族,K 的结构较Na 的复杂。
5、定性判断下列反应或过程中熵变的数值是正值还是负值。
(1)溶解少量食盐于水中;(2)活性炭表面吸附氧气; (3)碳与氧气反应生成一氧化碳。
解:(1)熵变为正值;(2)熵变为负值;(3)熵变为正值。
6、利用下列两个反应及其r m G θ∆(298K )值,计算34Fe O (s )在298K 时的标准生成吉布斯函数。
122332()()();(298)742.22r m Fe s O g Fe O s G K kJ mol θ-+=∆=-123344()()3();(298)77.7r m Fe O s Fe s Fe O s G K kJ mol θ-+=∆=-解: 22332()()()2Fe s O g Fe O s += (1)23344()()3()Fe O s Fe s Fe O s += (2)(1)4(2)3⨯+,可得 2343()2()()Fe s O g Fe O s += (3)故 34,,3(298)(298)f m Fe O r m G K G K θθ∆=∆={},1,21(298)4(298)3r m r m G K G K θθ⨯∆⨯+∆={}11(742.2)4(77.7)3kJ mol -⨯-⨯+-= -1015.51kJ mol -7、通过热力学计算说明下列水结冰过程:22()()H O l H O s →在298K 标准状态时能否自发进行。
已知冰在298K 时的标准摩尔生成吉布斯函数为-236.71kJ mol -。
解: 22()()H O l H O s →1(298)/f m G K kJ mol θ-∆ -237.129 -236.7,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-236.7)-(-237.129)﹜1kJ mol -=0.41kJ mol ->0 故在298K 的标准状态时,水结冰的过程不能自发进行。
8、试用教材附录3中的标准热力学数据,计算下列反应的(298)r mS K θ∆和(298)r m G K θ∆(1) 23423()4()4()Fe s H O l Fe O H g +=+ (2) 22()2()()()Zn s H aq Zn aq H g +++=+ (3) 22()()()2()CaO s H O l Ca aq OH aq +-+=+(4) 21()()()2AgBr s Ag s Br l =+解:(1) 23423()4()()4()Fe s H O l Fe O s H g +=+11(298)/m S K J mol K θ-- 27.28 69.91 146.4 130.6841(298)/f m G K kJ mol θ-∆ 0 -237.129 -1015.4 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛130.864×4+146.4-69.91×4-27.28×3﹜11J mol K --= 307.711J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-1015.4)-(-237.129)×4﹜1kJ mol - = -66.91kJ mol -(2) 22()2()()()Zn s H aq Zn aq H g +++=+11(298)/m S K J mol K θ-- 41.63 0 -112.1 130.6841(298)/f m G K kJ mol θ-∆ 0 0 -147.06 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛130.864+(-112.1)-41.63﹜11J mol K --= -23.011J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑= -147.61kJ mol -(3) 22()()()2()CaO s H O l Ca aq OH aq +-+=+11(298)/m S K J mol K θ-- 39.75 69.91 -53.1 -10.751(298)/f m G K kJ mol θ-∆ -604.03 -237.129 -553.58 -157.244,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛(-10.75)×2+(-53.1)-69.91-39.75﹜11J mol K --= -184.311J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑=﹛(-157.244)×2+(-553.58)-(-237.129)-(-604.03)﹜1kJ mol - = -26.911kJ mol -(4) 21()()()2AgBr s Ag s Br l =+11(298)/m S K J mol K θ-- 170.1 42.55 152.2311(298)/f m G K kJ mol θ-∆ -96.90 0 0,(298)(298)r m B m B BS K v S K θθ∆=∑=﹛152.231×12+42.55-170.1﹜11J mol K --= -54.111J mol K --,(298)(298)r m B f m B BG K v G K θθ∆=∆∑= 96.901kJ mol -9、用锡石(SnO 2)制取金属锡,有建议可用下列几种方法:(1)单独加热矿石,使之分解。