非标记型p53抑癌基因的荧光DNA生物传感器
- 格式:pdf
- 大小:1.01 MB
- 文档页数:5

无标记电化学生物传感平台用于癌胚抗原的检测周倩;卢明华【摘要】基于目标物诱导DNA杂交链式反应(HCR)及银纳米颗粒(Ag NPs)自组装过程构建了无标记型电化学生物传感平台,并将其应用于癌胚抗原(CEA)的检测.在目标物存在的情况下,适配体对CEA进行特异性识别并结合,释放出与之互补的触发DNA链(tDNA).该tDNA能够被金电极上的捕获探针(cDNA)捕获,并启动HCR 过程,使得两条发夹DNA链被相继打开并串联成长的DNA双链结构,带正电的Ag NPs通过与该DNA结构之间的静电作用大量自组装到电极表面,并产生强的电化学信号.在优化的实验条件下,该电化学生物传感平台能够在0.5 ng·L-1到50μg·L-1的浓度范围内实现对CEA的良好响应.【期刊名称】《化学研究》【年(卷),期】2018(029)006【总页数】6页(P592-597)【关键词】杂交链式反应;银纳米颗粒;核酸适配体;癌胚抗原;电化学【作者】周倩;卢明华【作者单位】河南大学化学化工学院,河南开封475004;河南大学化学化工学院,河南开封475004【正文语种】中文【中图分类】O657肿瘤标志物是与肿瘤密切相关的活性物质,其在人体内的存在状况或含量变化能够作为肿瘤存在与否的重要判定依据[1]. 癌胚抗原(CEA)是一种应用较为广泛的肿瘤标志物,在健康成人血清中的含量较低,临床参考值为0~5.0 μg·L-1. 其在血清中含量水平的异常往往与一些肿瘤疾病有关,如肺癌以及胃肠癌等[2-3]. 目前,在分析化学领域已经发展了一些生物传感策略用于CEA的检测[4-5]. 其中,电化学生物传感器通过电流等电化学信号实现对目标物的定量检测,具有灵敏度高、检测成本低以及响应时间短等优点[6]. 适配体是功能核酸的重要组成之一,是通过指数富集的配基系统进化技术(SELEX)得到的单链DNA或RNA序列[7-8]. 它可以特异性地识别并结合不同类型的目标物,例如蛋白质、金属离子、小分子甚至细胞等[9-10]. 凭借着目标范围广、化学稳定性好、生产成本低以及易于修饰等优势,适配体一直被作为能够媲美抗体的有效工具,并在分子成像、药物输送、生化研究和临床诊断中得到了广泛的应用[11-12]. 基于适配体的电化学生物传感器能够将二者的优势进行融合,得到同时具有高灵敏度和高特异性的生物传感平台.图1 基于目标物诱导的杂交链式反应及纳米银自组装的无标记电化学生物传感平台原理图Fig.1 Schematic illustration of the label-free electrochemical biosensor based on target-induced HCR and self-assembly of electroactive Ag NPs本文基于核酸适配体设计了一个目标物诱导的杂交链式反应(HCR),并将其与银纳米颗粒(Ag NPs)的自组装过程相结合,构建了一个电化学生物传感平台用于CEA 的高灵敏检测(图1). 目标物的存在能够引起适配体与触发DNA链(tDNA)之间的解离,得到释放的tDNA被捕获到金电极表面并触发HCR过程,形成长的双链DNA结构. 随后,Ag NPs通过与该DNA长链之间的静电作用自组装到电极表面并产生电化学信号. 随着目标物浓度的增加,组装到电极表面的Ag NPs数量随之增加,得到的电化学信号也随之增强. 通过线性扫描伏安法(LSV)测定Ag NPs产生的电流信号实现对目标物的定量检测.1 实验部分1.1 仪器与试剂电化学工作站(μA UTIII. FRA2.v,Eco Chemie,荷兰);Zeta电位仪(Zetasizer Nano S90,英国);透射电子显微镜(TEM)(FEI Titan 80-300,美国).巯基己醇(MCH)和三(2-羧乙基)膦(TCEP)购自东京化学工业公司(日本). 十六烷基三甲基溴化铵(CTAB)购自国药集团(中国),其他试剂均为分析纯级别. 所有的DNA 序列均来自北京鼎国生物技术有限公司(中国),具体的序列如表1所示.表1 本实验使用DNA序列Table 1 Details of the DNA sequences名称序列CEA aptamer5′-ATACCAGCTTATTCAATT-3′Trigger DNA (tDNA)5′-GCCTGGAACGCAGTACAGACAGGTACAATTGAATAAGCTGGTAT-3′Capture DNA (cDNA)5′-SH-TTTTATACCAGCTTAT-3′Hairpin 1 (H1)5′-TCAATTGTACCTGTCTGTACTGCGTTCCAGGCGACTTCAAT ACTGCCTGGAACGCAGTACAGAC-3′Hairpin 2 (H2)5′-GCCTGGAACGCAGTACAGACAGGTACAATTGAGTCTGTAC TGCGTTCCAGGCAGTATTGAAGTC-3′1.2 银纳米颗粒(Ag NPs)的合成本实验中带正电的Ag NPs是以CTAB为保护剂,采用NaBH4作为还原剂合成的[13-14]. 首先,用电子天平称取0.7 mg CTAB,通过超声和搅拌的方法使其充分溶解于30 mL的乙醇-水溶液(5.0%,质量分数,下同)中. 随后,称取0.022 5 g AgNO3加入到之前的CTAB溶液中,超声分散之后,剧烈搅拌15 min,得到均匀分散的无色透明溶液. 向其中缓慢地加入新制的NaBH4水溶液(0.1%),直至无色溶液变成黄绿色胶体. 最后,将制备好的Ag NPs保存在4 ℃的冰箱中储存备用.1.3 金电极的修饰本实验中采用直径为3.0 mm的金电极作为工作电极. 首先,将金电极先后用0.3和0.05 μm的氧化铝粉末充分打磨抛光,用超纯水冲洗之后在丙酮、乙醇和水中分别超声清洗5 min. 随后,用氮气将金电极表面吹干并进行金电极的修饰过程. 同时,将巯基修饰的cDNA用10 mmol·L-1的TCEP处理以消除二硫键的影响. 之后,将金电极浸入含有1.0 μmol·L-1 cDNA的PBS(0.01 mol·L-1, pH=7.4)中并在室温下孵育60 min. 将电极取出并用超纯水冲洗表面后,浸入1 mmol·L-1的MCH溶液中常温下反应1 h以封闭电极表面剩余的活性位点. 用超纯水清洗之后,得到cDNA修饰的金电极.1.4 目标物的检测首先,将tDNA(50 μL, 2.0 μmol·L-1)与CEA适配体(50 μL, 2.0 μmol·L-1)充分混合后在37 ℃的环境下孵育40 min,让二者形成互补的DNA双链结构. 之后,取5 μL该双链结构与5 μL的CEA标准样品充分混合之后滴加到cDNA修饰的金电极表面,并在37 ℃反应50 min. 用pH为7.4的PBS洗涤之后,该电极被浸入H1和H2(各10 μmol·L-1)的混合物中在37 ℃下孵育90 min以进行HCR过程. 随后,金电极被取出并用PBS清洗,将之前合成的Ag NPs滴加到该电极表面反应20 min进行自组装过程. 最后,将该电极用PBS冲洗之后作为工作电极并用三电极体系(Pt丝为辅助电极,Ag/AgCl为参比电极)进行电化学检测. 利用线性扫描伏安法(LSV)在含有0.1 mol·L-1 KCl的PBS(0.1 mol·L-1, pH=7.4)中进行电化学信号的测定.2 结果与讨论2.1 银纳米颗粒的表征首先,采用透射电子显微镜(TEM)对合成得到的Ag NPs进行了形貌表征. 如图2A 所示,该CTAB保护的Ag NPs主要以均匀分散的球形状态存在,且通过粒度分析仪得到的颗粒平均水合粒径约为14 nm. 此外,我们采用Zeta电位仪对合成得到的Ag NPs进行了电负性表征. 如图2B所示,该Ag NPs表面电位为正,且电位值为+ 27.2 mV,这为其通过与带负电的DNA长链之间的静电作用组装到金电极表面提供了重要前提.图2 Ag NPs的(A)TEM图像及粒径分布图(插图);(B)zeta电位分布曲线Fig.2 (A) TEM image (inset: size distribution) and (B) zeta potential of the Ag NPs 2.2 该传感平台的可行性分析为了探究在目标物竞争结合过程中释放出的tDNA能否触发HCR过程的进行,我们采用琼脂糖凝胶(2.0%)电泳进行了考察. 如图3所示,发夹H1链在泳道上呈现一条短而明亮的条带(条带b),在其中加入另一条发夹H2链并孵育一段时间后,观察到的依然是一条短而明亮的条带(条带c),说明H1和H2并不能自发进行HCR过程. 在H1和H2的混合物中继续加入tDNA并充分反应之后,可以发现泳道上出现了冗长的DNA条带(条带d),说明了HCR过程的成功进行.(a) DNA marker; (b) H1; (c) H1 + H2; (d) H1 + H2 + tDNA.图3 HCR过程的琼脂糖凝胶电泳表征Fig.3 Agarose gel electrophoresis analysis of HCR process 为了考察金电极表面的DNA组装情况,我们采用交流阻抗法(EIS)在含有0.1 mol·L-1 KCl和10 mmol·L-1 [Fe(CN)6]3-/4-的PBS(0.1 mol·L-1, pH=7.4)中测试了不同修饰电极的阻抗值,测试结果以图4中的尼奎斯特(Nyquist)图谱表示. 金电极阻抗较小,得到的Nyquist曲线是直径很小的半圆(曲线a). 当cDNA固定到金电极表面之后,得到的半圆直径明显增大(曲线b). 当目标物与适配体发生反应之后,tDNA被释放出来并被cDNA捕获到金电极表面,从而使得阻抗进一步增加(曲线c). 引入H1和H2发夹链之后,HCR过程被触发进行,在电极表面形成长的DNA双链结构,阻抗进一步增加(曲线d). 以上结果说明,目标物的存在能够诱导HCR过程在金电极表面的发生.(a) Au electrode; (b) cDNA + Au electrode; (c) electrode ‘b’ + mixture of CEA and Apt/tDNA structure; (d) electrod e ‘c’ + H1 + H2.图4 电极的EIS 图Fig.4 (A) EIS of the electrode随后,通过循环伏安法(CV)在含有0.1 mol·L-1 KCl的PBS(0.1 mol·L-1, pH=7.4)中对Ag NPs的自组装过程进行了表征. 如图5所示,HCR产物修饰的金电极在未进行Ag NPs的组装过程之前,其CV曲线中不能观察到明显的氧化还原峰存在(曲线a). 而在进行Ag NPs的自组装之后,可以观察到一对非常明显的氧化还原峰(曲线b). 由此可见,Ag NPs可以通过与HCR产物之间的静电作用自组装到金电极表面并产生明显的电化学信号.图5 电极与AgNPs反应(a)前、(b)后的CV曲线Fig.5 CV curves of electrode (a) before and (b) after reaction with Ag NPs在含有0.1 mol·L-1 KCl的PBS(0.1 mol·L-1, pH=7.4)中测定了该传感平台在有无目标物时的LSV曲线. 如图6所示,在没有目标物CEA时,得到的LSV曲线(曲线b)与背景信号(曲线a)几乎一致. 而当体系中存在CEA(以1.0 μg·L-1为例)时,得到的LSV峰电流明显增强(曲线c). 以上结果证明,本方案对CEA的检测具有较好的可行性.(a) background signal; (b) without CEA; (c) with CEA.图6 电极的LSV曲线Fig.6 LSV curves of the electrode2.3 实验条件的优化为了得到最佳的实验效果,本实验以1.0 μg·L-1的CEA为例对反应过程中涉及到的相关实验条件进行了优化. 首先,对目标物的反应时间进行了优化,如图7A所示,随着目标物CEA反应时间的增加,该传感体系的LSV峰电流值也逐渐增强. 当反应时间增加到50 min以后,该传感平台得到的电流信号停止增长并趋于稳定. 因此,本实验采用50 min作为目标物CEA的反应时间. 随后,对HCR过程的进行时间进行了优化. 如图7B所示,随着HCR反应时间的不断增加,该电化学传感平台得到的电化学信号也不断增强并在90 min时得到最大值,更长的反应时间并不会引起LSV电流的明显增加. 因此,本实验选择90 min作为HCR过程的反应时间. 此外,也对Ag NPs在金电极表面的组装时间进行了优化. 如图7C所示,LSV电流信号随着Ag NPs组装时间的增加而不断增长,并且在20 min处达到了最大值,继续增加反应时间并不会观察到明显的电流变化. 所以,20 min被作为Ag NPs组装过程的反应时间.2.4 该传感平台的分析性能在优化的实验条件下,将该电化学生物传感器用于含有不同浓度CEA样品的检测. 如图8A所示,该电化学传感体系得到的LSV电流信号随着样品中CEA浓度的增加而不断增大,且LSV峰电流值与CEA浓度的对数在0.5 ng·L-1到50 μg·L-1的浓度范围内呈现出良好的线性关系(图8B),得到的线性回归方程为I = 26.347 × lg C[CEA] + 43.123(R2 = 0.998 7). 检测限为0.17 ng·L-1. 为了考察该电化学生物传感平台对于目标物CEA测定的选择性,我们将该传感平台用于包括甲胎蛋白(AFP)、免疫球蛋白G(IgG)、前列腺抗原(PSA)以及癌抗原125(CA 125)在内的干扰物质. 其中,CEA浓度为1.0 μg·L-1,干扰物浓度为10 μg·L-1. 从图8C中可以看出,只有CEA能够引起LSV峰电流值的明显增加,此外,这些干扰物质与样品中CEA的共存并不会对传感器的电流响应产生明显影响. 以上结果表明,该传感平台对于CEA的检测具有较好的选择性.(A)CEA反应时间;(B)HCR反应时间;(C)Ag NPs组装时间.图7 实验条件的优化Fig.7 Optimization of experimental conditions图8 该电化学传感器对CEA的(A)LSV响应曲线;(B)线性拟合曲线;(C)选择性Fig.8 (A)LSV curves of the electrochemical sensor; (B) Calibration curve. (C) Selectivity of the electrochemical sensor2.5 该传感平台的初步应用为了考察该电化学生物传感平台在血清样品中的分析能力,我们将其应用于6个血清样品中CEA的检测. 将测试的结果与CEA酶联免疫法(ELISA)试剂盒的检测结果进行对比,并通过t检验法验证两种方法测试结果的一致性. 如表2所示,在置信度为95%时,所有样品测试结果的texp均小于tcrit(tcrit[0.05,4] = 2.78). 以上结果说明,该电化学生物传感平台的测试结果与ELISA试剂盒具有较好的一致性,具备在复杂样品中进行CEA测试的应用潜力.表2 该电化学生物传感平台与ELISA试剂盒测试结果对比Table 2 Comparisonof results obtained by the electrochemical sensing system and commercial ELISA kitSample No.Method; Concentration [mean ± SD, μg·L-1, n = 3]This assayCEA ELISAkittexp10.94±0.061.01±0.051.4522.94±0.193.04±0.180.6539.57±0.5110.47±0.532.13420.75±1.7622.05±1.341.0154.90±0.415.52±0.391.88615.37±1.14 14.03±1.011.513 结论基于目标物诱导的HCR过程和Ag NPs的自组装过程设计了一个具有高灵敏度、高选择性的电化学生物传感平台用于CEA的检测. HCR过程的进行有助于灵敏度的提升;Ag NPs通过静电作用自组装到电极表面,不需要另外标记,简化了操作步骤;适配体与目标物之间的高亲和力则构成了该传感体系对于目标物高选择性检测的重要基础. 此外,由于适配体具有普遍适用性,通过改变适配体以及其他DNA的序列设计,该传感体系有望进一步扩展到其他小分子、蛋白质以及细胞等与医疗诊断和环境监测相关目标物的检测.参考文献:【相关文献】[1] STURGEON C. Practice guidelines for tumor marker use in the clinic [J]. Clinical Chemistry, 2002, 48(8): 1151-1159.[2] GRUNNET M, SORENSEN J B. Carcinoembryonic antigen (CEA) as tumor marker in lung cancer [J]. Lung Cancer, 2012, 76(2): 138-143.[3] HAMMARSTRÖM S. The carcinoembryonic antigen (CEA) family: structures, suggested functions and expression in normal and malignant tissues [J]. Seminars in Cancer Biology, 1999, 9(2): 67-81.[4] YANG X, ZHUO Y, ZHU S, et al. Selectively assaying CEA based on a creative strategy of gold nanoparticles enhancing silver nanoclusters’ fluorescence [J]. Bios ensors and Bioelectronics, 2015, 64: 345-351.[5] WANG D, LI Y, LIN Z, et al. Surface-enhanced electrochemiluminescence of Ru@SiO2 for ultrasensitive detection of carcinoembryonic antigen [J]. Analytical Chemistry, 2015,87(12): 5966-5972.[6] KIM Y S, SU J L, GU M B. Electrochemical aptamer-based biosensors [J]. Biochip Journal, 2008, 2(3): 175-182.[7] LAO Y H, PHUA K K, LEONG K W. Aptamer nanomedicine for cancer therapeutics: barriers and potential for translation [J]. ACS Nano, 2015, 9(3): 2235-2254.[8] PAN W, CLAWSON G. The shorter the better: reducing fixed primer regions of oligonucleotide libraries for aptamer selection [J]. Molecules, 2009, 14(4): 1353-1369. [9] GOULKO A A, LI F, LE X C. Bioanalytical applications of aptamer and molecular-beacon probes in fluorescence-affinity assays [J]. Trends in Analytical Chemistry, 2009, 28(7): 878-892.[10] ZHOU J, BATTIG M R, WANG Y. Aptamer-based molecular recognition for biosensor development [J]. Analytical & Bioanalytical Chemistry, 2010, 398(6): 2471-2480.[11] ZHOU W, HUANG P J, DING J, et al. Aptamer-based biosensors for biomedical diagnostics [J]. Analyst, 2014, 139(11): 2627-2640.[12] DENG B, LIN Y, WANG C, et al. Aptamer binding assays for proteins: the thrombin example-a review [J]. Analytica Chimica Acta, 2014, 837: 1-15.[13] GANG W, LI W, ZHOU H, et al. Electrostatic assembly of CTAB-capped silver nanoparticles along predefined λ-DNA template [J]. Applied Surface Science, 2005, 252(5): 1189-1196.[14] ZHUANG J, FU L, XU M, et al. Sensitive electrochemical monitoring of nucleic acidscoupling DNA nanostructures with hybridization chain reaction [J]. Analytica Chimica Acta, 2013, 783(11): 17-23.。

非标记型p53抑癌基因电化学DNA生物传感器的研究刘萍;刘晓琴;王书民;金振国【摘要】基于发夹型核酸探针的高特异性识别能力以及电活性物质与DNA磷酸骨架间的静电作用,以发夹型核酸作为分子识别探针,电活性物质六氨合钌(RuHex)作为杂交指示剂,构建了一种非标记型检测p53抑癌基因的电化学DNA生物传感器.实验结果表明,在10 μmol/L RuHex溶液中,该传感器对目标DNA具有灵敏的电化学响应,电化学信号与目标DNA浓度在2.5~10 nmol/L范围内呈线性关系,检出限达2.5 nmol/L.根据电化学信号的差异可区别完全互补目标DNA、单碱基突变DNA和随机DNA分子.考察了单碱基突变位点不同的目标DNA分子与发夹型核酸探针的杂交效率,结果表明突变位点不同会影响发夹型核酸探针与目标DNA 的杂交效率.该传感器具有选择性好、无需标记、简单等优点.【期刊名称】《分析测试学报》【年(卷),期】2011(030)007【总页数】6页(P739-744)【关键词】发夹型核酸探针;RuHex;p53基因;电化学DNA生物传感器【作者】刘萍;刘晓琴;王书民;金振国【作者单位】商洛学院化学与化学工程系,陕西商洛726000;陕西师范大学化学与材料科学学院,陕西西安710062;陕西师范大学化学与材料科学学院,陕西西安710062;商洛学院化学与化学工程系,陕西商洛726000;商洛学院化学与化学工程系,陕西商洛726000【正文语种】中文【中图分类】O657.1;0629.74DNA生物传感器是以核酸作为分子识别元件,将目标物的存在转变为可检测的电、光、声等信号的器件或装置。
因在检测特定序列基因及基因突变时具有灵敏度高、响应快、操作简便、价格低廉、仪器简单等优点,DNA生物传感器越来越受到研究者的重视,被广泛应用于疾病预防、诊断和治疗。
电化学DNA传感器将探针与目标物质的识别过程用电化学分析方法检测,具有成本低、仪器便于携带、可适时检测等优点,尤其适合受环境、时间、费用等限制的检测,被广泛用于与基因相关疾病的诊断、食品检验、环境监测及军事反恐等领域[1-6]。

X raydiffraction(XRD)andenergydispersespectroscopy(EDS)wereemployedtoanalyzetheingredientsandel ementsdistributionofscaffold,respectively.Additionally,thecompressionstrengthofthescaffoldwastestedbymechanicaluniversaltestingmachine.Thebiocompatibilityofthescaffoldandthecellviabilityresearchwerechar acterizedviaCCK 8assayandLive/Deadstaining,respectively,andthecelladhesionwasstudiedbyDPAI/Phal loidinefluorescencestaining.qRT PCRwasemployedtoinvestigatetheexpressionlevelofosteogenic relatedgenesuchasBMP2,RUNX2andCOL1.ALPstainingwascarriedouttomeasuretheosteogenicdifferentiationeffectofBMSCs.Results TheCS β TCPscaffoldwascomprisedofbulkparallel,alignedandthinlamellaswithmanypor ousstructures.β TCPparticleswereevenlydistributedoverCSframeworklayersandtheCS βTCPscaffoldpos sessexcellentelasticpropertyandbiocompatibility,moreover,thecellseededonscaffoldrevealedhighcellviabili tyandcontinuousproliferation.qRT PCRandALPstainingresultsdemonstratedthattheCS β TCPscaffoldcouldinduceosteogenicdifferentiationofBMSC.Conclusion Tosumup,theCS β TCPscaffoldexpresseddesiredme chanicalandbiologicalproperties,andcouldinduceBMSCdifferentiateintoosteoblast,thecompositescaffoldpro videdapromisingstrategyforbonedefectregeneration.Keywords Chitosan;β TCP;compositescaffold;bidirectionallyophilizationtechnique;osteogenicdifferentia tion网络出版时间:2022-06-289:49 网络出版地址:https://kns.cnki.net/kcms/detail/34.1065.r.20220624.1741.020.html基于miR 15a 5p/P53信号通路探讨EMT与肺癌细胞阿霉素耐药的关系魏 东1,辛运超2,刘 博3,容 宇1,李彦明1,郝雁冰1摘要 目的 探讨miR 15a 5p在肺癌细胞对阿霉素(DOX)耐药中的作用,并阐明其与DOX耐药之间的功能和机制联系。

生物传感器在肿瘤检测中的应用肿瘤是指一种恶性肿瘤,也是现代医学所面临的重大问题之一。
随着科技的不断发展,研究人员发现生物传感器可以在肿瘤检测中发挥重要作用。
本文将介绍生物传感器在肿瘤检测中的应用,以及其优点和局限性。
生物传感器是一种可以检测和转换生物参量(如DNA、蛋白质、细胞、透明质酸等)变化为可读信号的装置。
肿瘤检测中最常用的生物传感器是基于抗体-抗原反应的传感器,即利用特定的抗体结合特定的抗原来检测肿瘤标志物,从而实现肿瘤的诊断和治疗。
例如,目前已经开发出的肿瘤标志物检测生物传感器可以检测人类胰腺癌标志物CA19-9、白血病标志物BCR-ABL、卵巢癌标志物CA125等,其中最常用的是CA19-9。
CA19-9是胰腺癌和结直肠癌等恶性肿瘤常用的肿瘤标志物,其存在可以提示患者是否患有相关癌症。
生物传感器检测肿瘤标志物的原理基于生物学抗原抗体作用,利用特异性识别,高灵敏度、高特异性的特点进行肿瘤标志物检测。
具体地,生物传感器中的抗体(也可以是核酸、酶等)通过膜蚀刻、电沉积等技术固定在传感器的材料表面上,待检测样本中的抗原与固定抗体结合后,导致生物传感器发生一系列电化学反应,最终反应产物被电化学检测,并转换为可视和可读的数字信号,从而实现肿瘤标志物的检测和诊断。
生物传感器在肿瘤检测中的应用具有几个优势。
首先,生物传感器检测肿瘤标志物的灵敏度高,可以检测到低浓度的肿瘤标志物,因此可以在肿瘤早期发现、早期诊断,从而提高治疗的成功率。
其次,生物传感器在检测过程中不需要多余的试剂,很大程度上减少了试剂的使用和化学废料的产生,同时检测过程简便、快速、经济,大大提高了检测的效率。
最后,生物传感器的检测过程不依赖于实验环境和设备复杂性,不需要专业技能和复杂实验室设备,可以在临床医疗现场实时检测肿瘤标志物,非常方便,节约了患者时间和财力。
当然,生物传感器在肿瘤检测中也存在一些局限性。
首先,生物传感器只能检测到已知的肿瘤标志物,对于未知的肿瘤标志物无法有效检测,限制了其应用范围。

《碳点作为基因载体递送p53基因用于肝癌治疗的研究》篇一一、引言随着科技的发展和医疗水平的提升,基因治疗已经成为当前治疗许多重大疾病的一种前沿手段。
在肝癌的治疗中,如何有效递送p53基因成为了一个重要的研究课题。
近年来,碳点(Carbon Dots, CDs)作为一种新型的纳米材料,因其良好的生物相容性、易于合成和优异的荧光性能,被广泛应用于生物医学领域。
本文旨在探讨碳点作为基因载体递送p53基因在肝癌治疗中的应用。
二、碳点与基因治疗碳点是一种由碳元素组成的纳米材料,具有优异的荧光性能和良好的生物相容性。
近年来,越来越多的研究表明,碳点可以作为基因载体,用于递送DNA、RNA等生物大分子。
其独特的物理化学性质使得碳点在基因递送过程中具有较高的稳定性和较低的毒性。
三、p53基因与肝癌治疗p53基因是一种重要的肿瘤抑制基因,能够调控细胞周期、促进细胞凋亡等生物学过程。
在肝癌中,p53基因的突变或缺失导致肿瘤细胞的增殖失控,从而加速了肝癌的进展。
因此,通过基因治疗手段恢复或增强p53基因的表达,对于肝癌的治疗具有重要意义。
四、碳点作为p53基因载体的应用利用碳点的优良性能,我们可以将其作为p53基因的载体,通过将其与p53基因结合,形成CDs-p53复合物,从而实现p53基因的有效递送。
研究表明,这种CDs-p53复合物能够有效地穿透细胞膜,进入细胞内部,并将p53基因递送到靶细胞中。
此外,碳点的荧光性能还可以用于实时监测基因递送过程和评估治疗效果。
五、实验方法与结果我们通过合成不同大小的碳点,并优化其与p53基因的结合条件,得到了高效的CDs-p53复合物。
将该复合物应用于肝癌细胞模型中,我们发现CDs-p53复合物能够有效地将p53基因递送到肝癌细胞中,并恢复或增强其表达水平。
此外,我们还发现CDs-p53复合物能够显著抑制肝癌细胞的增殖,并诱导其凋亡。
同时,由于碳点的荧光性能,我们可以通过荧光显微镜实时监测CDs-p53复合物在细胞内的分布和转导过程。
结晶紫光谱探针法无标记检测Pb^(2+)的DNA生物传感器刘萍;陈凤英;王香婷;于燕;熊泽东【期刊名称】《分析科学学报》【年(卷),期】2015(31)6【摘要】基于Pb^(2+)与凝血酶适配体(Thrombin Aptamer,TBA)特异性结合,以及结晶紫(CV)与凝血酶适配体、G-四链体结合后荧光信号的差异,建立了一种简单、灵敏、无需标记检测Pb2+的DNA生物传感器。
实验研究了不同浓度的Pb^(2+)引起CV/TBA体系荧光强度变化的规律,考察了DNA序列、TBA与CV浓度比,以及稳定时间等因素对检测灵敏度的影响。
实验结果表明:大多数金属离子无明显干扰,在最优实验条件下,Pb^(2+)浓度在5~50nmol/L范围内与体系荧光强度的变化呈良好的线性关系(r=0.9984),检测限(S/N=3)为2.0×10^(-9) mol/L。
【总页数】4页(P851-854)【关键词】结晶紫;凝血酶适体;Pb2+;G-四链体【作者】刘萍;陈凤英;王香婷;于燕;熊泽东【作者单位】商洛学院化学工程与现代材料学院,陕西商洛726000;陕西省尾矿资源综合利用重点实验室,陕西商洛726000【正文语种】中文【中图分类】O657.39【相关文献】1.荧光标记DNA探针用于水溶液中Hg~(2+)的检测 [J], 郭俊红;孔德明2.核酸适体修饰纳米金共振散射光谱探针快速检测痕量Pb~(2+) [J], 凌绍明;范燕燕;蒋治良;温桂清;刘庆业;梁爱惠3.高频电感耦合等离子体光谱法研究甲基丙烯酸甲酯接枝氰乙基化交联淀粉对Pb^(2+),Cr^(6+),Cd^(2+),Cu^(2+),Mn^(2+),Fe^(3+)的吸附 [J], 乌大年;李悦;庄晓;巫拱生;吴凤从4.荧光标记DNA探针用于水溶液中Hg^2+的检测 [J], 郭俊红;孔德明5.表面增强拉曼光谱无标记检测含GCGC四分体的DNA结构 [J], 鲍莹;项晓璇;孙溧康;国新华因版权原因,仅展示原文概要,查看原文内容请购买。
专利名称:基于纳米探针直接检测肺癌样品中P53基因突变的方法
专利类型:发明专利
发明人:毛红菊,贾春平,金庆辉,赵建龙
申请号:CN200710170614.4
申请日:20071119
公开号:CN101392286A
公开日:
20090325
专利内容由知识产权出版社提供
摘要:本发明涉及的是一种基于纳米探针直接检测肺癌样品中p53基因突变的方法,其特征在于未标记的靶核酸序列以及纳米金标记的信号探针与固相支持物连接的捕获探针进行的夹心杂交,并通过银染增强的纳米金信号放大效应产生高灵敏的识别信号。
该方法能够检测未扩增的基因组DNA样品中的单碱基突变。
与传统的基于荧光信号检测的方法相比,本发明提供的纳米芯片检测方法大大提高了检测的灵敏度和特异性,并可通过普通的光学扫描仪或者普通的电荷藕合器件(CCD)数字照相机就可以对杂交信号进行采集和分析,也可通过相关软件进行分析,得出检验报告。
申请人:中国科学院上海微系统与信息技术研究所
地址:200050 上海市长宁区长宁路865号
国籍:CN
代理机构:上海智信专利代理有限公司
代理人:潘振甦
更多信息请下载全文后查看。
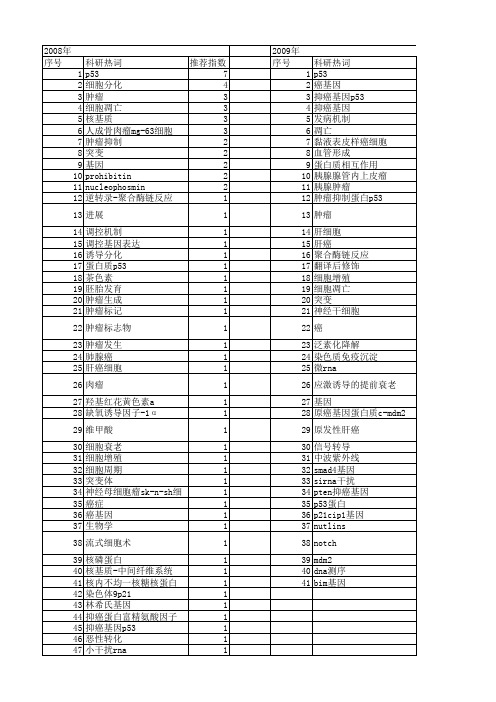
第39卷 第2期陕西师范大学学报(自然科学版)Vol.39 N o.22011年3月Journal of Shaanx i Norm al U niversity (Natur al Science Edition)M ar.2011文章编号:1672 4291(2011)02 0045 05收稿日期:2010 04 14基金项目:国家自然科学基金资助项目(20705017).作者简介:刘萍,女,讲师,主要研究方向为生物传感器和生命分析.E mail:liupingcheng hui@126.co m.*通信作者:金燕,女,副教授,博士.E mail:jinyan@.非标记型p 53抑癌基因的荧光DNA 生物传感器刘 萍1,2, 白金燕1, 金 燕1*(陕西师范大学化学与材料科学学院,陕西西安710062;2商洛学院化学与化学工程系,陕西商洛726000)摘 要:基于发夹型核酸探针的高特异性识别能力以及结晶紫与单、双链DNA 结合后荧光强度的差异,以发夹型核酸作为探针,构建了一种非标记型检测p 53抑癌基因的荧光DNA 生物传感器.此传感器不但能够区分完全互补、单碱基突变和随机目标DNA 序列,而且还能识别不同突变位点的单碱基突变序列.在0.05~5.00 mol/L 范围内,完全互补目标DNA 的浓度与体系的荧光增强效率呈线性关系,检出限为5 10-8m ol/L.该方法已应用于检测正常和单碱基突变的p 53基因.关键词:发夹型核酸探针;结晶紫;p 53基因;荧光DNA 生物传感器中图分类号:O657.3 文献标识码:ALabel free fluorescence DNA biosensor for detection of p 53tu mor suppressor geneLiu Ping 1,2,Bai Jin y an 1,Jin Yan1*(1Colleg e of Chem istry and M aterials Science,Shaanx i No rmal U niv ersity,Xi an 710062,Shaanx i,China;2Department of Chem istry and Chem ical Engineering,Shang luo U niversity,Shang luo 726000,Shaanx i,China)Abstract:A label free fluo rescence biosensor has been developed for detectio n of p 53tumo r suppressor gene based on the specific recog nition of hairpin DNA and fluo rescence difference derived fr om interactions of cry stal v iolet (CV )with the ssDNA and dsDN A.The results indicated that this metho d can easily discriminate com plementary targ et DNA fro m single base mutation olig onucleo tide and random o lig onucleotide.And it also could distinguish the mutation site of sing le base mutation olig onucleo tide.In the range o f 0.05 5 mol/L,the co ncentratio n of com plementary sequence w as linear w ith the chang e of the fluo rescence signal of CV,and the detection limit w as 50nm ol/L.T his m ethod can be used in detecting no rmal and single base mutation p 53g ene.Key words:hair pin DNA;crystal violet;p 53gene;fluor escence DNA bio sensor DNA 生物传感器是以核酸作为分子识别元件,将目标物的存在转变为可检测的电、光、声等信号的器件或装置,它与传统的分析方法相比,具有快速、灵敏、操作简便、成本低,不需放射性标记等优点.因此近几年,基于核酸特异性识别的DNA 生物传感器已被广泛应用在疾病诊断、食品检验、环境监测以及军事反恐等领域[1 4].目前,常见的DNA 生物传感器主要有质量敏感型、热敏型、场效应型、光学和电化学等类型.荧光DNA 生物传感器具有操作简单、快速、灵敏度高、选择性好,大多在均相溶液中反应等优势,越来越受到研究工作者的广泛关注[5 9].DNA 生物传感器的识别元件核酸探针是它进行选46 陕西师范大学学报(自然科学版)第39卷择性测定的基础,核酸探针的设计与选择直接影响DNA 生物传感器的性能.与传统的直链探针相比较,发夹型核酸探针(H PDNA)对目标物具有更高的特异性识别能力.近几年来,发夹型核酸探针已经在构建生物传感器方面取得了很大进展[10 11].正常p 53基因具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡的生物学功能,如果p 53基因发生突变,就可能引起细胞癌变.研究表明,50%的癌症与p 53基因突变有关[12 15],因此,p 53基因突变的检测是非常重要的.本文基于结晶紫与单、双链DNA 结合后荧光强度的差异,以发夹型核酸作为分子识别探针,结晶紫作为荧光信号分子,构建一种简单、快速、选择性好、非标记型检测p 53抑癌基因的荧光DNA 生物传感器.考察传感器对p 53基因识别的特异性以及目标序列的浓度和荧光增强效率之间的关系,研究单碱基突变位点对发夹型核酸探针与目标DNA 杂交效率的影响.1 实验1.1 试剂与仪器发夹型核酸探针:5 SH CGAGC GTT CAT GCC GCC CAT GCTCG 3 ;目标DNA (cDNA ):5 AT G GGC GGC ATG AAC 3 ;单碱基突变DNA1(misDN A1):5 ATG AGC GGC A TG AAC 3 ;单碱基突变DNA2(misDNA2):5 AT G GGC AGCA TGAAC 3 ;单碱基突变DNA3(misDNA3):5 AT G GGC GGC A TA AA C 3 ;随机序列DNA (RDN A):5 CAT AAG CTA CCA CAA 3 均购自于上海生物工程有限公司,均用25mmo l/L Tr is H Cl,pH =7.0的缓冲溶液配制成100 mo l/L 的储备液.结晶紫(CV),KCl,M gCl 2,无水乙醇等所用试剂均为分析纯,实验用水均为超纯水.F 7000FL 荧光分光光度计(日立,日本),电子分析天平(瑞士梅特勒 托利多仪器有限公司),TG16离心机(湖南英泰仪器有限公司).1.2 实验方法取10 mo l/L 结晶紫溶液于微量比色皿中,检测其荧光光谱.保持结晶紫的浓度不变,加入5 mol/L H PDNA ,混合均匀后放置30m in,再检测其荧光光谱,然后依次加入浓度分别为0.05、0.1、0.5、1、2、5 mol/L 的目标DNA(互补、突变、随机序列的DNA),培育5min,混合均匀后,再进行荧光检测,观察荧光强度的改变.其中激发波长E x =585nm,发射波长E m 扫描范围为600~750nm ,激发光狭缝为10nm,发射峰狭缝为10nm.实验中所用缓冲溶液均为含100mm ol/L KCl(或100mmo l/L M gCl 2)的25mmo l/L T ris H Cl(pH =7.0).2 结果与讨论2.1 实验原理及验证结晶紫属于三苯甲烷类染料,分子内容易发生振动,导致平面结构发生扭曲,光活性降低,因此本身荧光信号很弱.当与一些大分子(蛋白质、DNA 等)结合后,由于振动受阻,会使结晶紫的荧光信号增加[16 19].与单链相比较,结晶紫和双链DNA 结合后,荧光信号增加较多.另外,与传统的直链探针相比较,发夹型核酸探针对目标物具有更高的特异性识别能力,利用此优势,本文以发夹型核酸作为分子识别探针,结晶紫作为荧光信号分子,构建了一种非标记型检测p 53抑癌基因的荧光DNA 传感器.当发夹型核酸探针与结晶紫混合后,由于振动受阻,结晶紫的荧光信号增加,目标核酸序列加入后,与发夹型核酸探针的茎环部位杂交,双链的形成使结晶紫的荧光信号又有一定程度的增加,因此可以通过目标核酸与探针杂交前后,结晶紫荧光信号的改变,实图1 不同条件下CV 的荧光光谱图Fig.1 Fluorescence emission spectra of C V at diff erent experiment conditionsa.10 mo l/L CV ;b.10 mo l/L CV +5 mo l/L HP DN A;c 10 mol/L CV +5 mol/L HP DN A +5 mol/L cDN A.现对目标核酸的定性、定量检测.为了验证该方法的可行性,我们测定了结晶紫及其中依次加入H PDNA 和完全互补目标DNA (cDNA)前后的荧光光谱,结果如图1所示.图中曲线a 为结晶紫的荧光光谱,曲线b 为加入H PDNA 后结晶紫的荧光光谱,曲线c 为加入cDNA 以后,CV/H PDNA 体系的荧光光谱.可以看出,结晶紫本身荧光信号很弱,与发夹型DNA 探针结合后,结晶第2期刘萍等:非标记型p 53抑癌基因的荧光DN A 生物传感器47紫的荧光信号显著增加,加入目标DNA 分子后,荧光信号进一步增加,这与实验原理是一致的.2.2 金属离子对传感器性能的影响不同的金属离子对传感器的性能可能有影响,因此考察了K +和M g 2+两种金属离子对传感器性能的影响,结果如图2所示.图中曲线a 为在含有100m mol/L M gCl 2的缓冲溶液中,CV/H PDNA 体系荧光增强效率[F -F 0]/F 0与cDNA 浓度的关系图.曲线b 为含有100mmo l/L KCl 的缓冲溶液中,CV/H PDNA 体系荧光增强效率[F -F 0]/F 0与cDNA 浓度的关系图,其中F 0和F 分别表示cDNA 加入前后,体系在630nm 处的荧光强度.从图中可以看出,在含有100mmo l/L KCl 的缓冲溶液中,CV/H PDNA 体系的荧光增强效率随着cDN A 浓度增加而明显增加.而在含有100mmo l/L M g Cl 2的缓冲溶液中,随着cDNA 浓度增加,体系的荧光增强效率变化较小.因此实验均在含有100m mol/L KCl 的缓冲溶液中进行.图2 金属离子对HPDNA 与完全互补DNA 分子杂交的影响Fig.2 The ef fects of Mg 2+,K +concentration on the DNA hybridization between HPDNA andcomplementary DNAs a.M g 2+; b.K +2.3 传感器对目标序列的识别DNA 生物传感器需解决的一个关键问题是能够特异性识别目标分子,因此,我们考察了该传感器对特定DNA 片段识别的选择性.图3为该DNA 生物传感器与完全互补、单碱基突变和随机DNA 序列杂交前、后,体系荧光效率(F/F 0)变化的柱状图,F 0和F 分别表示与不同序列DNA 杂交前、后,体系在630nm 处的荧光强度.图中黑柱和白柱分别表示探针与不同序列DNA 杂交前、后,CV/H PDNA 体系的荧光效率(F/F 0).从图中可以看出,探针与完全互补和单碱基突变的DNA 序列杂交后,体系的荧光强度都有所增加,而随机DNA 序列的加入,却几乎没有引起荧光强度改变.另外,与完全互补DNA 序列杂交后,体系荧光强度增加的幅度比单碱基突变DNA 序列的要大得多.因此,此方法能够区分完全互补、单碱基突变、随机序列的目标DN A 分子,选择性好.图3 CV/HPDNA 体系与不同序列的DNA 杂交前后荧光效率(F/F 0)变化的柱状图Fig.3 Bar chart on fluorescence effeciency (F/F 0)of C V in presence HPDNA and diff erent target DNAs2.4 单碱基突变位点对DNA 杂交的影响单核苷酸多态性(singlenucleotidepolym orphism,SNP)主要是指在基因组水平上单个核苷酸的变异所引起的DNA 序列多态性.研究SNP 有助于解释及防治个体的表现差异以及个体对各种药物的耐受性和遗传性疾病的诊治.发夹型核酸探针具有较高的特异性识别能力,可灵敏的检测单碱基突变DNA.为了进一步研究此方法的选择性,我们考察了单碱基突变位点对DNA 杂交效率的影响,结果如图4所示.图中曲线a 、b 、c 分别为H PDNA 与misDNA1(突变位点在序列的左端)、m isDNA2(突变位点在序列的中间)、misDNA3(突变位点在序列的右端)杂交后,CV/H PDNA 体系荧光增强效率[F -F 0]/F 0与DN A 浓度的关系图,F 0和F 分别表示加入不同序列DNA 前后体系的荧光强度.可以看出,体系的荧光强度随不同单碱基突变位点的目标DNA 浓度的增加而增加,但是增加的幅度却有所差异.突变位点在DNA 序列两端的m isDNA1和m isDNA3与H PDNA 杂交后,体系的荧光强度增加较多.而在相同浓度下,突变位点在DNA 序列中间的m isDNA2与H PDNA 杂交后,体系的荧光强度增强幅度较小.这一结果不但表明单碱基突变位点会影响H PDNA 探针与目标DNA 分子的杂交效率,而且也说明此方法能够较好地区分单碱基突变位点不同的目标DNA 序列.48 陕西师范大学学报(自然科学版)第39卷图4 单碱基突变位点对发夹型DNA 与目标DNA 杂交效率的影响Fig.4 The effect of mutation site on the hybridizationeff iciency between HPDNA and target DNA s.a .misDN A 1; b.misDN A2; c.misDN A3.2.5 p 53基因的定量检测由实验结果可知,目标DNA 与H PDNA 杂交前后,体系的荧光强度会发生改变,因此可以通过荧光强度的改变实现对完全互补目标DNA (cDNA )的定量检测.图5为与不同浓度cDNA 作用后,CV/H PDNA 体系的荧光光谱图;图6为CV/H PDNA 体系的荧光增强效率与cDNA 浓度的校准曲线图.从图中可以看出,体系的荧光强度随cDNA 浓度的增大而增加(图5),在0.05~5 mo l/L 范围内,cDNA 的浓度与体系的荧光增强效率呈线性关系(图6),其线性方程为Y =0.09+0.23X ,线性相关系数R =0.9983,检出限为5 10-8mo l/L.图5 CV/HPDNA 体系与cD NA 作用的荧光光谱图Fig.5 Emission spectra of HPDNA/C V in presence ofcDNA with different concentration3 结论利用发夹型核酸探针的高特异性识别能力以及结晶紫与单、双链DNA 结合后荧光强度的差异,以发夹型核酸作为探针,结晶紫作为荧光信号分子,构建了一种非标记型检测p 53基因的荧光DNA生物图6 p 53基因检测的校准曲线Fig.6 The calibration plots for p 53gene measurements传感器.实验结果表明,该荧光DNA 生物传感器能够选择性地识别完全互补、单碱基突变以及随机的目标DN A 序列.通过单碱基突变位点对HPDNA 探针与目标DNA 分子杂交效率的影响,实现对不同突变位点的识别.另外,在0.05~5 mol/L 范围内,完全互补目标DNA 的浓度与体系的荧光增强效率呈线性关系,检出限为5 10-8mol/L.该方法具有快速、简单、选择性好,无需任何标记等优点,为检测正常以及单碱基突变的p 53基因提供了一个较好的荧光分析途径.参考文献:[1]Pournag hi A M H,H ejazi E M S.Developing an electr ochemical deox yr ibo nucleieaeid (D NA )biosenso r on the basis of human inter leukine 2gene using an eleetr o activ e label [J].A nalyt ica Chimica A cta,2006,570(2):144 150.[2]Bisho p J.Bio sensor for D NA sequence det ection [J].Bio sensor s and Bio electro nics,2006,6(6):1016 1020.[3]Pato lsky F,W eizmann Y ,Willner I.R edox act ive nucleic acid r eplica for the amplified bioelectr ocatalytic de tectio n of viral DN A [J ].Jour nal o f the A merican Chemical So ciety,2002,124(9):770 772.[4]Er dem A ,Ka radeniz H.Electro chemical g enemag net icassay fo r the detectio n of hepatitis B v irus DN A in poly mer ase chain r eact ion amplicons by using disposable sen sor techno lo gy [J].Electr ochemistry Co mmunicatio ns,2005,7(8):815 820.[5]Chen Xiao,Zhang Xianer ,Cha i Yiquan,et al.D NA o ptica l senso r a rapid met ho d for the det ection o f D NA hy bridization [J].Bio sensor s and Bioelectro nics.1998,13(4):451 458.[6]W ang Wenjuan,Chen Chunlai,Q ian M inx ie,et al.Aptamer biosenso r for pro tein detect ion using go ld nano part icles [J].A nalytical Bio chemist ry,2008,373(2):213 219.第2期刘萍等:非标记型p53抑癌基因的荧光DN A生物传感器49[7]Fang Xiao hong,T an Weiho ng,Sen A r up.Sy ntheticDN A aptamer s to detect pr otein molecular v ariants in a hig h t hr oughput fluo rescence quenching assay[J].ChemBiochem,2003,4(9):829 834.[8]L i N a,H o Chihming.A ptamer based optical pro besw ith separat ed molecular r eco gnit ion and sig na l trans ductio n mo dules[J].Jo ur na l o f the A merican Chemical Society,2008,130(8):2380 2381.[9]Wang Jing,L iu Bin.F luor escence resonance energ ytr ansfer betw een an anionic co njugated polymer and a dye labeled lysozyme aptamer fo r specific lysozyme de tect ion[J].Chemical Communicat ions,2009,17:2284 2286.[10]Jin Yan,Y ao Xin,L iu Qing,et al.Hairpin D NApro be based electr ochem ical bio sensor using methyleneblue as hy br idizat ion indicator[J].Bio sensor s and Bioelect ronics,2007,22(6):1126 1130.[11]X u Ying,Yang L in,Y e Xiaoy an,et al.Impedancebased DN A bio sensor emplo ying molecular beaconDN A as probe and thionine as charg e neutralizer[J].Electr oanaly sis,2006,18(9),873 881.[12]Lev ine A J.p53,the cellular g atekeeper fo r g ro wthand div ision[J].Cell,1997,88(3):323 331.[13]Ag arw al M L,T ay lo r W R,Chernov M V,et a l.T hep53N etw or k[J].Jo ur nal of Bio lo gical Chemistr y,1998.273(2):1 4.[14]H ansen R,O ren M.p53:fro m induct ive sig nal to cellular effect[J].Cur rent O pinion in G enet ics and De v elo pment,1997,7(1):46 51.[15]Guimar aes D P,H ainaut P.T P53:a key gene in human cancer[J].Bio chimie,2002,84(1):83 93. [16]R achw al P A,Fo x K R.Quadruplex melting[J].M ethods,2007,43(4):291 301.[17]Zhang Shusheng,X ia Jianping,L i X uemei.Electr ochemical biosenso r fo r detection o f adeno sine based on st ruct ur e sw itching aptamer and amplificatio n wit h re por ter pro be DN A modified Au nano par ticles[J].Ana lyt ical Chemistry,2008,80(22):8382 8388.[18]K ong Deming,M a Yo ng e,Wu Jing,et al.Discr iminatio n o f G quadr uplexes f rom duplex and sing le stran ded D NA s w ith f luor escence and energ y transfer fluo r escence spectr a of cry sta l v io let[J].Chemistr y AEur opean Journal,2009,15(4):901 909.[19]W akelin L P G,A dams F A,H unter C,et a l.Interact ion of cry stal violet w ith nucleic acids[J].Bio chemis t ry,1981,20(20):5779 5787.责任编辑 王 勇(上接第44页)[15]Chaosuancharo en N,Ko ng kathip N,Ko ng kathip B.Anov el synthet ic appr oach from diosgenin to a17 hy dro xy ort ho ester v ia a reg ioand stereo specific rear r ang ement o f an epox y ester[J].Synthet ic Communica tions,2004,34(6):961 983.[16]Chen Z hang uo,W ei Junfa,W ang M ing zhen,et al.Aluminium pow der cataly zed r egio and stereo select ive am ino bromination of , unsatur at ed carbonyl co m pounds and simple olef ins wit h the p t oluenesulfon amide/N bro mosuccinimide(T sNH2 NBS)system[J].Advanced Synthesis&Cataly sis,2009,351,23582368.[17]Dhoo ghe M,Speybroeck V V,N ieuw enho ve A V,etal.N ovel synthesis o f3,4 diaminobut anenitr iles and4 amino 2 butenenitriles fro m2 (cyanomethyl)aziridines thro ug h intermediate aziridinium salts:an experimental and theor etical ppro ach[J].T he Journal of O rg anic Chemist ry,2007,72:4733 4740.[18]Gho rai M K,Kalpat aru D,D ipt i S.L ewis acid mediated hig hly r egioselectiv e SN2 t ype r ing o pening of2 ar yl N t osylazetidines and azir idines by alco ho ls[J].T he Journal o f Or ganic Chemist ry,2007,72:5859 5862.责任编辑 王 勇。