2019版一轮优化探究化学(苏教版)练习:章末排查练6 Word版含解析
- 格式:doc
- 大小:62.50 KB
- 文档页数:5

2019版高考一轮优化探究化学练习汇编目录2019版一轮优化探究化学(人教版)练习:大题规范练(01) Word版含解析2019版一轮优化探究化学(人教版)练习:大题规范练(02) Word版含解析2019版一轮优化探究化学(人教版)练习:大题规范练(03) Word版含解析2019版一轮优化探究化学(人教版)练习:大题规范练(04) Word版含解析课时作业1.(RJ必修1·P202题改编)安全是顺利进行实验的保障,下列实验处理或方法符合实验安全要求的是()A.尾气(主要含氯气)用澄清石灰水吸收B.氢气和氯气混合光照制氯化氢C.导管口点燃一氧化碳时要先验纯D.将鼻子贴近集气瓶口直接闻气体气味答案:C2.(2017·甘肃河西联考)下列有关试剂的保存方法正确的是()①NaOH固体保存在配有橡胶塞的细口瓶中②Na2CO3溶液通常保存在配有橡胶塞的细口瓶中③液溴通常用水封保存④锂保存在煤油中⑤浓硝酸通常保存在棕色细口瓶中A.①③⑤B.②③⑤C.②④⑤D.①③④答案:B3.下列说法或做法正确的是()A.试管可以做液体或溶液反应的实验,不能做固体反应的实验B.用蒸发皿小心蒸发碳酸氢钙溶液,最终得到碳酸氢钙晶体C.做氯气与钠反应的实验时,可用玻璃燃烧匙或在普通燃烧匙中铺一层细沙D.熔融氢氧化钠固体,可用陶瓷坩埚解析:试管可以做固体反应的实验,如加热KClO3和MnO2的混合物制取O2;Ca(HCO3)2在溶液中受热会分解生成CaCO3;熔融的NaOH与陶瓷中的SiO2发生反应,所以不可用陶瓷坩埚熔融NaOH 固体。
答案:C4.在做化学实验时必须注意安全操作,下列实验操作或事故处理正确的是()①在点燃易燃气体前,必须检验气体的纯度②浓硫酸对皮肤有腐蚀性,如不慎溅到皮肤上,用较多的水冲洗,再涂上稀硼酸溶液③给试管中的液体加热时,液体体积不超过试管容积的1/3④点燃添满酒精的酒精灯⑤用10 mL量筒量取8.55 mL蒸馏水A.仅①B.仅①②C.仅①③D.全部答案:C5.下列操作中错误之处最多的是()解析:A 项有一处错误,读数时应平视而不应仰视;B 项存在两处错误,一是不能将水加入浓硫酸中,二是不能在量筒中稀释浓硫酸;C 项有一处错误,不能把NaOH 直接放在纸上称量;D 项有一处错误,溶解固体时应用玻璃棒搅拌而不是摇动。

章末排查练(六)一、原电池电极反应式或总反应式的书写1.铁镍电池(负极-Fe,正极-NiO2,电解液-KOH溶液)放电Fe(OH)2+Ni(OH)2,则:已知:Fe+NiO2+2H2O充电负极:_______________________________________________;正极:_______________________________________________;阴极:_______________________________________________;阳极:________________________________________________。
答案:Fe-2e-+2OH-===Fe(OH)2NiO2+2H2O+2e-===Ni(OH)2+2OH-Fe(OH)2+2e-===Fe+2OH-Ni(OH)2-2e-+2OH-===NiO2+2H2O 2.LiFePO4电池(正极-LiFePO4,负极-Li,含Li+导电固体为电解质)放电LiFePO4,则已知:FePO4+Li充电负极:_______________________________________________;正极:_______________________________________________;阴极:_______________________________________________;阳极:________________________________________________。
答案:Li-e-===Li+FePO4+Li++e-===LiFePO4Li++e-===Li LiFePO4-e-===FePO4+Li+3.高铁电池(负极-Zn,正极-石墨,电解质为浸湿的固态碱性物质)放电3Zn(OH)2+2Fe(OH)3+4KOH,则:已知:3Zn+2K2FeO4+8H2O充电负极:_______________________________________________;正极:_______________________________________________;阴极:_______________________________________________;阳极:________________________________________________。

章末排查练(四)授课提示:对应学生用书第104页一、排查易错易混点正误判断,正确的打“√”,错误的打“×”。
(1)稀盐酸可除去烧瓶内残留的MnO 2。
( )(2)富集溴一般先用热空气和水蒸气吹出单质溴,再用SO 2将其还原吸收。
( )(3)燃料的脱硫脱氮、SO 2的回收利用和NO x 的催化转化都是减少酸雨产生的措施。
( )(4)利用NaOH 溶液和浓H 2SO 4通过洗气的方法可以除去CO 中的CO 2。
( )(5)实验室里用锌粒与稀HNO 3反应制取H 2。
( )(6)Cu 溶于稀HNO 3反应的离子方程式:Cu +2H ++NO -3===Cu 2++NO 2↑+H 2O 。
( ) (7)将可调高度的铜丝伸入稀HNO 3中,溶液变蓝,说明铜与稀HNO 3发生置换反应。
( )(8)液氨用做制冷剂不涉及化学变化。
( )(9)除去Cl 2中少量HCl 气体的方法是将混合气体依次通入盛有饱和食盐水和浓H 2SO 4的洗气瓶。
( )(10)MnO 2与浓盐酸反应制Cl 2的离子方程式:MnO 2+4HCl(浓)=====△Mn 2++2Cl -+Cl 2↑+2H 2O 。
( )(11)制取二氧化氮时,用水或NaOH 溶液吸收尾气。
( )(12)标准状况下,6.72 L NO 2与水充分反应转移的电子数目为0.1N A 。
( )(13)硬度:晶体硅<金刚石。
( )(14)浓氨水可检验氯气管道漏气。
( )(15)P 2O 5可用于干燥Cl 2和NH 3。
( )答案:(1)× (2)√ (3)√ (4)√ (5)× (6)×(7)× (8)√ (9)√ (10)× (11)× (12)×(13)√ (14)√ (15)×二、排查41个主要化学方程式1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。

章末排查练(五)一、常考易错选择题选项再排查正误判断,正确的打“√”,错误的打“×”。
(1)18 g D 2O 和18 g H 2O 中含有的质子数均为10N A 。
( )(2)235 g 核素235 92U 发生裂解反应:235 92U +10n ――→裂变9038Sr +136 54Xe +1010n,净产生的中子(10n)数为10N A 。
( )(3)I 的原子半径大于Br,HI 比HBr 的热稳定性强。
( )(4)P 的非金属性强于Si,H 3PO 4比H 2SiO 3的酸性强。
( )(5)SiO 2晶体熔化、液态SO 3汽化均需克服分子间作用力。
( )(6)Mg 、MgO 中镁元素的微粒半径:r (Mg 2+)>r (Mg)。
( )(7)常温高压下,18 g H 2O 中含有的原子总数为3N A 。
( )(8)AlN(原子晶体)和石英的化学键类型相同。
( )(9)离子化合物中一定含有离子键。
( )(10)单质分子中均不存在化学键。
( )(11)含有共价键的化合物一定是共价化合物。
( )(12)NaHCO 3、HCOONa 均含有离子键和共价键。
( )(13)结构和组成相似的物质,沸点随相对分子质量增大而升高,因而NH 3沸点低于PH 3。
( )(14)第ⅠA 族金属元素是同周期中金属性最强的元素。
( )(15)同种元素的原子均有相同的质子数和中子数。
( )(16)分子间作用力的大小决定分子稳定性的高低。
( )(17)原子核外电子排布决定元素在周期表中的位置。
( )(18)Ca(OH)2的碱性比Mg(OH)2的碱性强。
( )(19)常压下,0 ℃时冰的密度比水的密度小,水在4 ℃时密度最大,这些都与分子间的氢键有关。
( )(20)12C18O和14N2同温同压下原子数相等时具有的中子数相等。
()(21)12C18O和14N2同温同压下,质量相等时具有的质子数相等。
()(22)CO2分子中的化学键为非极性键。
![[推荐学习]2019版一轮优化探究化学(鲁科版)练习:章末排查练(七) Word版含解析-](https://img.taocdn.com/s1/m/ab904f1e31126edb6f1a10c1.png)
章末排查练(七)判断正误,正确的打“√”,错误的打“×”。
一、化学反应速率1.活化分子的碰撞都是有效碰撞。
()2.温度越高,活化分子百分数越大、浓度越大。
()3.压强越大,活化分子百分数越大。
()4.决定化学反应速率的内在因素是反应物本身的性质。
()5.固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变。
()6.可逆反应达到平衡,反应就不再进行。
()7.增大反应物浓度,化学反应速率一定加快。
()8.在恒温条件下,增大压强,化学反应速率一定加快。
()9.在一定条件下,增加反应物的量,化学反应速率一定加快。
()10.其他条件不变,温度越高,反应速率越快。
()11.正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动。
()12.加入催化剂加快了反应速率,改变了反应吸收或放出的热量。
() 13.一定条件下,某一反应的活化分子在反应物分子中所占百分数是一定的。
() 14.同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同。
()15.5 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的反应速率大。
() 16.一个放热反应,放出热量的多少与反应速率成正比。
()17.正反应速率越大,反应物的转化率越大。
()18.对于某可逆反应,反应进行的净速率是正、逆反应速率之差。
()答案:1.× 2.√ 3.× 4.√ 5.√ 6.×7.×8.×9.×10.√11.×12.×13.√14.×15.×16.×17.×18.√二、化学平衡1.正反应速率增大,平衡向正反应方向移动。
()2.在恒容条件下,有两个平衡体系:A(g)2B(g);2A(g)B(g),都增加A的量,A、B转化率都变小。
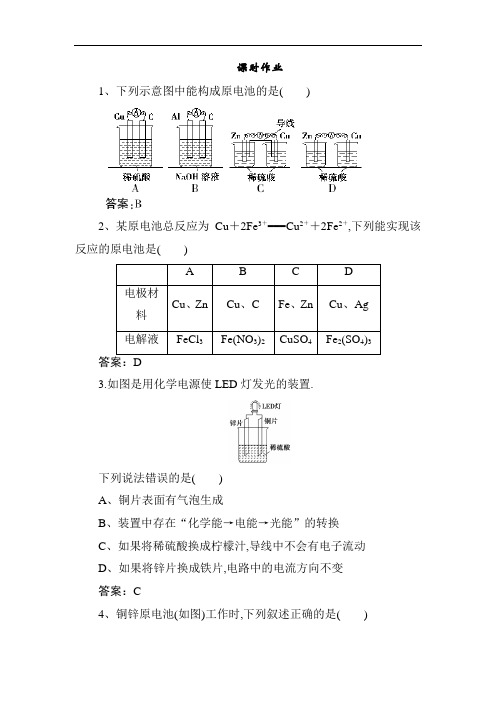
课时作业1、下列示意图中能构成原电池的是()2、某原电池总反应为Cu+2Fe3+===Cu2++2Fe2+,下列能实现该反应的原电池是()3.如图是用化学电源使LED灯发光的装置.下列说法错误的是()A、铜片表面有气泡生成B、装置中存在“化学能→电能→光能”的转换C、如果将稀硫酸换成柠檬汁,导线中不会有电子流动D、如果将锌片换成铁片,电路中的电流方向不变答案:C4、铜锌原电池(如图)工作时,下列叙述正确的是()A、正极反应为Zn-2e-===Zn2+B、电池反应为Zn+Cu2+===Zn2++CuC、在外电路中,电子从Cu极流向Zn极D、盐桥中的K+移向ZnSO4溶液答案:B5、用a、b、c、d四种金属按表中所示的装置进行实验,下列叙述正确的是()B、装置乙中的c金属是原电池的阴极C、装置丙中的d金属是原电池的正极D、四种金属的活动性顺序:d>a>b>c解析:甲中a不断溶解说明a是负极,活动性:a>b,A错误;原电池用正极或负极命名电极,B错误,由乙中现象知活动性:b>c;丙中d 是负极,活动性:d>a,C错误;综上可知D正确.答案:D6、(2017·宁夏中卫质检)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)()A、杠杆为导体或绝缘体时,均为A端高B端低B、杠杆为导体或绝缘体时,均为A端低B端高C、当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B 端低D、当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B 端高解析:杠杆为导体时,向水槽中滴入浓CuSO4溶液,构成原电池,Fe 为负极,发生反应:Fe-2e-===Fe2+,Cu为正极,发生反应:Cu2++2e -===Cu,则A端低B端高;杠杆为绝缘体时,发生Fe与硫酸铜溶液的反应,在Fe的表面附着Cu,铁球质量变大,则A端高B端低,C项正确.答案:C7、研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是()A、放电时金属锂做负极B、放电时OH-向正极移动C、水既是氧化剂又是溶剂D、总反应为2Li+2H2O===2LiOH+H2↑解析:原电池中活泼金属做负极,锂比铁活泼,故锂做负极,A正确;原电池中,放电时阴离子向负极移动,B错误;金属锂和水反应生成氢氧化锂和氢气,该反应中,水是氧化剂,水在电池中还是溶剂,C正确;锂水电池中,金属锂和水反应生成氢氧化锂和氢气,总反应为2Li+2H2O===2LiOH+H2↑,故D正确.答案:B8. (2017·北京朝阳统考)纸电池是一种有广泛应用的“软电池”,图中这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是()A、Zn为负极,发生氧化反应B、电池工作时,电子由MnO2流向ZnC、正极反应:MnO2+e-+H2O===MnOOH+OH-D、电池总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnOOH答案:B9、(2017·合肥质检)某种甲烷燃料电池采用铂做电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为CH4+2O2===CO2+2H2O.下列有关说法正确的是()A、电子由a极流出经过负载流向b极B、电解质溶液中H+移向a极C、每转移1 mol e-,消耗1.6 g CH4D、b极上的电极反应式为O2+2H2O+4e-===4OH-答案:A10、(2017·长沙模拟)2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl-4、Al2Cl-7和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法正确的是()A、放电时,电子由石墨电极经用电器流向铝电极B、充电时,铝电极上发生氧化反应C、充电时,AlCl-4向铝电极方向移动D、放电时,负极的电极反应为Al-3e-+7AlCl-4===4Al2Cl-7解析:Al-3e-―→Al2Cl-7,利用AlCl-4平衡电荷,得电极反应式为Al-3e-+7AlCl-4===4Al2Cl-7,铝做负极,石墨做正极,电子由负极流向正极,A项错误、D项正确;B项,充电时,铝为阴极,发生还原反应,错误;C项,放电时,AlCl-4向铝电极移动,则充电时向石墨电极移动,错误.答案:D11、(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________(填字母,下同).a、C(s)+H2O(g)===CO(g)+H2(g)ΔH>0b、2H2(g)+O2(g)===2H2O(l)ΔH<0c、NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH<0若以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应为________________________________________________.(2)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是________.(填字母序号)a、实验过程中,左侧烧杯中NO-3浓度不变b、实验过程中取出盐桥,原电池能继续工作c、若开始时用U形铜代替盐桥,装置中无电流产生d、若开始时用U形铜代替盐桥,U形铜的质量不变解析:(1)根据题中信息,设计成原电池的反应通常是放热反应,排除a,根据已学知识,原电池反应必是自发进行的氧化还原反应,排除c.原电池正极发生还原反应,由于是碱性介质,则电极反应中不应出现H+,故正极的电极反应为O2+4e-+2H2O===4OH-.(2)该原电池的工作原理是Cu+2Ag+===2Ag+Cu2+,盐桥起形成闭合回路和平衡电荷的作用,因此当电池工作时,盐桥中的NO-3向负极移动,因此左侧烧杯中NO-3的浓度将增大,a错误.当取出盐桥,不能形成闭合回路,电池处于断路状态,不能继续工作,b错误.若开始时用U形铜代替盐桥,则左侧烧杯相当于电解装置,而右侧烧杯相当于原电池装置,电极反应从左往右依次为阳极:4OH--4e-===2H2O+O2↑,阴极:Cu2++2e-===Cu,负极:Cu-2e-===Cu2+,正极:Ag++e-===Ag,由此可知c错误、d正确.答案:(1)b O2+2H2O+4e-===4OH-(2)d12、某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性.该原理的离子方程式为___________________________________________________ ________________________________________________.方案Ⅱ:有人利用Fe、Cu做电极设计成原电池,以确定它们的活动性.试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式.正极反应式:________________________________________________.负极反应式:________________________________________________.方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案:___________________________________________________ ___________________________________________________(与方案Ⅰ、Ⅱ不能雷同),用离子方程式表示其反应原理:___________________________________________________ ________________________________________________.答案:方案Ⅰ:Fe+2H+===Fe2++H2↑方案Ⅱ:装置如图所示2H++2e-===H2↑Fe-2e-===Fe2+方案Ⅲ:将铁片置于CuSO4溶液,若铁片表面覆盖一层铜,说明Fe 比Cu活动性强Fe+Cu2+===Fe2++Cu13.氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:(1)氢氧燃料电池的能量转化的主要形式是________,在导线中电子流动方向为________(用a、b表示).(2)负极反应式为________________________________________________.(3)电极表面镀铂粉的原因是________________________________________________.(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H22LiHⅡ.LiH+H2O===LiOH+H2↑①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________.②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH的体积与被吸收的H2的体积比为________.③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol.答案:(1)由化学能转变为电能由a到b(2)2H2+4OH--4e-===4H2O(或H2+2OH--2e-===2H2O)(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率(4)①Li H2O②1∶1 148或8.71×10-4③32。
章末排查练(七)判断正误,正确的打“√”,错误的打“×”.一、化学反应速率1、活化分子的碰撞都是有效碰撞.()2、温度越高,活化分子百分数越大、浓度越大.()3、压强越大,活化分子百分数越大.()4、决定化学反应速率的内在因素是反应物本身的性质.()5、固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变.()6、可逆反应达到平衡,反应就不再进行.()7、增大反应物浓度,化学反应速率一定加快.()8、在恒温条件下,增大压强,化学反应速率一定加快.()9、在一定条件下,增加反应物的量,化学反应速率一定加快.()10、其他条件不变,温度越高,反应速率越快.()11、正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动.()12、加入催化剂加快了反应速率,改变了反应吸收或放出的热量.()13、一定条件下,某一反应的活化分子在反应物分子中所占百分数是一定的.()14、同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同.()15、5 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的反应速率大.()16、一个放热反应,放出热量的多少与反应速率成正比.()17、正反应速率越大,反应物的转化率越大.()18、对于某可逆反应,反应进行的净速率是正、逆反应速率之差.()答案:1.× 2.√ 3.× 4.√ 5.√ 6.×7.×8.×9、×10.√11.×12.×13.√14.×15.×16、×17.×18.√二、化学平衡1、正反应速率增大,平衡向正反应方向移动.()2、在恒容条件下,有两个平衡体系:A(g)2B(g);2A(g)B(g),都增加A的量,A、B转化率都变小.()3、在一定条件下,平衡向正反应方向移动,正反应速率变大.()4、由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大.()5、平衡向正反应方向移动,反应物的转化率都增大.()(g)+3H2(g)2NH3(g)ΔH<0,平衡后,改变条件,6、对于:N判断下列说法是否正确.(1)保持体积不变,充入N2,平衡向正反应方向移动,其转化率增大.()(2)保持体积不变,充入NH3,则NH3的体积分数减小.()(3)保持温度不变,压缩体积,平衡向正反应方向移动,N2、H2的转化率均增大,其体积分数均减小,NH3的体积分数增大,N2、H2的浓度增大,NH3的浓度减小.()O(g)CO(g)+H2(g)反应,在一定条件下达7、对于C(s)+H到平衡,增加或减少C(s)的量,平衡不移动.()(g)+O2(g)2SO3(g)反应,当密度保持不变,在恒8、对于2SO温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志.( )9、对于C(s)+CO2(g) 2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志.( )10、对于2SO2(g)+O 2(g) 2SO 3(g)和I 2(g)+H 2(g) 2HI(g)反应,在恒温恒容条件下,当压强保持不变时,均能说明上述反应达到化学平衡状态.( )11、对于I2(g)+H 2(g) 2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI 的百分含量保持不变.( )12、对于C(s)+H2O(g)CO(g)+H 2(g)反应,其平衡常数K =c (CO )·c (H 2)c (C )·c (H 2O ).( ) 13、H2(g)+I 2(g) 2HI(g)平衡常数为K 1,HI(g) 12H 2(g)+12I 2(g)平衡常数为K 2,则K 1·K 2=1.( ) 14、化学平衡常数越大,说明正反应进行的程度越大,即该反应进行的越完全,反应物的转化率越大;化学平衡常数越小,说明正反应进行的程度越小,即该反应进行的就越不完全,反应物的转化率就越小.( )15、化学平衡常数只受温度影响,与反应物或生成物的浓度变化无关;温度越高,化学平衡常数越大.( )16、K =c (CO 2)·c (H 2)c (CO )·c (H 2O ),温度升高,K 增大,则CO 2(g)+H 2(g) CO(g)+H2O(g) ΔH >0.( )答案:1.× 2.× 3.× 4.√ 5.× 6.(1)× (2)× (3)×7.√ 8.× 9.√ 10.× 11.√ 12.× 13.×14、√15.×16.×。
章末排查练(三)排查50个重要反应的化学、离子方程式1.钠及其重要化合物①Na和H2O的反应.②Na和CH3COOH的反应.③Na2O2和H2O的反应.④NaH和水的反应.⑤向NaOH溶液中通入过量CO2.⑥将Na2CO3溶液与石灰乳混合.⑦向Na2CO3溶液中通入过量CO2.⑧将Na2CO3和Ca(HCO3)2混合.⑨将含等物质的量NaHCO3溶液和NaOH溶液混合.⑩将含等物质的量NaHCO3溶液与澄清石灰水混合.⑪将NaHCO3溶液与少量澄清石灰水混合.⑫向饱和Na2CO3溶液中通入过量CO2气体.答案:①2Na+2H2O===2Na++2OH-+H2↑②2Na+2CH3COOH===2CH3COO-+2Na++H2↑③2Na2O2+2H2O===4Na++4OH-+O2↑④NaH+H2O===Na++OH-+H2↑⑤OH-+CO2===HCO-3⑥CO2-3+Ca(OH)2===CaCO3↓+2OH-⑦CO2-3+CO2+H2O===2HCO-3⑧CO2-3+Ca2+===CaCO3↓⑨HCO-3+OH-===CO2-3+H2O⑩HCO-3+Ca2++OH-===CaCO3↓+H2O⑪2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物⑬Al和NaOH溶液的反应.⑭Al(OH)3和NaOH溶液的反应.⑮Al(OH)3和盐酸的反应.⑯Al2O3和NaOH的反应.⑰Al2O3和盐酸的反应.⑱NaAlO2和过量盐酸的反应.⑲向NaAlO2溶液中通入过量CO2气体.⑳将NaAlO2与NaHCO3混合.21将NaAlO2与AlCl3溶液混合.○22向AlCl3溶液中加入过量NaOH溶液.○23向AlCl3溶液中加入过量氨水.○24将AlCl3溶液与NaHCO3溶液混合.○答案:⑬2Al+2OH-+2H2O===2AlO-2+3H2↑⑭Al(OH)3+OH-===AlO-2+2H2O⑮Al(OH)3+3H+===Al3++3H2O⑯Al2O3+2OH-===2AlO-2+H2O⑰Al2O3+6H+===2Al3++3H2O⑱AlO-2+4H+===Al3++2H2O⑲AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3⑳AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3213AlO-2+Al3++6H2O===4Al(OH)3↓○22Al3++4OH-===AlO-2+2H2O ○23Al3++3NH3·H2O===Al(OH)3↓+3NH+4○24Al3++3HCO-3===Al(OH)3↓+○3CO2↑3.铁及其重要化合物25Fe和过量稀HNO3的反应.○26Fe高温下和水蒸气的反应.○27Fe2O3和Al的反应.○28Fe2O3高温下和CO的反应.○29FeCl3溶液和Cu的反应.○30FeCl3与KSCN的反应.○31向FeCl2溶液中加入等物质的量的Na2O2.○32向FeCl2溶液中加入NaClO .○33Fe(OH)2长时间置于空气中.○34Fe3O4和稀盐酸的反应.○○35Fe 3O 4和稀HNO 3的反应 . ○36FeO 和稀盐酸的反应 . ○37FeO 和稀HNO 3的反应 . ○38Fe(OH)2和稀盐酸的反应 . ○39Fe(OH)2和稀HNO 3的反应 . ○40Fe(OH)3和HI 的反应 . ○41FeBr 2和少量Cl 2的反应 . ○42FeBr 2和Cl 2等物质的量的反应 . ○43FeBr 2和过量Cl 2的反应 . 答案:○25Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O ○263Fe +4H 2O(g)=====高温Fe 3O 4+4H 2 ○27Fe 2O 3+2Al=====高温2Fe +Al 2O 3 ○28Fe 2O 3+3CO=====高温2Fe +3CO 2 ○292Fe 3++Cu===2Fe 2++Cu 2+ ○30Fe 3++3SCN -Fe(SCN)3 ○314Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3↓+8Na ++O 2↑ ○322Fe 2++ClO -+4OH -+H 2O===2Fe(OH)3↓+Cl - ○334Fe(OH)2+O 2+2H 2O===4Fe(OH)3 ○34Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O ○353Fe 3O 4+28H ++NO -3===9Fe3++NO ↑+14H 2O ○36FeO +2H +===Fe 2++H 2O ○373FeO +10H ++NO -3===3Fe 3++NO ↑+5H 2O○38Fe(OH)2+2H +===Fe 2++2H 2O ○393Fe(OH)2+10H ++NO -3===3Fe3++NO ↑+8H 2O ○402Fe(OH)3+6H ++2I -===2Fe 2++I 2+6H 2O ○412Fe 2++Cl 2===2Fe 3++2Cl - ○422Fe 2++2Br -+2Cl 2===2Fe 3++Br 2+4Cl - ○432Fe 2++4Br -+3Cl 2===2Fe 3++2Br 2+6Cl -4.铜及其重要化合物○44Cu 在硫蒸气中燃烧 . ○45铜在空气中生成铜绿 . ○46用惰性电极电解CuSO 4溶液 . ○47Cu 和浓HNO 3的反应 . ○48Cu 和稀HNO 3的反应 . ○49Cu 和浓H 2SO 4的反应 . ○50胆矾受热分解 .答案:○442Cu +S=====△Cu 2S ○452Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3 ○462Cu 2++2H 2O=====通电2Cu +4H ++O 2↑ ○47Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ○483Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ○49Cu +2H 2SO 4(浓)=====△Cu 2++SO 2-4+SO 2↑+2H 2O ○50CuSO 4·5H 2O=====△CuSO 4+5H 2O。
章末排查练(四)授课提示:对应学生用书第104页一、排查易错易混点正误判断,正确的打“√”,错误的打“×”。
(1)稀盐酸可除去烧瓶内残留的MnO 2。
( )(2)富集溴一般先用热空气和水蒸气吹出单质溴,再用SO 2将其还原吸收。
( )(3)燃料的脱硫脱氮、SO 2的回收利用和NO x 的催化转化都是减少酸雨产生的措施。
( )(4)利用NaOH 溶液和浓H 2SO 4通过洗气的方法可以除去CO 中的CO 2。
( )(5)实验室里用锌粒与稀HNO 3反应制取H 2。
( )(6)Cu 溶于稀HNO 3反应的离子方程式:Cu +2H ++NO -3===Cu 2++NO 2↑+H 2O 。
( ) (7)将可调高度的铜丝伸入稀HNO 3中,溶液变蓝,说明铜与稀HNO 3发生置换反应。
( )(8)液氨用做制冷剂不涉及化学变化。
( )(9)除去Cl 2中少量HCl 气体的方法是将混合气体依次通入盛有饱和食盐水和浓H 2SO 4的洗气瓶。
( )(10)MnO 2与浓盐酸反应制Cl 2的离子方程式:MnO 2+4HCl(浓)=====△Mn 2++2Cl -+Cl 2↑+2H 2O 。
( )(11)制取二氧化氮时,用水或NaOH 溶液吸收尾气。
( )(12)标准状况下,6.72 L NO 2与水充分反应转移的电子数目为0.1N A 。
( )(13)硬度:晶体硅<金刚石。
( )(14)浓氨水可检验氯气管道漏气。
( )(15)P 2O 5可用于干燥Cl 2和NH 3。
( )答案:(1)× (2)√ (3)√ (4)√ (5)× (6)×(7)× (8)√ (9)√ (10)× (11)× (12)×(13)√ (14)√ (15)×二、排查41个主要化学方程式1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。
章末排查练(三)排查50个重要反应的化学、离子方程式1.钠及其重要化合物. O 的反应2Na 和H ①.COOH 的反应3Na 和CH ② .O 的反应2和H 2O 2Na ③ .NaH 和水的反应④ . 2向NaOH 溶液中通入过量CO ⑤. 溶液与石灰乳混合3CO 2将Na ⑥. 2溶液中通入过量CO 3CO 2向Na ⑦. 混合2)3和Ca(HCO 3CO 2将Na ⑧. 溶液和NaOH 溶液混合3将含等物质的量NaHCO ⑨. 溶液与澄清石灰水混合3将含等物质的量NaHCO ⑩.澄清石灰水混合溶液与少量3将NaHCO ⑪ .气体2溶液中通入过量CO 3CO 2向饱和Na ⑫ 答案:①2Na +2H 2O===2Na ++2OH -+H 2↑②2Na +2CH 3COOH===2CH 3COO -+2Na ++H 2↑③2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑④NaH +H 2O===Na ++OH -+H 2↑⑤OH -+CO 2===HCO -3⑥CO 2-3+Ca(OH)2===CaCO 3↓+2OH -⑦CO 2-3+CO 2+H 2O===2HCO -3⑧CO 2-3+Ca 2+===CaCO 3↓⑨HCO -3+OH -===CO 2-3+H 2O⑩HCO -3+Ca 2++OH -===CaCO 3↓+H 2O⑪2HCO -3+Ca 2++2OH -===CaCO 3↓+CO 2-3+2H 2O⑫2Na ++CO 2-3+CO 2+H 2O===2NaHCO 3↓2.铝及其重要化合物. Al 和NaOH 溶液的反应⑬.和NaOH 溶液的反应3Al(OH)⑭ . 和盐酸的反应3Al(OH)⑮. 和NaOH 的反应3O 2Al ⑯. 和盐酸的反应3O 2Al ⑰.和过量盐酸的反应2NaAlO ⑱ .气体2溶液中通入过量CO 2向NaAlO ⑲ . 混合3与NaHCO 2将NaAlO ⑳.溶液混合3与AlCl 2将NaAlO ○21 .溶液中加入过量NaOH 溶液3向AlCl ○22 . 溶液中加入过量氨水3向AlCl ○23.溶液混合3溶液与NaHCO 3将AlCl ○24 答案:⑬2Al +2OH -+2H 2O===2AlO -2+3H 2↑⑭Al(OH)3+OH -===AlO -2+2H 2O ⑮Al(OH)3+3H +===Al 3++3H 2O ⑯Al 2O 3+2OH -===2AlO -2+H 2O ⑰Al 2O 3+6H +===2Al 3++3H 2O ⑱AlO -2+4H +===Al 3++2H 2O⑲AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3⑳AlO -2+HCO -3+H 2O===Al(OH)3↓+CO 2-3 ○213AlO -2+Al 3++6H 2O===4Al(OH)3↓○22Al 3++4OH -===AlO -2+2H 2O ○23Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4○24Al 3++3HCO -3===Al(OH)3↓+3CO 2↑3.铁及其重要化合物. 的反应3Fe 和过量稀HNO ○25.高温下和水蒸气的反应Fe ○26 .和Al 的反应3O 2Fe ○27.高温下和CO 的反应3O 2Fe ○28 . 溶液和Cu 的反应3FeCl ○29.与KSCN 的反应3FeCl ○30 .2O 2溶液中加入等物质的量的Na 2向FeCl ○31 . 溶液中加入NaClO 2向FeCl ○32.长时间置于空气中2Fe(OH)○33 . 和稀盐酸的反应4O 3Fe ○34. 的反应3NO 和稀H 4O 3Fe ○35. FeO 和稀盐酸的反应○36. 的反应3FeO 和稀HNO ○37. 和稀盐酸的反应2Fe(OH)○38.的反应3和稀HNO 2Fe(OH)○39 . 和HI 的反应3Fe(OH)○40.的反应2和少量Cl 2FeBr ○41 .等物质的量的反应2和Cl 2FeBr ○42 .的反应2和过量Cl 2FeBr ○43 答案:○25Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O ○263Fe +4H 2O(g)=====高温Fe 3O 4+4H 2○27Fe 2O 3+2Al =====高温2Fe +Al 2O 3○28Fe 2O 3+3CO =====高温2Fe +3CO 2○292Fe 3++Cu===2Fe 2++Cu 2+○30Fe 3++3SCN -Fe(SCN)3○314Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3↓+8Na ++O 2↑○322Fe 2++ClO -+4OH -+H 2O===2Fe(OH)3↓+Cl -○334Fe(OH)2+O 2+2H 2O===4Fe(OH)3○34Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O ○353Fe 3O 4+28H ++NO-3===9Fe 3++NO ↑+14H 2O ○36FeO +2H +===Fe 2++H 2O ○373FeO +10H ++NO -3===3Fe 3++NO ↑+5H 2O○38Fe(OH)2+2H +===Fe 2++2H 2O ○393Fe(OH)2+10H ++NO -3===3Fe 3++NO ↑+8H 2O ○402Fe(OH)3+6H ++2I -===2Fe 2++I 2+6H 2O○412Fe 2++Cl 2===2Fe 3++2Cl -○422Fe 2++2Br -+2Cl 2===2Fe 3++Br 2+4Cl -○432Fe 2++4Br -+3Cl 2===2Fe 3++2Br 2+6Cl -4.铜及其重要化合物. Cu 在硫蒸气中燃烧○44. 铜在空气中生成铜绿○45.溶液4用惰性电极电解CuSO ○46 . 的反应3Cu 和浓HNO ○47. 的反应3u 和稀HNO C ○48.的反应4SO 2Cu 和浓H ○49 .胆矾受热分解○50 答案:○442Cu +S =====△Cu 2S ○452Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3○462Cu 2++2H 2O =====通电2Cu +4H ++O 2↑○47Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ○483Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O○49Cu +2H 2SO 4(浓)=====△Cu 2++SO 2-4+SO 2↑+2H 2O ○50CuSO 4·5H 2O =====△CuSO 4+5H 2O。
章末排查练(六)一、原电池电极反应式或总反应式的书写1.铁镍电池(负极-Fe,正极-NiO2,电解液-KOH溶液)放电Fe(OH)2+Ni(OH)2,则:已知:Fe+NiO2+2H2O充电负极:_______________________________________________;正极:_______________________________________________;阴极:_______________________________________________;阳极:________________________________________________。
答案:Fe-2e-+2OH-===Fe(OH)2NiO2+2H2O+2e-===Ni(OH)2+2OH-Fe(OH)2+2e-===Fe+2OH-Ni(OH)2-2e-+2OH-===NiO2+2H2O 2.LiFePO4电池(正极-LiFePO4,负极-Li,含Li+导电固体为电解质)放电LiFePO4,则已知:FePO4+Li充电负极:_______________________________________________;正极:_______________________________________________;阴极:_______________________________________________;阳极:________________________________________________。
答案:Li-e-===Li+FePO4+Li++e-===LiFePO4Li++e-===Li LiFePO4-e-===FePO4+Li+3.高铁电池(负极-Zn,正极-石墨,电解质为浸湿的固态碱性物质)放电3Zn(OH)2+2Fe(OH)3+4KOH,则:已知:3Zn+2K2FeO4+8H2O充电负极:_______________________________________________;正极:_______________________________________________;阴极:_______________________________________________;阳极:________________________________________________。
答案:3Zn-6e-+6OH-===3Zn(OH)22FeO2-4+6e-+8H2O===2Fe(OH)3+10OH-3Zn(OH)2+6e-===3Zn+6OH-2Fe(OH)3-6e-+10OH-===2FeO2-4+8H2O4.氢氧燃料电池(1)电解质是KOH溶液(碱性电解质)负极:_______________________________________________;正极:_______________________________________________;总反应方程式:________________________________________________。
(2)电解质是H2SO4溶液(酸性电解质)负极:_______________________________________________;正极:_______________________________________________;总反应方程式:________________________________________________。
(3)电解质是NaCl溶液(中性电解质)负极:_______________________________________________;正极:_______________________________________________;总反应方程式:________________________________________________。
答案:(1)2H2-4e-+4OH-===4H2O O2+2H2O+4e-===4OH-2H2+O2===2H2O(2)2H2-4e-===4H+O2+4H++4e-===2H2O2H2+O2===2H2O (3)2H2-4e-===4H+O2+2H2O+4e-===4OH-2H2+O2===2H2O5.甲烷燃料电池(铂为两极,正极通入O2和CO2,负极通入甲烷,电解液有三种)(1)电解质是熔融碳酸盐(K2CO3或Na2CO3)正极:_______________________________________________;负极:_______________________________________________;总反应方程式:________________________________________________。
(2)酸性电解质(电解液为H2SO4溶液)正极:_______________________________________________;负极:_______________________________________________;总反应方程式:________________________________________________。
(3)碱性电解质(电解液为KOH溶液)正极:_______________________________________________;负极:_______________________________________________;总反应方程式:________________________________________________。
答案:(1)2O2+8e-+4CO2===4CO2-3CH4-8e-+4CO2-3===5CO2+2H2O CH4+2O2===CO2+2H2O(2)2O2+8e-+8H+===4H2O CH4-8e-+2H2O===CO2+8H+CH4+2O2===CO2+2H2O(3)2O2+8e-+4H2O===8OH-CH4-8e-+10OH-===CO2-3+7H2O CH4+2O2+2OH-===CO2-3+3H2O 6.甲醇燃料电池(1)碱性电解质(铂为两极,电解液为KOH溶液)正极:_______________________________________________;负极:_______________________________________________;总反应方程式:________________________________________________。
(2)酸性电解质(铂为两极,电解液为H2SO4溶液)正极:_______________________________________________;负极:_______________________________________________;总反应方程式:________________________________________________。
答案:(1)3O2+12e-+6H2O===12OH-2CH3OH-12e-+16OH-===2CO2-3+12H2O2CH3OH+3O2+4KOH===2K2CO3+6H2O(2)3O2+12e-+12H+===6H2O2CH3OH-12e-+2H2O===12H++2CO22CH3OH+3O2===2CO2+4H2O7.CO燃料电池(总反应方程式均为2CO+O2===2CO2)(1)熔融盐(铂为两极,Li2CO3和Na2CO3的熔融盐做电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气)正极:_______________________________________________;负极:________________________________________________。
(2)酸性电解质(铂为两极,电解液为H2SO4溶液)正极:_______________________________________________;负极:________________________________________________。
答案:(1)O2+4e-+2CO2===2CO2-32CO+2CO2-3-4e-===4CO2(2)O2+4e-+4H+===2H2O2CO-4e-+2H2O===2CO2+4H+二、电解池电极反应式和总反应式的书写1.用惰性电极电解下列溶液(1)NaCl 溶液阴极:_______________________________________________; 阳极:_______________________________________________;总反应式:________________________________________________。
(2)CuSO 4溶液阴极:_______________________________________________; 阳极:_______________________________________________;总反应式:________________________________________________。
答案:(1)2H ++2e -===H 2↑ 2Cl --2e -===Cl 2↑ 2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑ (2)2Cu 2++4e -===2Cu 4OH --4e -===2H 2O +O 2↑2CuSO 4+2H 2O=====电解2Cu +2H 2SO 4+O 2↑2.用惰性电极电解下列熔融态物质(1)MgCl 2阳极:_______________________________________________; 阴极:_______________________________________________;总反应式:________________________________________________。
(2)Al 2O 3阳极:_______________________________________________; 阴极:_______________________________________________;总反应式:________________________________________________。