沉淀滴定法和重量分析法
- 格式:ppt
- 大小:1.01 MB
- 文档页数:59



第七章沉淀滴定法和重量分析法教学目的、要求:掌握沉淀滴定法。
熟悉重量分析法的原理。
了解重量分析法的特点及注意事项。
教学重点及难点:沉淀滴定法及重量分析法的原理。
§8-1 沉淀滴定法概述: 沉淀滴定法是以沉淀反应为基础的滴定分析法。
沉淀反应虽然很多,但并不是所有沉淀反应都能应用于滴定分析。
应用于沉淀滴定的沉淀反应必须符合以下条件:(1) 沉淀反应必须定量进行,沉淀的溶解度必须很小。
(2) 沉淀反应必须迅速。
(3) 必须有适宜的指示剂来确定滴定终点。
由于受上述条件所限,目前应用较广的是生成难溶性银盐的反应,如:Ag++ C1-=AgCl↓以这种反应为基础的沉淀滴定法称为银量法。
本法可用来测定含C1—、Br—、I—、SCN—及Ag+等离子化合物的含量。
银量法按所用的指示剂不同,又分为铬酸钾指示剂法、铁铵矾指示剂法、吸附指示剂法。
一、银量法的基本原理1.滴定曲线:沉淀滴定法在滴定过程中的溶液离子浓度的变化情况也可以用滴定曲线表示,以pAg(或pX)为纵坐标,以滴定体积或滴定百分数为横坐标。
在化学计量点附近和其他滴定一样也产生滴定突跃,其突跃范围大小与沉淀的溶度积和溶液的浓度有关。
2.分步滴定:当溶液同时含有Cl-、Br-、I-时,由于他们与Ag+形成的沉淀溶度积差别较大,可利用分步沉淀的原理,用AgNO3连续滴定,形成三个突跃,分别测定他们的含量。
二、确定终点的方法(一)铬酸钾指示剂法(Mohr法)1.原理用AgN03标准溶液滴定氯化物或溴化物时,以铬酸钾为指示剂,滴定反应为:终点前:Ag++ Cl-=AgCl↓ (白色)终点时:2Ag+十CrO42-=Ag2CrO4↓(砖红色)根据分步沉淀的原理,Cl-先沉淀。
2.滴定条件(1).指示剂的用量要适当。
若指示剂浓度过大,会使终点提前;过小,终点迟钝。
一般在50 ~ 100 ml滴定液中加入5%K2CrO4指示剂1ml即可。
(2).在中性或微碱性溶液中进行。


第七章重量分析法和沉淀滴定法§ 7– 1 沉淀滴定法沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。
能用于沉淀滴定法的沉淀反应必须符合:(1) 生成沉淀的溶解度必须很小。
(2) 沉淀反应必须迅速、定量地进行。
(3) 有合适的确定终点的方法目前应用较广的是生成难溶银盐的反应,如:Ag+ + Cl- =AgClAg+ + SCN-=AgSCN这种滴定方法称为“银量法”,可用于测定Cl-、Br-、I-、SCN-等离子。
根据确定滴定终点的方法不同, 银量法可分为以下几种: 一、摩尔法⒈原理:以测定Cl-为例,在中性溶液中,加入K2CrO4指示剂,用AgNO3标准溶液滴定:Ag+ + Cl- =AgCl (白色)2Ag+ + CrO42- =Ag2CrO4 (砖红色)由于AgCl沉淀的溶解度小于Ag2CrO4沉淀的溶解度,所以在滴定过程中,首先生成AgCl沉淀,随着AgNO3标准溶液继续加入,AgCl沉淀不断生成,溶液中Cl- 浓度越来越小,Ag+浓度越来越大,直至[Ag +]2[ CrO 42-] > Ksp 时,便出现砖红色Ag 2CrO 4的沉淀,指示滴定终点的到达。
显然,终点出现的早晚与溶液中CrO 42-的浓度大小有关。
若CrO 42- 的浓度过大,则终点提前出现,使分析结果偏低;若CrO 42-浓度过小,则终点推迟,使分析结果偏高。
因此,为了获得准确的分析结果,必须控制CrO 42-的浓度,适宜CrO 42-的浓度可以从理论上加以计算。
在计量点时,Cl -与Ag +恰好完全作用生成AgCl 沉淀,此时[Ag +] = [Cl -] =√Ksp (AgCl) = √1.56×10-10 = 1.25×10-5 mol/L若Ag 2CrO 4沉淀恰在计量点时生成,则[][]()L m o l Ag CrO Ag Ksp CrO /108.51025.1100.9,225122442---+⨯=⨯⨯==-2在实际滴定中,因为K 2CrO 4本身呈黄色,若接上面计算的CrO 42-浓度,颜色太深影响终点的观察。

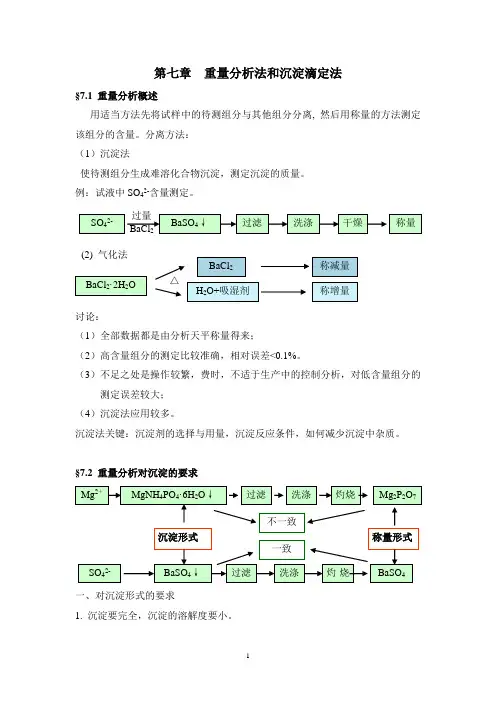
第七章 重量分析法和沉淀滴定法§7.1 重量分析概述用适当方法先将试样中的待测组分与其他组分分离, 然后用称量的方法测定该组分的含量。
分离方法:(1)沉淀法使待测组分生成难溶化合物沉淀,测定沉淀的质量。
例:试液中SO 42-含量测定。
讨论:(1)全部数据都是由分析天平称量得来;(2)高含量组分的测定比较准确,相对误差<0.1%。
(3)不足之处是操作较繁,费时,不适于生产中的控制分析,对低含量组分的测定误差较大;(4)沉淀法应用较多。
沉淀法关键:沉淀剂的选择与用量,沉淀反应条件,如何减少沉淀中杂质。
§7.2 重量分析对沉淀的要求一、对沉淀形式的要求1. 沉淀要完全,沉淀的溶解度要小。
△例:测Ca2+,CaSO4:Ksp=2.45×10-5;CaC2O4:Ksp=1.78×10-92. 沉淀要纯净,尽量避免混进杂质,易于过滤和洗涤。
颗粒较粗的晶形沉淀:MgNH4PO4·6H2O,颗粒细小的晶形沉淀:CaC2O4、BaSO4等,非晶形沉淀:Al(OH)3,3. 易转化为称量形式二、对称量形式的要求1. 组成必须与化学式完全符合例:磷钼酸铵(溶解度很小的晶形沉淀),组成不定;常采取磷钼酸喹啉作为测定PO43-的称量形式。
2. 称量形式要稳定不易吸收空气中的H2O和CO2,不易分解等。
例:CaC2O4·H2O灼烧后得到CaO不宜作为称量形式。
3. 称量形式的摩尔质量尽可能地大减少称量误差。
7.2.3 沉淀剂的选择根据上述对沉淀形式的要求来考虑沉淀剂的选择。
1. 沉淀剂应具有较好的选择性例:丁二酮肟和H2S都可沉淀Ni2+,但常选用前者。
2. 选用易挥发或易灼烧除去的沉淀剂铵盐和有机沉淀剂都能满足这项要求。
§7.3 沉淀完全的程度与影响沉淀溶解度的因素一、沉淀平衡,溶度积MA(固)= M+ + A-(溶液)活度积:Kap =aM+ × aA-aM+=γM+ × cM+;aA- = γA- × cA-Kap= cM+ × cA- ×γM+ ×γA-纯水中MA的溶解度很小:cM+ × cA- = S02 = Ksp溶度积,S0为MA的溶解度二、影响沉淀溶解度的因素1. 共同离子效应例: BaCl 2+ SO 42- → BaSO 4 ↓ (Ksp= 8.7 ×10-11)(1) 当加入BaCl 2的量与SO 42-的量符合化学计量关系时,在200mL 溶液中溶解的BaSO 4质量为:(2) 加入过量的BaCl 2 ([Ba 2+] = 0.01mol·L -1)时:沉淀剂决不能加得太多,否则可能发生其他影响。



第六章法芒)辔霧)沉淀滴定-本页仅作为文档封面’使用时请直接删除即可"-内页可以根据需求调整合适字体及大小"分析化学课程教案授课题目(教学章节或主题)「第6章重量分析法和沉淀滴定法授课类型理论课授课时间6学时教学目标或要求:掌握沉淀重量法对沉淀的要求,影响沉淀溶解度的因素,理解溶解度,溶度积和条件溶度积,了解沉淀形成一般过程.掌握减少沉淀沾污的方法,影响沉淀颗粒大小的因素,沉淀条件的选择,理解共沉淀,后沉淀,了解有机沉淀的应用.教学内容(包括基本内容'重点,难点):第6章重量分析法概述一, 重量法的分类和特点二,沉淀重量法的分析过程和对沉淀的要求-1.对沉淀形要求2对称量形的要求沉淀的溶解度及其影响因素一:溶解度,溶度积和条件溶度积二,影响沉淀溶解度的因素盐效应2同离子效应3酸效应,4•络合效应,5.其他影响因素沉淀的类型与形成过程-沉淀的类型二,沉淀形成一般过程三:影响沉淀颗粒大小的因素1.沉淀物质的本性2过饱和程度3临界比影响沉淀纯度的因素-共沉淀1.表面吸附2吸留与包夹3生成混晶或固溶体二, 后沉淀(继沉淀)三:减少沉淀沾污的方法沉淀条件的选择沉淀条件的选择和沉淀后的处理丄晶形沉淀2无定形沉淀,3均匀沉淀法称量形的获得——沉淀的过滤:洗涤,烘干或灼烧有机沉淀的应用重量分析结果的计算第6章重量分析法和沉淀滴定法§概述重量分析是通过称量物质的质量进行测定的,测定时通常先用适当的方法使被测组分与其他组分分离•然后称重,由称得的质量计算该组分的含量.-重量法的分类和特点根据被测组分与其他组分分离方法的不同,重量法分为挥发法:电解法和沉淀法三类: 其中以沉淀法最为重要.1.挥发法利用物质的挥发性质'通过加热或其他方法便待测组分从试样中挥发逸出. 例如测定试样中湿存水或结晶水时,可将试样加热烘干恒重,试样减轻的质量即水分质量'或者将逸出的水汽用已知质量的干燥剂吸收,干燥剂増加的质量即水的质量.2.电解法利用电解的方法使待测金属离子在电极上还原析出,然后称重'电极増加的质量即为金属质量.3.沉淀法利用沉淀反应使待测组分以微溶化合物的形式沉淀出来,再使之转化为称量形式称量. 重量法直接通过称量得到分析结果,不用基准物质(或标准物质)进行比较:准确度较高相对误差一般为—缺点是程序长费时多,已逐渐为滴定法代替但目前硅,硫磷鎳以及几种稀有元素的精确测定仍采用重量法.二,沉淀重量法的分析过程和对沉淀的要求.试样分解制成试液后,加入适当的沉淀剂:使被测组分沉淀析出(称为沉淀形),沉淀经过滤,洗涤,在适当温度下烘干成灼烧:转化为称量形,然后称量•根据称量形的化学式计算被测组分在试样中的合量,沉淀形式与称量形式可能相同,也可能不同,以的测定为例试液沉淀剂沉淀形称量形为了保证测定有足够的准确度并便于操作,重量法对沉淀形和称量形有一定要求.1.对沉淀形的要求:①沉淀的溶解度要小;②沉淀纯度要高;③沉淀要便于过滤和洗涤.以上要求分别涉及沉淀平衡,沉淀的形成过程和共沉淀理论,这些是本章讨论的重点,后面将分别介绍.2.对称量形的要求]①称量形必须有确定的化学组成;②称量形必须稳定,不受空气中水分,C02和02等的影响;③称量形的摩尔质量要大,这样可增大称量形的质量,减少称量误差,提高测定准确度. §沉淀的溶解度及其影响因素沉淀的溶解损失量重量法误差的重要来源之一,若沉淀溶解损失小于天平的的称量误差就不影响测定的准确度•实际上相当多的沉淀在纯水中的溶解度都大于此值,但若控制好沉淀条件,就可以降低溶解损失,使其达到上述要求,为此必须了解沉淀溶解度及其影响因素.-溶解度,溶度积和条件溶度积以1:1型难溶化合物MA为例,在水溶液中达到平衡时有如下平衡关系,其中MA(I)可以是不带电荷的分子MA也可以是离子对M+A-,它的活度在一定温度下是常数,叫做固有溶解度(或分子溶解度)以表示因纯固体物质的活度等于1,故若溶液中没有影响沉淀溶解平衡的其他反应存在,则固体MA的溶解度S为So和M+(成A-)的浓度之租对于大多数电解质来说,So都较小而且大多数未被测定故一般计算中往往忽略So 项•但有的化合物的固有溶解度相当大,例如,若按溶度积计算'它在水中的溶解度约X 10-5mol/L,实际测得的溶解度约mol儿这说明溶液中有大量HgCI2分子存在•根据沉淀MA在水溶液中的平衡关系,得到是离子的活度积,称为活度积常数:它仅随温度变化,若引入活度系数,就得到用浓度表示的溶度积常数KspKsp与溶液中的离子强度有关,在重量测定中大多是加入过量沉淀剂,一般离子强度较大,应用溶度积作计算:才符合实际情况.附录表17所列微溶化合物的溶度积:均为活度积:应用时一般作为溶度积,但在离子强度较大时应以相应的计算该条件下的Ksp.实际上除了形成沉淀的主反应外,还可能存在多种副反应•组成沉淀的金属离子还会与多种络合剂络合:也可能发生水解作用:组成沉淀的阴离子还会与H+结合成弱酸,即此时溶液中金属离子总浓度[M]为沉淀剂总浓度[A]为引入相应的副反应系数后,则即称为条件溶度积,因> 1 > l;K*sp>Ksp,即副反应的发生使溶度积常数増大,同络合物的:电对的一样:沉淀的K'sp也随介质条件变化,它表示沉淀与溶液达到平衡时,组成沉淀离子的各种形式总浓度的乘积,用它来作计算才能说明沉淀反应的完全程度.。
第七章沉淀滴定法和重量分析法沉淀滴定法和重量分析法都是以沉淀平衡为基础的分析方法。
沉淀的完全,沉淀的纯净及选择合适的方法确定滴定终点是沉淀滴定法和重量分析法准确定量测定的关键。
第一节沉淀滴定法沉淀滴定法(precipitation titration)是基于沉淀反应的滴定分析方法。
沉淀反应很多,但能作为滴定法的沉淀反应却很少。
主要原因是:(1)沉淀溶解度较大,在化学计量点反应不完全。
(2)共沉淀和后沉淀影响,造成沉淀玷污,结果的误差较大。
(3)形成的沉淀没有固定的组成,缺乏计算依据。
(4)缺少合适指示终点的方法。
目前应用最多的是以AgNO3为滴定剂,生成难溶性银盐沉淀反应的滴定分析法:Ag+ + X-→AgX↓X:Cl-、Br-、I-、CN-、SCN-等以银盐沉淀反应为基础的沉淀滴定方法称为银量法(argentimetry),可用于测定Cl-、Br-、I-、CN-、SCN-和Ag+等,也可以测定经处理后,定量转化为这些离子的有机物。
此外,K4[Fe(CN)6]与Zn2+、Ba2+(Pb2+)与2SO-、Hg2+与S2-、NaB(C6H5)4与K+等形成沉淀的反应也可以用于4沉淀滴定分析。
本节主要讨论银量法的基本原理及其应用。
一、银量法的基本原理1.滴定曲线沉淀滴定法滴定过程溶液中构晶离子浓度(或其负对数)的变化情况可以用滴定曲线表示。
以0.1000mol/L AgNO3溶液滴定20.00ml 0.1000mol/L NaCl溶液为例,计算滴定过程中构晶离子浓度或其负对数的变化,绘制滴定曲线。
(1)滴定开始前:溶液中的氯离子浓度等于NaCl 的分析浓度。
[Cl -]=0.1000mol/L pCl=-lg(1.000×10-1)=1.00(2)滴定开始至化学计量点前:溶液中的氯离子浓度,取决于剩余的NaCl 的浓度。
例如,当滴定到90.0%,即加入AgNO 3溶液18.00ml :L /mol 1026.500.1800.2000.21000.0]Cl [3--⨯=+⨯= 28.2pCl = 而Ag +浓度则因为 [Ag +][Cl -]=K sp =1.8×10-10pAg+pCl=-lg K sp =9.74故 pAg=9.74-2.28=7.46同理,当滴定到99.9%,即加入AgNO 3 溶液19.98ml 时,溶液中剩余的Cl -浓度为:[Cl -]=5.0×10-5 mol/L pCl=4.30 pAg=5.44(3)化学计量点:达化学计量点时AgCl 呈饱和溶液。
沉淀滴定法和重量分析法沉淀滴定法是基于沉淀反应的原理进行分析的方法。
其基本原理是当两种反应物溶液混合后,根据溶液中各物质的溶解度、生成的沉淀的重量和比例来确定所分析物质的含量。
在进行沉淀滴定时,通常会使用滴定试剂滴定样品溶液,通过观察反应过程中沉淀的形成和消失来确定滴定终点。
常用的滴定试剂包括银盐、钡盐、钴盐等。
例如,银滴定法可以用来测定氯化物的含量,钴滴定法可以用来测定氰离子的含量。
沉淀滴定法具有简单、直观、准确的优点,因此在实际应用中得到了广泛的应用。
重量分析法则是通过测量试剂或溶液的质量变化来测定被分析物质的含量。
根据试样中所含有的成分,分析过程通常需要经历干燥、加热、溶解、滴定等步骤,最后根据试剂的质量变化来计算所含物质的含量。
重量分析法可以测定各种物质的含量,包括金属、非金属、无机盐、有机物等。
例如,重量分析法可以用来测定硝酸银中含有的银离子的含量,测定石灰石中含有的氧化钙的含量等。
重量分析法的优点是操作简单,结果准确可靠,但常常需要较长的分析时间和较精密的仪器设备。
需要注意的是,无论是沉淀滴定法还是重量分析法,在进行定量分析时都需要进行仪器的校准和样品的预处理。
例如,沉淀滴定法中,滴定试剂浓度的准确测定和标定是非常重要的,而重量分析法中,准确称量试剂和溶液的质量也是至关重要的。
同时,为了提高结果的准确性,需要合理选择试样的取样量和适当设置试剂的使用量,以确保反应完全和准确地测定所需含量。
总之,沉淀滴定法和重量分析法是常见的化学定量分析方法,通过观察沉淀形成和消失过程以及通过称量试剂、试液或溶液的重量变化来确定所分析物质的含量。
这两种方法在实验室和工业生产中都得到了广泛的应用,为我们提供了了解物质组成和含量的重要手段。