2018-2019年高中化学重庆高二水平会考汇编试卷【4】含答案考点及解析
- 格式:docx
- 大小:253.26 KB
- 文档页数:16

2018-2019年高中化学重庆高三水平会考全真试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上一、选择题1.某固体仅由一种元素组成,其密度为5 g/cm3。
用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子,则此元素的相对原子质量最接近()A.32B.65C.120D.150【答案】D【解析】试题分析:设元素的相对原子质量为M,则有20个原子的质量为20M/ NA,已知边长为1nm,即10-7cm,则晶胞的体积为10-21cm3,则ρ=m/V=20M÷6.02×1023÷10−21g/cm3=5g/cm3,解得:M=150,故答案为D。
考点:本题考查相对原子质量的计算。
2.下图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是()A B C D【答案】D【解析】NO2气体能把I-氧化成I2,应变蓝色,D项不一致。
3.下列有关实验操作与结论都正确的是()【答案】B也能使澄清石灰水变浑浊,相应的盐也可能是亚硫酸盐、碳酸氢盐,A项错;只【解析】SO2与葡萄糖只有Al3+遇NaOH才能产生“先生成沉淀后沉淀溶解”的现象,B项对;新制Cu(OH)2有在加热条件下才能产生砖红色沉淀,C项错;若待测液中含有Fe3+也有同样的现象,D项错。
4.下列关于有机物因果关系的叙述完全正确的一组是【答案】D【解析】苯分子结构中不存在碳碳双键,A错误;乙酸乙酯与水发生的是水解反应,乙烯与水发生的是加成反应,B错误;乙酸分子中没有醛基,葡萄糖分子中含有醛基,两者与Cu(OH)反应的实质不同。
C错误。
25.化学无处不在,下列化学原理应用或解释正确的是A.合成洗涤剂和纯碱溶液都可洗去衣服上的油污,二者去污原理相同B.硅胶多孔,吸水能力强,常用作袋装食品的干燥剂和抗氧化剂C.酸雨主要是因SO2、SO3、NO、NO2等酸性氧化物在空气中与雨水作用生成H2SO4、HNO3的缘故D.在轮船船身镶嵌锌块可避免船体遭受海水腐蚀,此法称为牺牲阳极的阴极保护法【答案】D【解析】试题分析:洗涤剂中包含的表面活剂可以降低水的表面张力,从而使洗涤剂更好的渗透到纤维里面,吸附溶解污垢。

2018-2019年高中化学重庆高二水平会考模拟试题【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.下列溶液中的Cl -浓度与100 mL 1 mol ·L -1 MgCl 2溶液中的Cl -浓度相等的是 A .150 mL 1 mol·L -1AlCl 3溶液B .75 mL 0.5mol·L -1CaCl 2溶液C .150 mL 0.75 mol·L -1CaCl 2溶液 D .75 mL 2 mol ·L -1NaCl 溶液【答案】D 【解析】试题分析:1 mol ·L -1 MgCl 2溶液中的Cl -浓度为2 mol ·L -1,A 、Cl -浓度为3mol ·L -1,错误;B 、Cl -浓度为1mol ·L -1,错误;C 、Cl -浓度为1.5mol ·L -1,错误;D 、Cl -浓度为2 mol ·L -1,正确,答案选D 。
考点:考查溶液中离子浓度的计算2.已知在1×105Pa 、298 K 条件下,2 mol 氢气燃烧生成水蒸气放出484 kJ 热量,下列热化学方程式正确的是A .H 2O(g)=H 2(g)+O 2(g)ΔH =242 kJ·mol -1B .2H 2(g)+O 2(g)=2H 2O(l)ΔH =-484 kJ·mol -1C .H 2(g)+O 2(g)=H 2O(g)ΔH =242 kJ·mol -1D .2H 2(g)+O 2(g)=2H 2O(g)ΔH =484 kJ·mol -1 【答案】A 【解析】试题分析:A 、2mol 氢气燃烧生成水蒸气放出484kJ 热量,则1mol 氢气燃烧生成水蒸气放出242kJ 热量,其逆过程就要吸收这些热量,有:H 2O (g )=H 2(g )+O 2(g )△H=+242kJ•mol-1,故A 正确;B 、生成的水应该为气态,而不是液态,故B 错误;C 、反应为放热反应,此时焓变符号为负,故C 错误;D 、反应为放热反应,此时焓变符号为负,故D 错误。

2018-2019年高中化学重庆高二高考真卷精品试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.已知常温下KHSO 3溶液的pH <7,且等浓度的HSO 3-的电离程度大于SO 32-的水解程度。
等物质的量的KHSO 3、K 2SO 3、K 2SO 4溶于足量水形成的溶液中,有关粒子之间的关系正确的是 A .c(SO 42-)>c(HSO 3-)>c(SO 32-) >c(H 2SO 3)B .c(K +)>c(SO 32-)>c(SO 42-)>c(HSO 3-)>c(H +)>c(OH -)C .c(K +)=c(HSO 3-)+2c(SO 32-)+2c(SO 42-)D .c(K +)+c(H +)=c(HSO 3-)+c(SO 32-)+c(SO 42-)+c(OH -) 【答案】B 【解析】试题分析:由于等浓度的HSO 3-的电离程度大于SO 32-的水解程度,所以等物质的量的KHSO 3、K 2SO 3、K 2SO 4溶于足量水形成的溶液时,c(SO 32-)>c(SO 42-)>c(HSO 3-);c(H +)>c(OH -);根据物料守恒及已知条件可知:c(K +)>c(SO 32-)>c(SO 42-)>c(HSO 3-);盐的电离作用远大于弱电解质的电离作用,所以c(HSO 3-)>c(H +)。
故离子浓度的关系是:c(K +)>c(SO 32-)>c(SO 42-)>c(HSO 3-)>c(H +)>c(OH -)。
故选项是B 。
考点:考查溶液中离子浓度的大小比较的知识。
2.下列各组物质的熔沸点按由低到高的顺序排列正确的是 A .冰、干冰、氯化钠、金刚石 B .汞、钠、烧碱、二氧化硅 C .NaCl 、KCl 、CsCl D .H 2O 、H 2S 、H 2Se 、H 2Te【答案】B 【解析】试题分析:A .熔沸点按由低到高的顺序排列应该是干冰冰、、氯化钠、金刚石 。
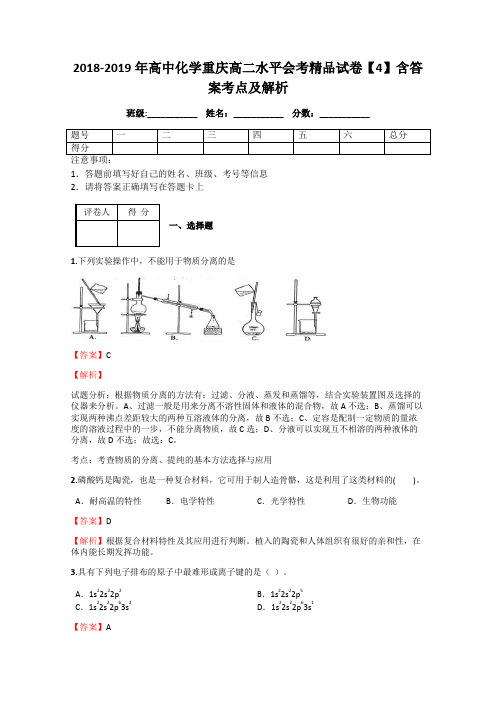
2018-2019年高中化学重庆高二水平会考精品试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上一、选择题1.下列实验操作中,不能用于物质分离的是【答案】C【解析】试题分析:根据物质分离的方法有:过滤、分液、蒸发和蒸馏等,结合实验装置图及选择的仪器来分析。
A、过滤一般是用来分离不溶性固体和液体的混合物,故A不选;B、蒸馏可以实现两种沸点差距较大的两种互溶液体的分离,故B不选;C、定容是配制一定物质的量浓度的溶液过程中的一步,不能分离物质,故C选;D、分液可以实现互不相溶的两种液体的分离,故D不选;故选:C。
考点:考查物质的分离、提纯的基本方法选择与应用2.磷酸钙是陶瓷,也是一种复合材料,它可用于制人造骨骼,这是利用了这类材料的()。
A.耐高温的特性B.电学特性C.光学特性D.生物功能【答案】D【解析】根据复合材料特性及其应用进行判断。
植入的陶瓷和人体组织有很好的亲和性,在体内能长期发挥功能。
3.具有下列电子排布的原子中最难形成离子键的是()。
A.1s22s22p2B.1s22s22p5C.1s22s22p63s2D.1s22s22p63s1【答案】A【解析】形成离子键的元素为活泼金属元素与活泼非金属元素,A 为C ,B 为F ,C 为Mg ,D 为Na ,则只有A 碳元素既难失电子,又难得电子,不易形成离子键。
4.用N A 表示阿伏加德罗常数的值,下列说法正确的是( )A .25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH -数目为0.2N AB .1 mol OH -在电解过程中完全放电时电路中通过了N A 个电子C .铜的电解精炼时,阳极上每转移2mol 电子时就溶解铜原子N A 个D .1mol/L 的Na 2CO 3溶液中CO 32-粒子数目小于N A 【答案】B 【解析】试题分析:A 项,pH=13的1.0L Ba(OH)2溶液中c (OH -)=0.1mol/L ,则n (OH -)=0.1mol ,N (OH -)=0.1 N A ,A 项错误。
2018-2019年高中化学重庆高三水平会考检测试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上一、选择题1.下列物质的转化在给定条件下不能实现的是A.Ca(ClO)2(aq)HClO(aq)HCl(aq)B.H 2SiO3SiO2SiCl4C.Al 2O3NaAlO2(aq)Al(OH)3D.Fe 2O3Fe2(SO4)3(aq)无水Fe2(SO4)3【答案】B【解析】不HCl与反应,故该项错误。
试题分析:B项SiO2考点:考查无机化合物之间的转化。
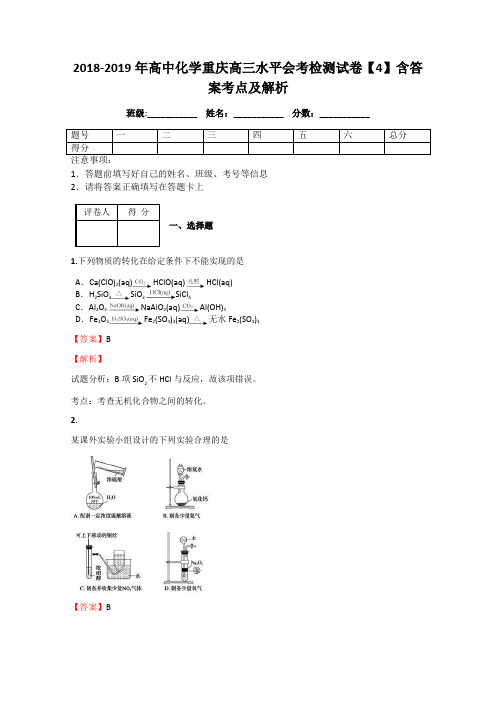
2.某课外实验小组设计的下列实验合理的是【答案】B【解析】A 项中不能在容量瓶中稀释浓硫酸;C 项中NO 2气体不能用排水法收集;D 项中Na 2O 2为粉末状固体,且与水反应剧烈,不适合用简易启普发生器制取。
3.下列实验操作中,仪器一定需要插入液面以下的是①制备Fe(OH)2时将NaOH 溶液滴入FeSO 4溶液中所用的胶头滴管 ②制备氢气的简易装置中的长颈漏斗 ③分馏石油时控制温度的温度计 ④用乙醇制备乙烯时所用的温度计⑤向BaCl 2溶液中滴加稀硫酸所用的胶头滴管 A .③⑤ B .②⑤ C .①②④ D .①②③④⑤【答案】C【解析】分馏石油时,温度计应放在蒸馏烧瓶的支管口处。
向BaCl 2溶液中滴加稀硫酸所用的胶头滴管不应插入BaCl 2溶液的液面下。
4.25 ℃时,a mol·L 一元酸HA 与b mol·L -1NaOH 等体积混合后,pH 为7,则下列关系一定正确的是A .a=bB .a >bC .c(A -)=c(Na +) D .c(A -)<c(Na +)【答案】C【解析】假如酸是强酸,则酸和碱恰好反应显中性,其物质的量应该相等,,即体积相等时,a=b ;假如酸为弱酸,pH=7,酸应该过量,体积相等时,a >b ;故,A 、B 错;要显中性,c(H +)=c (OH -),根据电荷守恒,则c (Na +)=c (A -),D 错;答案选C 。

2018-2019年高中化学重庆高二水平会考测试试题【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.温室效应引起国际的关注,我国也积极应对,采取措施。
中科院首创用CO 2合成可降解塑料聚二氧化碳。
下列相关说法合理的是( ) A .聚二氧化碳塑料是通过加聚反应制得的 B .聚二氧化碳塑料与干冰互为同素异形体 C .聚二氧化碳塑料的使用也会产生白色污染 D .聚二氧化碳塑料与干冰都属于纯净物 【答案】A【解析】CO 2的结构简式为COO ,显然由CO 2制得聚二氧化碳塑料是通过加聚反应完成的,聚二氧化碳是高聚物,属于混合物,而干冰是化合物,属于纯净物,而同素异形体是单质。
因聚二氧化碳可降解,所以不会产生白色污染。
2.如图所示,将铁棒和石墨棒插入1L 1mol ﹒L -1食盐水中。
下列说法正确的是( )A .若电键K 与N 连接,铁被保护不会腐蚀B .若电键K 与N 连接,正极反应式是4OH - -4e -=2H 2O+O 2↑C .若电键K 与M 连接,将石墨棒换成铜棒可实现铁棒上镀铜D .若电键K 与M 连接,当两极共产生28 L(标准状况)气体时,生成1 mol NaOH 【答案】CD 【解析】试题分析:若电键K 与N 连接,该装置构成了原电池,较活泼的金属铁作负极而加速被腐蚀,故A 错误。
若电键K 与N 连接,该装置构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H 2O+O 2+4e -=4OH -,故B 错误。
若电键K 与M 连接,构成电解池,将石墨棒换成铜棒,是电解池的阳极,铁棒是阴极,电解质溶液换成CuSO 4溶液就可以实现铁棒上镀铜,故C 正确。
D .若电键K 与M 连接,该装置是电解池,电池反应式为:2NaCl+2H 2O2NaOH+Cl 2↑+H 2 ↑,假设只发生2NaCl+2H 2O2NaOH+Cl 2↑+H 2 ↑,根据方程式知,当两极共产生28 L (标准状况)体时,生成了1.25molNaOH ,实际上氯化钠只有1mol ,与实际不符合,则电解过程中还电解水,所以当氯化钠完全解时,根据原子守恒生成的氢氧化钠是1mol ,故D 正确。
2018-2019年高中化学重庆高二高考真卷汇编试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.Cu 2O 是一种半导体材料,基于绿色化学理念设计的制取Cu 2O 的电解池示意图如图所示,电解总反应为:2Cu+H 2O Cu 2O+H 2↑。
下列说法正确的是( )A .石墨电极上产生氢气B .铜电极发生还原反应C .铜电极接直流电源的负极D .当有0.1 mol 电子转移时,有0.1 mol Cu 2O 生成 【答案】A 【解析】试题分析:从反应中得知Cu 在通电时失电子,在阳极放电,发生氧化反应,另一电极(石墨)作阴极,发生还原反应,2H 2O+2e -H 2↑+2OH -,相应的Cu Cu 2O ,转移0.1 mol 电子生成0.05 mol Cu 2O ,故B 、C 、D 项错。
考点:电解原理的应用2.下列反应无论怎样调整反应物的用量都只能生成一种物质的是 A .甲烷和氯气混合后光照发生反应 B .乙烯与氯化氢的加成反应 C .1,3—丁二烯与氢气发生反应 D .乙炔和氯气的加成反应【答案】B 【解析】试题分析:A 、甲烷和氯气混合后光照发生反应,生成物为多种取代产物的混合物;B 、乙烯与氯化氢的加成反应产物为氯乙烯;C 、1,3—丁二烯与氢气发生反应可发生1,4-加成和1,4-加成或全部加成;D 、乙炔与氯气加成可生成1,2-二氯乙烯和1,1,2,2-四氯乙烷。
考点:考查有机物的性质。
3.右图是一电池,下列有关说法正确的是A .该电池负极反应为:2Fe 2+-2e -2Fe 3+B .当有6.02×1023电子转移时,Fe 电极减少56g C .石墨电极上发生氧化反应D .盐桥中K +移向FeCl 3溶液 【答案】D 【解析】试题分析:该原电池中,铁作负极,石墨作正极,A .负极上铁失电子发生氧化反应,电极反应式为:Fe-2e -═Fe 2+,A 错误;B .当有6.02×1023电子转移时,Fe 电极减少的质量=××56g·mol -1=28g ,B 错误;C .石墨作正极,正极上铁离子得电子发生还原反应,C 错误;D .盐桥中K +移向正极电解质溶液,即移向FeCl 3溶液,D 正确;选D . 考点:原电池和电解池的工作原理 4.下列说法正确的是A .4.2 g 丙烯中所含的共价键数目为0.6×6.02×1023B .含1 mol H 2SO 4的浓硫酸与足量铜反应转移的电子总数为6.02×1023C .相同条件下,1 L CO 和H 2的混合气体完全燃烧消耗0.5 L O 2D .相同物质的量OH -和CH 3+含有相同数目的电子 【答案】C 【解析】试题分析:丙烯分子含有6个碳氢单键,1个碳碳单键和1个碳碳双键。
2018-2019年高中化学重庆高二水平会考真题试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.进行如下实验,在A 锥形瓶中放入10 g 绿豆大小的碳酸钙,在B 锥形瓶中放入5 g 粉末状的碳酸钙,分别加入50 mL 1 mol·L -1盐酸,下图中能正确表示实验结果的是(注:x —时间,y —锥形瓶中碳酸钙减少的质量)( )【答案】C 【解析】试题分析:有固体参加的反应速率与固体表面积有关。
B 锥形瓶中放入粉末状的碳酸钙,所以B 中产生的CO 2速率比较大;50 mL 1 mol·L -1盐酸最多只能消耗碳酸钙2.5 g ,最终产生的CO 2应该相等,故C 选项的图像符合。
考点:影响化学反应速率的因素 2.对于可逆反应N 2(g )+3H 2(g )2NH 3(g )(正反应为放热反应),下列说法中正确的是( )。
A .达到平衡后加入N 2,当重新达到平衡时,NH 3的浓度比原平衡的大,H 2的浓度比原平衡也大B .达到平衡后,升高温度,既加快了正、逆反应的速率,又提高了NH 3的产率C .达到平衡后,缩小容器的体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率D .加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,逆反应速率减小 【答案】C【解析】达到平衡后,加入N 2平衡向正反应方向移动,NH 3的浓度增大了,而H 2的浓度会减小;达到平衡后,升高温度,正、逆反应速率都增大,但平衡向逆反应方向移动,不利于NH 3的生成;达到平衡后,缩小体积即增大压强,正、逆反应速率都增大,平衡向正反应方向移动,有利于提高H 2的转化率;加入催化剂,能同等程度地增大正、逆反应速率,缩短反应达到平衡的时间。
3.氨气溶于水时,大部分NH 3与H 2O 以氢键(用“…”表示)结合形成NH 3·H 2O 分子。
2018-2019年高中化学重庆高二水平会考拔高试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.在蒸发皿中加热蒸干再加热(低于400℃)下列物质的溶液,可以得到该物质固体的是( ) A .氯化铝 B .碳酸氢钠 C .硫酸亚铁 D .硫酸镁【答案】D 【解析】试题分析:A .氯化铝是强酸弱碱盐。
加热促进盐水解产生氢氧化铝和盐酸。
盐酸有挥发性,会随着水分的蒸发而挥发,所以蒸干得到的固体为氢氧化铝。
再加热氢氧化铝分解得到氧化铝。
错误。
B .碳酸氢钠溶液蒸干得到NaHCO 3.再加热发生分解反应2NaHCO 3Na 2CO 3+CO 2↑+H 2O 。
因此最后得到的固体为Na 2CO 3。
错误。
C .硫酸亚铁是强碱弱酸盐。
加热促进盐水解产生氢氧化铝和硫酸。
由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸亚铁。
但是由于在加热的过程中有空气中的氧气参加反应,因此硫酸亚铁会被氧化为硫酸铁。
所以固体为硫酸铁。
错误。
D .硫酸镁硫酸亚铁是强碱弱酸盐。
加热促进盐水解产生氢氧化铝和硫酸。
由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸镁,最后的固体为硫酸镁。
正确。
考点:考查盐水解在溶液加热蒸干得到的固体中的应用的知识。
2.如图是CsCl 晶体的晶胞结构(晶体中最小重复单元),已知晶体中两个最近的Cs +核间距离为a cm ,氯化铯的式量为M ,N A 为阿伏加德罗常数,则氯化铯晶体的密度为( )。
A .g·cm -3B .g·cm -3C .g·cm -3D .g·cm -3【答案】C【解析】晶体的密度等于晶体的质量与晶体在该质量下的体积的比值(即晶体的密度=),据式量可知,1 mol CsCl的质量为M克,故需求出1 mol CsCl的体积。
2018-2019年高中化学重庆高二水平会考全真试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上一、选择题HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是1.根据反应Br+H2()A.正反应吸热B.加入催化剂,该化学反应的反应热不变C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示D.加入催化剂可增大正反应速率,降低逆反应速率【答案】D【解析】试题分析::加入催化剂能同等程度地加快正、逆反应速率。
考点:影响反应速率的因素2.0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是()A.C(Na+)>C(CN—)>C( H+)>C(OH―)B.C(HCN)+C (CN—)=0.04mol·L—1C.C(Na+)+C(H+)= C(CN—)+C(OH―)D.C(CN—)>C(HCN)【答案】C【解析】试题分析:根据题意可知等浓度、等体积的NaCN、HCN的混合溶液中,C(CN—)<C(Na+),说明NaCN的水解作用大于HCN的电离作用,水解消耗水电离产生的H+,所以溶液显碱性,C(OH―)>C( H+),所以选项A错误;C(HCN)+C (CN—)=(0.02mol/L×1L+0.02mol/L×1L)÷2L=0.02mol/L,所以选项B 错误;C .根据电荷守恒可得:C(Na +)+C(H +)= C(CN —)+C(OH ―)。
正确;D .由于NaCN 、HCN 是等浓度、等体积混合,所以若不水解、不电离,则C(CN —)="C(HCN)=" C(Na +),但是由于反应后C(CN —)< C(Na +),说明CN —水解产生了HCN,所以C(CN —)<C(HCN),选项D 错误。
2018-2019年高中化学重庆高二水平会考汇编试卷【4】含答案考点及解析班级:___________ 姓名:___________ 分数:___________1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上一、选择题1.已知胆矾溶于水时溶液温度降低,室温下将1mol 无水硫酸铜制成溶液时放出热量为Q 1 kJ ,又知胆矾分解的热化学方程式为:CuSO 4·5H 2O(s) CuSO 4(s)+5H 2O(l) ΔH =+Q 2 mol·L 则Q 1和Q 2的关系为( ) A .Q 1<Q 2 B .Q 1>Q 2 C .Q 1=Q 2 D .无法确定【答案】A 【解析】试题分析:假设胆矾溶于水时吸收热量为QKJ/mol ,我们可以认为这个溶解分为2步进行,首先是胆矾分解的热化学方程式为:CuSO 4·5H 2O(s) CuSO 4(s)+5H 2O(l) ΔH =+Q 2 mol/L .然后是室温下将1mol 无水硫酸铜制成溶液时放出热量为Q 1 kJ/mol .则根据盖斯定律可得Q=Q 2-Q 1>0。
所以Q 2>Q 1。
故选项为A 。
考点:考查盖斯定律在物质溶解及化学反应中能量变化中的应用的知识。
2.下列事实可证明氨水中的(NH 3•H 2O)是弱碱的是 A .氨水能被弱酸醋酸中和 B .铵盐受热易分解C .氨水可以使酚酞试液变红D .常温下,0.1 mol/L 氯化铵溶液的pH 约为5【答案】D 【解析】试题分析:常温下,0.1 mol/L 氯化铵溶液的pH 约为5,说明氯化铵是强酸弱碱盐,可证明氨水中的(NH 3•H 2O)是弱碱。
考点:弱电解质的证明3.已知:K sp (AgCl )=1.8×10-10,K sp (AgI )=1.5×10-16,K sp (Ag 2CrO 4)=2.0×10-12则下列难溶盐的饱和溶液中,Ag +浓度大小顺序正确的是( )A .AgCl >AgI >Ag 2CrO 4B .AgCl >Ag 2CrO 4>AgIC .Ag 2CrO 4>AgCl >AgID .Ag 2CrO 4>AgI >AgCl【答案】C 【解析】试题分析:依题意,在氯化银溶液中,有以下关系式:K sp (AgCl )=c(Cl -)·c(Ag +),又因为在氯化银溶液中存在:c(Cl -)=c(Ag +),所以:同理,碘化银溶液中: 铬酸银溶液中:所以:三种溶液中Ag +浓度大小顺序正确的是:C 。
考点:考查难溶电解质中银离子浓度的大小。
4.下列变化过程,属于放热过程的是 A .液态水变成水蒸气 B .酸碱中和反应C .弱酸电离D .NH 4Cl 晶体与Ba(OH)2·8H 2O 混合搅拌【答案】B 【解析】试题分析:A.液态水变成水蒸气,是物理变化中的汽化,是吸热过程,故A 错误;B.酸碱中和反应,是典型的放热反应,是放热过程,故B 正确;C.弱酸电离,是化学变化中的吸热反应,是吸热过程,故C 错误;D.NH 4Cl 晶体与Ba (OH )2•8H 2O 混合搅拌,是典型的吸热反应,是吸热过程,故D 错误; 考点:吸热反应和放热反应 5.下列说法正确的是 ( )A .1 L 水中溶解了58.5 g NaCl ,该溶液的物质的量浓度为1 mol /LB .从1 L2 mol /L 的H 2SO 4溶液中取出0.5L ,该溶液的浓度为1 mol /LC .配制500 mL 0.5 mol /L 的CuSO 4溶液,需62.5 g 胆矾D .中和1 00 mL1 mol /L 的H 2SO 4溶液,需NaOH 4 g 【答案】C 【解析】试题分析:A 不正确,氯化钠的物质的量是1mol ,但溶液的体积不是1L ;溶液是均一、稳定的,则从1 L2 mol /L 的H 2SO 4溶液中取出0.5L ,该溶液的浓度仍然是为2 mol /L ,B 不正确;500 mL 0.5 mol /L 的CuSO 4溶液中硫酸的物质的量是0.25mol ,则需要胆矾的质量是0.25mol×250g/mol =62.5g ,C 正确;中和1 00 mL1 mol /L 的H 2SO 4溶液,需NaOH 的物质的量是0.2mol ,质量是8g ,D 不正确,答案选C 。
考点:考查物质的量浓度的有关判断、计算点评:该题是基础性试题的考查,侧重对教材基础知识的检验和训练,有利于巩固学生的基础,提高学生的应试能力和学习效率,增强学生的学习自信心。
6.下列反应无论怎样调整反应物的用量都只能生成一种物质的是( ) A .甲烷和氯气混合后光照发生反应 B .乙烯与氯化氢的加成反应C .甲苯与等物质的量的Br 2发生反应D .乙炔和氯气的加成反应 【答案】B 【解析】试题分析:甲烷和氯气光照生成物不止一种,A 不符合。
B 中生成物是氯乙烷,产物只有一种;C 中发生的是取代反应,产物不止一种;D 中生成物可以是1,2-二溴乙烯,也可以是1,1,2,2-四溴乙烷,答案选B 。
考点:考查常见有机反应生成物的判断点评:该题是基础性试题的考查,难度不大。
该题的关键是明确加成反应和取代反应的原理,然后结合题意灵活运用即可。
有利于培养学生的逻辑推理能力和发散思维能力。
7.在N 2+3H 2 2NH 3的反应中,经过一段时间后,NH 3的浓度增加了0.6 mol/L ,在此时间内用NH 3表示的反应速率为0.30 mol/(L·s)。
则此一段时间是( ) A .1秒 B .2秒C .0.44秒D .1.33秒【答案】B 【解析】试题分析:由化学反应速率的公式V=C/t 计算可得。
考点:化学反应速率点评:利用反应速率的公式判断、计算反应速率的大小是高考必考知识点,考生应掌握并灵活应用。
8.已知:A 、B 、C 、D 、E 为周期表中前四周期的五种元素,它们的原子序数依次增大。
A 的基态原子有3个不同的能级,各能级中电子数相等;B 的基态原子2p 能级上的未成对电子数与A 原子的相同;B 2- 离子与 C 2+离子具有相同的稳定电子层结构;D 有“生物金属”之称,D 4+离子和氩原子的核外电子排布相同;E 的基态原子的价电子排布式为3d 84s 2。
请回答下列问题:(1)A 、B 、C 三种元素的电负性由大到小的顺序是_______ _(填元素符号)。
(2)在D 的单质晶体中,原子的堆积方式与Mg 同,则其堆积方式是 ,D 原子的配位数是 。
(3)氢气是理想的清洁能源,E 元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如上图所示,晶胞中心有一个E 原子,其他E 原子都在晶胞面上,则该晶体的化学式为________。
已知该晶体的密度为d g·cm -3,其晶胞的边长为a cm ,则该物质的摩尔质量是________。
(阿伏伽德罗常数用N A 表示)【答案】(总11分)(1) O >C >Mg (2分) (2) 六方最密堆积、12(每空2分) (3)LaNi 5 (2分)、 a 3·N A ·d g·mol -1(3分) 【解析】试题分析:根据A 的基态原子有3个不同的能级,各能级中电子数相等,A 为C 元素;B 的基态原子2p 能级上的未成对电子数与A 原子的相同,B 为O 元素;B 2- 离子与 C 2+离子具有相同的稳定电子层结构。
C 为Mg 元素;D 有“生物金属”之称,D 4+离子和氩原子的核外电子排布相同,D 为Ti 元素;E 的基态原子的价电子排布式为3d 84s 2,E 为Ni 元素。
(1) A 、B 、C 分别为C 、O 、Mg 元素,电负性由大到小的顺序是O >C >Mg 。
(2)D 为Ti 元素,其单质晶体的堆积方式是六方最密堆积,原子的配位数是12。
(3)E 为Ni 元素,根据晶胞图示得该晶体的化学式为LaNi 5,该物质的摩尔质量是a 3·N A ·d g·mol-1。
考点:原子组成与结构专题 化学键与晶体结构点评:本题考查较为综合,题目难度中等,正确推断元素的种类为解答该题的关键。
9.右图中的曲线是表示其他条件一定时,2NO +O 22NO 2 △H <0 ,反应中NO 的转化率与温度的关系曲线,图中标有a 、b 、c 、d 四点,其中表示未达到平衡状态,且v (正)>v (逆)的点是 ( )A .a 点B .b 点C .c 点D .d 点【答案】C 【解析】试题分析:该反应是体积减小的放热的可逆反应,图中曲线表示平衡曲线,则a 、c 表示未达到平衡状态,其中a 点要达到平衡状态,则NO 的转化率降低,说明v (正)<v (逆)。
C 的要达到平衡状态,则NO 的转化率增大,说明的点是v (正)>v (逆),答案选C 。
考点:考查平衡状态的有关判断以及图像识别点评:该题是高考中的常见题型,属于中等难度的试题。
试题综合性强,侧重对学生解题能力和技巧的培养和训练,有利于培养学生灵活运用基础知识解决实际问题的能力。
10.用高分子塑料骨钉取代钛合金骨钉是医学上的一项新技术,这种塑料骨钉不仅具有相当的强度,而且可在人体内水解,使骨科病人免遭拔钉的痛苦.合成这种塑料骨钉的原料能与强碱溶液反应,也能在浓硫酸条件下形成环酯.则合成这种塑料骨钉的原料是( ) A .CH 2===CH —CH 2Cl B .CH 2===CH —COOH C .CH 3—CH(OH)—COOH D .H 2N —CH 2—COOH【答案】C 【解析】试题分析:能与强碱溶液反应,则应有羧基或酚羟基;能形成环状酯,则分子中同时含有—OH 和—COOH ,因此答案选C 。
考点:考查有机物结构和性质的判断点评:该题是基础性知识的考查,难度不大。
该题的关键是根据已知信息,准确判断出有机物中的官能团,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
二、实验题11.萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.合成α萜品醇G 的路线之一如下:已知:RCOOC 2H 5,请回答下列问题:(1)A 催化氢化得Z (C 7H 12O 3),写出Z 在一定条件下聚合反应的化学方程式: .(2)B 的分子式为 ;写出一个同时满足下列条件的B 的链状同分异构体的结构简式: .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 (3)B→C 的反应类型为 .(4)C→D 的化学方程式为 . (5)试剂Y 的结构简式为 .(6)G 与H 2O 催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H ,写出H 的结构简式: .【答案】(1);(2)C 8H 14O 3;;(3)取代反应;(4)(5)CH 3MgBr ;(6)【解析】解:由A 、B 的结构可知,A 与甲烷发生加成反应生成B ,B 与HBr 发生取代反应生成C 为,C 发生消去反应生成D 为,D 水解反应得到E 为,E 与乙醇发生酯化反应生成F 为,F 发生信息反应生成G ,结合F 与G 的结合可知Y 为CH 3MgBr ,(1)A 催化氢化得Z (C 7H 12O 3),A 催化加氢生成Z ,结合Z 的分子式可知,该反应为羰基与氢气发生加成反应,故Z 为,Z 通过酯化反应进行的缩聚反应生成高聚物,该反应方程式为,故答案为:;(2)根据B 的结构简可知B 的分子式为C 8H 14O 3,B 的同分异构体中,核磁共振氢谱有2个吸收峰,说明分子中含有2种H 原子,由B 的结构可知,分子中H 原子数目很多,故该同分异构体为对称结构,为链状结构,不饱和度为2,能发生银镜反应,故含有醛基2个﹣CHO ,其余的H 原子以甲基形式存在,另外的O 原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为:,故答案为:C 8H 14O 3;;(3)由B 到C 的反应条件可知,B 发生取代反应生成,故答案为:取代反应;(4)C→D 的化学方程式为,故答案为:;(5)由以上分析可知Y 为CH 3MgBr ,故答案为:CH 3MgBr ;(6)G 与H 2O 催化加成得不含手性碳原子,羟基接在连接甲基的不饱和C 原子上,H 的结构简式为:,故答案为:.【点评】本题考查有机物的推断与合成,难度中等,充分利用有机物的结构、反应条件及反应信息进行判断,掌握官能团的性质与理解反应信息是关键,能较好的考查考生的阅读、自学能力和思维能力,是热点题型.三、填空题12.(10分)写出下列反应的化学方程式,并指出反应类型: (1)实验室制乙烯 ( ) (2)用甲苯制备TNT ( ) (3)苯酚和浓溴水的反应 ( )(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热: ( ) (5)乙醛与银氨溶液的反应 ( ) 【答案】(1),反应类型是消去反应;(2)发生的反应是取代反应;(3)发生的反应是取代反应 ;(4)BrCH 2CH 2Br+2NaOH CH≡CH↑+2NaBr+2H 2O 发生的反应是消去反应 ; (5)CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+3NH 3+2Ag+H 2O 。