第八章 第三讲 盐类的水解
- 格式:docx
- 大小:38.89 KB
- 文档页数:1

43 3 33 4 4 3盐类的水解(讲义)一、知识点睛1.盐类的水解(1)定义在溶液中由盐电离产生的离子与水电离产生的H+或OH-结合生成的反应,叫做盐类的水解反应,简称盐类的水解。
(2)实质盐电离出的弱酸酸根离子(或弱碱阳离子)与水电离出的H+(或OH-),结合生成弱电解质,破坏了水的电离平衡,水的电离程度,溶液中与不再相等,溶液呈现一定的酸性或碱性。
(3)水解条件①盐能溶于水或易溶于水;②盐在水溶液中能电离出弱酸酸根离子或弱碱阳离子。
注:常见的弱碱阳离子:Fe3+、Al3+、Fe2+、Cu2+、Zn2+、NH +等。
常见的弱酸酸根离子:CO 2-、SO 2-、CH3COO-、S2-、HS-、ClO-、F-、HCO -、HSO -、PO 3-、HPO 2-、SiO 2-等。
2.盐类的水解规律简记为:有弱才水解,无弱不水解,越弱越水解,谁强显谁性。
3 3 3. 水解反应表达式(1) 一元弱酸酸根离子水解或一元弱碱阳离子水解CH 3COO -的水解:NH 4+的水解:(2) 多元弱酸酸根离子水解(分步进行,以第一步为主)CO 2-的水解:(3) 多元弱碱阳离子水解(分步进行,以总反应表示)Fe 3+的水解:注:①盐类的水解是酸碱中和反应的逆反应;②大多数水解反应进行的程度很小,水解产物很少,无明显沉淀或气体生成。
4. 影响盐类水解的因素 (1) 温度:温度越高,水解程度。
(2) 浓度:浓度越小,水解程度 。
(3) 外加试剂①加酸可以 弱碱阳离子水解,可以 弱酸酸根离子水解; ②加碱可以弱碱阳离子水解,可以弱酸酸根离子水解;③加入与水解产物相同的离子,水解程度 ,加入能与水解产物反应的物质,水解程度 ;④弱酸酸根离子与弱碱阳离子混合,水解反应相互促进,水解程度增大。
5. 水解原理的应用 (1) 热碱水去油污加热促进 CO 2-水解。
(2) 硫酸铝钾或硫酸铝做净水剂Al 3+水解生成的 Al(OH)3 胶体具有吸附作用。


《盐类的水解》讲义一、什么是盐类的水解在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
我们先来了解一下水的电离。
水是一种极弱的电解质,它能微弱地电离出 H⁺和 OH⁻,在一定温度下,水电离出的 c(H⁺)和 c(OH⁻)的乘积是一个常数,称为水的离子积常数,通常用 Kw 表示。
在常温下,Kw = 10×10⁻¹⁴。
当盐溶解在水中时,盐中的阳离子或阴离子会与水电离出的 H⁺或OH⁻结合。
如果阳离子结合 OH⁻,阴离子结合 H⁺,就会破坏水的电离平衡,使溶液中的 c(H⁺)和 c(OH⁻)不再相等,从而导致溶液呈现酸性或碱性。
二、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才会发生水解。
例如,CH₃COONa 中含有 CH₃COO⁻,它是弱酸根离子,能发生水解;而NaCl 中,Na⁺和 Cl⁻对应的碱和酸都是强酸强碱,所以 NaCl 不水解。
2、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
比如,相同浓度的碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)溶液,由于碳酸的酸性强于碳酸氢根的酸性,所以碳酸钠的水解程度大于碳酸氢钠。
3、谁强显谁性当盐中的阳离子水解程度大于阴离子时,溶液显酸性;当阴离子水解程度大于阳离子时,溶液显碱性;当阳离子和阴离子水解程度相当时,溶液显中性。
例如,氯化铵(NH₄Cl)溶液中,NH₄⁺水解程度大于Cl⁻,溶液显酸性;碳酸钠溶液中,CO₃²⁻水解程度大于Na⁺,溶液显碱性;而醋酸铵(CH₃COONH₄)溶液中,CH₃COO⁻和NH₄⁺水解程度相当,溶液显中性。
三、盐类水解的影响因素1、内因盐本身的性质是决定盐类水解程度的主要因素。
弱酸根离子或弱碱阳离子对应的酸或碱越弱,水解程度越大。
2、外因(1)温度升高温度能促进盐类的水解。
因为水解反应是吸热反应,温度升高,平衡向吸热方向移动,即水解程度增大。
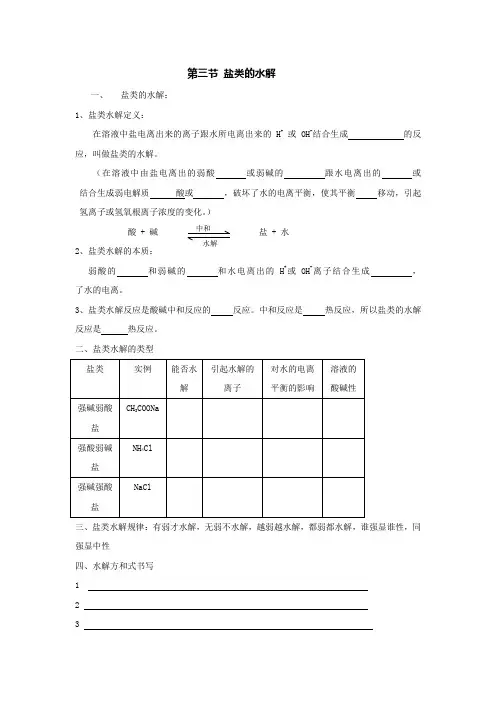
第三节 盐类的水解一、 盐类的水解: 1、盐类水解定义:在溶液中盐电离出来的离子跟水所电离出来的H +或 OH -结合生成 的反应,叫做盐类的水解。
(在溶液中由盐电离出的弱酸 或弱碱的 跟水电离出的 或 结合生成弱电解质 酸或 ,破坏了水的电离平衡,使其平衡 移动,引起氢离子或氢氧根离子浓度的变化。
)酸 + 碱盐 + 水2、盐类水解的本质:弱酸的 和弱碱的 和水电离出的H +或OH -离子结合生成 , 了水的电离。
3、盐类水解反应是酸碱中和反应的 反应。
中和反应是 热反应,所以盐类的水解反应是 热反应。
二、盐类水解的类型 三、盐类水解规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性四、水解方和式书写1 2 3中和 水解五影响水解的因素:内因:盐类本身的性质这是影响盐类水解的内在因素。
外因:1、温度温度升高,水解程度。
2、浓度溶液浓度越小,实际上是增加了水的量,可使平衡相反应方向移动,使盐的水解程度。
(最好用勒沙特例原理中浓度同时减小的原理来解释)3、溶液的酸碱性六、水解的应用7 溶液中离子浓度的关系(1)、多元弱酸溶液例1.0.1mol/L的H2S溶液中所存在的离子浓度由大到小的排列顺序是__________.规律是:(2)、一元弱酸的正盐溶液例2.0.1mol/L的CH3COONa溶液中所存在的离子浓度由大到小的排列顺序是______.规律是:(3)、二元弱酸的正盐溶液例3.0.1mol/L的Na2CO3溶液中所存在的离子浓度由大到小的排列顺序是_______.规律是:(不水解离子)>(水解离子)>(显性离子)>(二级水解离子)>(水电离出的另一离子)(4)、二元弱酸的酸式盐溶液例4.0.1mol/L的NaHCO3溶液中所存在的离子浓度由大到小的排列顺序是_________.规律是:(5)、不同溶液中同一离子浓度的比较例5.在相同物质的量浓度的下列各溶液中:①NH4Cl、②CH3COONH4、③NH4HSO4。



盐类的水解盐类的水解是指盐在水溶液中发生水解反应,分解成氢氧根离子(OH-)和金属离子。
在化学中,盐是由阳离子和阴离子组成的化合物。
当盐溶解在水中时,水分子与盐离子发生相互作用,导致盐的水解。
盐的水解可产生酸性、碱性或中性溶液,具有重要的化学性质。
盐的水解类型盐的水解反应可分为酸性水解、碱性水解和中性水解三种类型。
1. 酸性水解当溶液中存在酸性离子时,如氯离子(Cl-)或硝酸根离子(NO3-),盐类发生酸性水解。
在酸性水解过程中,盐的阳离子将与水生成酸,而盐的阴离子则不参与水解反应。
酸性水解的典型例子是氯化铵(NH4Cl)水解成铵离子(NH4+)和氯离子(Cl-)。
水解后生成的氢氧根离子(OH-)和酸相互中和,产生酸性溶液。
水解方程式如下所示:NH4Cl + H2O ⇌ NH4+ + Cl-NH4+ + H2O ⇌ NH3 + H3O+2. 碱性水解当溶液中存在碱性离子时,如氢氧根离子(OH-)或氧化物离子(O2-),盐类发生碱性水解。
在碱性水解过程中,盐的阴离子将与水生成碱,而盐的阳离子则不参与水解反应。
碱性水解的典型例子是氢氧化钠(NaOH)和氯化钙(CaCl2)。
水解方程式如下所示:NaOH + H2O ⇌ Na+ + OH-CaCl2 + H2O ⇌ Ca2+ + 2Cl-3. 中性水解当盐类既不是酸性离子也不是碱性离子时,其水解产生的氢氧根离子(OH-)和金属离子(如钠离子Na+)相互中和,产生中性溶液。
中性水解的典型例子是氯化铁(FeCl3)。
水解方程式如下所示:FeCl3 + 3H2O ⇌ Fe(OH)3 + 3HCl盐类水解的应用盐类的水解在生活和工业中具有广泛的应用。
1. 食品加工在食品加工中,常使用盐类进行调味。
盐的水解反应使食物呈酸性、碱性或中性,影响食物的味道和质地。
例如,在酸奶的制作过程中,盐类的水解反应是发酵过程中乳酸菌与葡萄糖进行代谢产生乳酸的结果。
2. 化学工业在化学工业中,盐类的水解反应被广泛应用于酸碱中和反应和沉淀反应的过程中。

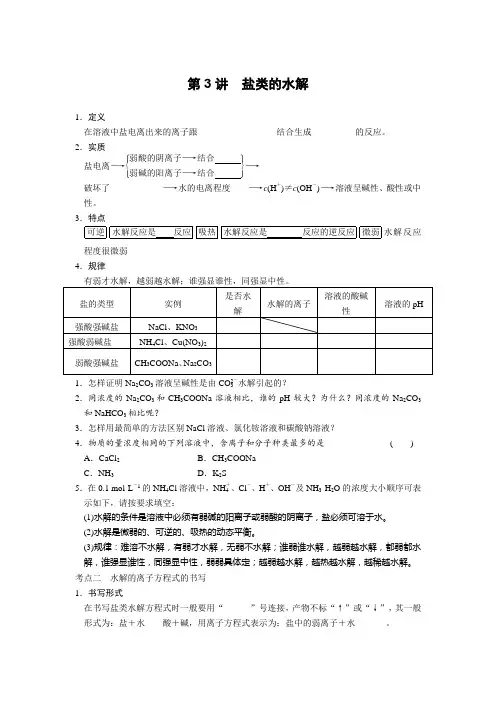
第3讲 盐类的水解1.定义在溶液中盐电离出来的离子跟__________________结合生成__________的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合 弱碱的阳离子―→结合 ―→ 破坏了____________―→水的电离程度____―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性。
3.特点可逆水解反应是 反应吸热水解反应是 反应的逆反应微弱水解反应程度很微弱 4.规律盐的类型 实例 是否水解 水解的离子溶液的酸碱性 溶液的pH强酸强碱盐 NaCl 、KNO 3 强酸弱碱盐 NH 4Cl 、Cu(NO 3)2 弱酸强碱盐CH 3COONa 、Na 2CO 31.怎样证明Na 2CO 3溶液呈碱性是由CO 2-3水解引起的?2.同浓度的Na 2CO 3和CH 3COONa 溶液相比,谁的pH 较大?为什么?同浓度的Na 2CO 3和NaHCO 3相比呢?3.怎样用最简单的方法区别NaCl 溶液、氯化铵溶液和碳酸钠溶液? 4.物质的量浓度相同的下列溶液中,含离子和分子种类最多的是 ( )A .CaCl 2B .CH 3COONaC .NH 3D .K 2S5.在0.1 mol·L -1的NH 4Cl 溶液中,NH +4、Cl -、H +、OH -及NH 3·H 2O 的浓度大小顺序可表示如下,请按要求填空:(1)水解的条件是溶液中必须有弱碱的阳离子或弱酸的阴离子,盐必须可溶于水。
(2)水解是微弱的、可逆的、吸热的动态平衡。
(3)规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。
考点二 水解的离子方程式的书写 1.书写形式在书写盐类水解方程式时一般要用“______”号连接,产物不标“↑”或“↓”,其一般形式为:盐+水酸+碱,用离子方程式表示为:盐中的弱离子+水_____。

