2019版高考化学大一轮复习第15讲硫及其重要化合物考点2硫酸的性质硫及其化合物的相互转化考题集萃实战演练
- 格式:doc
- 大小:54.50 KB
- 文档页数:2

硫及其化合物(2)核心知识点一:一、硫酸1.稀硫酸的性质稀H2s04具有酸的通性硫酸是强电解质,在水溶液中的电离方程式为H2sO4==2HHSO42-,能与指示剂、金属、碱性氧化物、碱、盐等物质发生反应。
2.浓硫酸的性质(1)硫酸的物理性质:纯硫酸是一种无色油状液体,沸点高,难挥发。
浓H2s04与水以任意比互溶,溶解时可放出大量的热,所以浓H2s04稀释的时候,要将浓H2s04沿器壁慢慢注入水中,并用玻璃棒不断搅拌。
(2)浓H2SO4的三大特性①吸水性:可作为干燥剂,但由于氧化性和酸性的存在,因此不能够干燥还原性气体如H2S和碱性气体NH3。
通常使用装置为洗气瓶。
②脱水性:蔗糖中加入浓硫酸或用蘸有浓硫酸的玻璃棒在纸张上写字,都会发现有黑色的碳生成。
说明:蔗糖黑面包实验中,我们闻到的刺鼻性气味就是脱水后的碳与浓硫酸反应的结果。
③强氧化性:与金属反应:△A Cu+2H2sO4(浓)—CuSO4+SO2T+2H2O> C+2H2SO4 (浓)—CO2T+2SO2T +2H2O。
钝化常温下,铁、铝遇浓H2sO4钝化,可用铝槽车运浓H2sO4。
_____________ ___ __________ ______ ______但是在加热条件下铁、铝可以与浓硫酸反应:2Fe + 6H2sO4(浓)F e2(SO4)3 + 3SO2T+△6H2O;2Al + 6H2SO4(浓)—Al 2(SO4) 3 + 3SO2T+ 6H2O;与非金属反应:热的浓硫酸还能氧化碳、硫等非金属单质。
jh,C + 2H2SO4(浓)CO2 + 2SO2T+ 2H2O;AS + 2H2SO4(浓)-3SO2 + 2H2O浓硫酸还能与还原性较强的物质反应,如H2S、HI等。
H2S + H2sO4(浓)=S1+ 3SO2 + 2H2O;2HI + H2SO4 (浓)=I2 + SO2T + 2H2O。
3.硫酸根的检验取被检测溶液于试管中,向试管中加足量盐酸溶液,无现象,再向溶液中加入氯化钡溶液,观察有无白色沉淀。
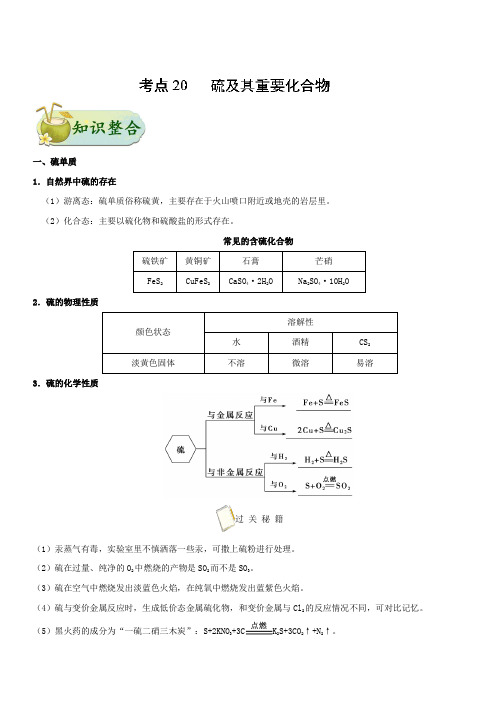
一、硫单质1.自然界中硫的存在(1)游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
常见的含硫化合物2.硫的物理性质溶解性颜色状态水酒精CS2淡黄色固体不溶微溶易溶3.硫的化学性质过关秘籍(1)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(2)硫在过量、纯净的O2中燃烧的产物是SO2而不是SO3。
(3)硫在空气中燃烧发出淡蓝色火焰,在纯氧中燃烧发出蓝紫色火焰。
(4)硫与变价金属反应时,生成低价态金属硫化物,和变价金属与Cl2的反应情况不同,可对比记忆。
(5)黑火药的成分为“一硫二硝三木炭”:S+2KNO3+3C K2S+3CO2↑+N2↑。
二、硫的氧化物——二氧化硫和三氧化硫1.二氧化硫(1)物理性质(2)化学性质①酸性氧化物的通性a.与水反应:SO 2+H2O H2SO3b.使指示剂变色:SO2能使紫色石蕊溶液变红c.与碱反应:NaOH足量:SO2+2NaOH Na2SO3+H2ONaOH不足量:SO2+NaOH NaHSO3d.与碱性氧化物反应:SO2+CaO CaSO3②氧化性:2H2S+SO23S↓+2H2O(产生淡黄色沉淀)③还原性a.与O2反应:2SO2+O22SO3b.与X2(Cl2、Br2、I2)的水溶液反应:SO2+X2+2H2O2HX+H2SO4c.可被酸性KMnO4溶液、K2Cr2O7溶液、H2O2、Fe3+等氧化。
④漂白性:SO2能漂白某些有色物质(如品红溶液),但不能使紫色石蕊溶液等指示剂褪色。
(3)检验将气体通入品红溶液后,溶液褪色,加热后溶液又恢复到红色则可验证该气体是SO2。
注意“加热”是必不可少的步骤,因为氯气也能使品红溶液褪色,但加热后溶液不会重新变红色。
2.三氧化硫(1)物理性质常温常压下为无色、易挥发的液体,熔点为16.8 ℃,沸点为44.8 ℃。
(2)化学性质:酸性氧化物的通性三、硫酸的性质和23SO -、24SO -的检验 1.硫酸的性质干燥注意:(1)浓硫酸的稀释方法:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。


硫及其化合物一、硫及其重要化合物的主要性质及用途: 1.硫:(1)物理性质: 硫为淡黄色固体;不溶于水, 微溶于酒精, 易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体: 如单斜硫、斜方硫、弹性硫等。
(2)化学性质: 硫原子最外层6个电子, 较易得电子, 表现较强的氧化性。
①与金属反应(与变价金属反应, 均是金属氧化成低价态)Al 2S 3的唯一途径) 2S (黑色) ②与非金属反应2 (说明硫化氢不稳定)③与化合物的反应 S+6HNO 34+6NO 2↑+2H 2O S+2H 2SO 4+2H 2O 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途: 大量用于制造硫酸、三药一柴: 医药、火药、农药、和火柴的原料。
2. 硫的氧化物: (1)二氧化硫:①SO2是无色而有刺激性气味的有毒气体, 密度比空气大, 容易液化, 易溶于水。
②SO2是酸性氧化物, 能跟水反应生成亚硫酸。
③SO 2有强还原性 常见氧化剂(见上)均可与SO 2发生氧化一还原反应 如: SO2 + Cl 2 +2H2O == H2SO4 + 2HCl④SO 2也有一定的氧化性 2H 2S + SO 2 == 3S ↓ +2H 2O⑤SO2具有漂白性, 能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)⑥实验室制法: Na2SO3 + H2SO4(浓) == Na2SO3 + H2O +SO2↑ 或Cu + 2H 2SO 4(浓) === CuSO 4 + 2H 2O + SO 2↑(2)三氧化硫: 是一种没有颜色易挥发的晶体;具有酸性氧化物的通性, 遇水剧烈反应生成硫酸【练习】分析数据, 回答下列问题: (已知Cl2+SO2+2H2O H2SO4+2HCl)①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________。
②如果将刚取样的上述雨水和自来水相混合, pH将变________(填“大”或“小”)。

精品基础教育教学资料,仅供参考,需要可下载使用!高三化学一轮复习知识点第15讲 硫及其化合物【考情分析】1.了解硫及其重要化合物的制备方法,掌握其主要化学性质及其应用。
2.了解硫的氧化物对环境的影响。
【核心素养分析】1.变化观念与平衡思想:从硫的化合价变化认识硫及其化合物的相互转化及应用。
2.科学探究与创新意识:从不同的角度探究硫及其重要化合物的性质及制备实验方案,并进行实验操作验证。
3.科学态度与社会责任:关注与SO2有关的污染和环境保护,具有可持续发展意识和绿色化学观念。
【重点知识梳理】知识点一 硫及其氧化物的性质 一、硫单质的性质及应用 1.硫元素的存在形态(1)游离态:在火山口附近或地壳的岩层例存在 (2)化合态:以硫化物和硫酸盐的形式存在 2.硫单质的物理性质硫单质俗称硫黄,是一种淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2;有多种同素异形体,如单斜硫、斜方硫等。
3.硫单质的化学性质 (1)S 的氧化性S 与Fe 、Cu 、Hg 反应的化学方程式依次为Fe +S=====△FeS 、2Cu +S=====△Cu 2S 、S +Hg===HgS(此反应适用于除去室内洒落的Hg)。
(2)S 的还原性①S 与O 2反应的化学方程式为S +O 2=====点燃SO 2,在空气中燃烧火焰为淡蓝色。
②与强氧化剂反应(如浓硫酸)的化学方程式为S +2H 2SO 4(浓)=====△3SO 2↑+2H 2O 。
(3)S 与NaOH 溶液反应的化学方程式为3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O ,该反应中硫既是氧化剂,又是还原剂,此反应可用于除去试管内黏附的S 。
【特别提醒】①硫与变价金属反应时,生成低价态金属硫化物(如Cu 2S 、FeS)。
②汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
二、硫的氧化物(SO 2、SO 3)的性质及应用 1.二氧化硫(SO 2) (1)物理性质二氧化硫是无色、有刺激性气味的有毒气体,是大气污染物之一;易溶于水,通常状况下,1体积水溶解约40体积SO 2。

2019高考化学第4章(非金属及其化合物)第3节硫及其重要化合物考点(2)浓硫酸的性质及SO2-4的检验讲与练(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学第4章(非金属及其化合物)第3节硫及其重要化合物考点(2)浓硫酸的性质及SO2-4的检验讲与练(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学第4章(非金属及其化合物)第3节硫及其重要化合物考点(2)浓硫酸的性质及SO2-4的检验讲与练(含解析)的全部内容。
考点二浓硫酸的性质及SO2-,4的检验李仕才1.硫酸的物理性质(1)纯硫酸是一种无色油状液体,沸点高,难挥发.(2)溶解性:浓H2SO4与水以任意比互溶,溶解时可放出大量热,浓H2SO4稀释的方法是将浓H2SO4沿器壁慢慢注入水中,并用玻璃棒不断搅拌.2.稀硫酸具有酸的通性3.浓硫酸的特性4.SO错误!的检验检验SO错误!的操作方法:被检液错误!取清液错误!有无白色沉淀―→判断有无SO错误!先加稀盐酸的目的是排除CO2-,3、SO错误!、Ag+等的干扰,检验过程中可能发生反应的离子方程式:CO2-3+2H+===CO2↑+H2O、SO错误!+2H+===SO2↑+H2O、Ag++Cl-===AgCl↓、Ba2++SO2-,4===BaSO4↓。
判断正误(正确的打“√”,错误的打“×”)1.浓H2SO4使胆矾(CuSO4·5H2O)变成白色粉末,体现了浓H2SO4的脱水性。
( ×)2.浓H2SO4具有强氧化性,不能用于干燥还原性气体SO2。
高考化学复习硫单质及其化合物知识点
6.与碱反应
7.有漂白性(与有机色质化合成无色物质,生成的无色物质不太稳定,受热或时日一久便返色)
(三)硫酸性质用途小结
1.强酸性
(1)、与碱反应
(2)、与碱性氧化物反应(除锈;制硫酸铜等盐)
(3)、与弱酸盐反应(制某些弱酸或酸式盐)
硫单质及其化合物知识点的全部内容就是这些,查字典化学网预祝考生可以取得更优异的成绩。
2019年高考第一轮复习备考专题已经新鲜出炉了,专题包含高考各科第一轮复习要点、复习方法、复习计划、复习试题,大家来一起看看吧~。
高一化学第三章《硫硫酸》知识点总结一、硫(一)硫的存在硫在自然界中以游离态和化合态两种形式存在。
游离态的硫存在于火山口附近或地壳的岩层里。
化合态的硫主要以硫化物和硫酸盐的形式存在,如黄铁矿(FeS₂)、黄铜矿(CuFeS₂)、石膏(CaSO₄·2H₂O)、芒硝(Na₂SO₄·10H₂O)等。
(二)硫的物理性质硫通常是一种黄色晶体,俗称硫磺,质脆,易研成粉末。
硫不溶于水,微溶于酒精,易溶于二硫化碳(CS₂)。
(三)硫的化学性质1、氧化性硫与金属单质反应,如硫与铁反应生成硫化亚铁(FeS):Fe + S = FeS (加热);硫与铜反应生成硫化亚铜(Cu₂S):2Cu + S =Cu₂S (加热)。
2、还原性硫在空气中燃烧生成二氧化硫(SO₂):S + O₂= SO₂(点燃)。
二、二氧化硫(一)二氧化硫的物理性质二氧化硫是一种无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(1∶40)。
(二)二氧化硫的化学性质1、酸性氧化物的通性(1)与水反应:SO₂+ H₂O ⇌ H₂SO₃。
(2)与碱反应:SO₂(少量)+ 2NaOH = Na₂SO₃+ H₂O ;SO₂(过量)+ NaOH = NaHSO₃。
(3)与碱性氧化物反应:SO₂+ CaO = CaSO₃。
2、氧化性和还原性(1)氧化性:SO₂+ 2H₂S =3S↓ + 2H₂O 。
(2)还原性:2SO₂+ O₂= 2SO₃(催化剂、加热);SO₂能使氯水、溴水、碘水褪色:SO₂+ Cl₂+ 2H₂O = H₂SO₄+ 2HCl 。
3、漂白性二氧化硫能使品红溶液褪色,加热后又恢复原来的颜色。
这是因为二氧化硫与某些有色物质结合生成不稳定的无色物质。
三、三氧化硫(一)三氧化硫的物理性质三氧化硫是一种无色易挥发的晶体,熔点 168℃,沸点 448℃。
(二)三氧化硫的化学性质三氧化硫是酸性氧化物,具有酸性氧化物的通性。
1、与水反应:SO₃+ H₂O = H₂SO₄,放出大量的热。
第四章 第15讲 考点二
1.(2017·海南卷)分别将足量下列气体通入稀Na 2S 溶液中,可以使溶液变浑浊的是( B )
A .CO
B .SO 2
C .HCl
D .CO 2
解析 A 项,CO 与Na 2S 不反应,无明显现象,错误;B 项,二氧化硫具有氧化性,能与Na 2S 反应生成S 单质,使溶液变浑浊,正确;C 项,盐酸的酸性比H 2S 强,所以HCl 与Na 2S 可以反应产生具有臭鸡蛋气味的气体H 2S ,但溶液不变浑浊,错误;D 项,CO 2与Na 2S 不反应,无明显现象,错误。
2.Na 2S 2O 3是重要的化工原料,易溶于水,在中性或碱性环境中较稳定。
Ⅰ.制备Na 2S 2O 3·5H 2O
反应原理:Na 2SO 3(aq)+S(s)=====△Na 2S 2O 3(aq)
实验步骤:
①称取15 g Na 2SO 3,加入圆底烧瓶中,再加入80 mL 蒸馏水。
另取5 g 研细的硫粉,用3 mL 乙醇润湿,
加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na 2S 2O 3·5H 2O ,经过滤、洗涤、干燥,得到产品。
回答问题:。
__使硫粉易于分散到溶液中__是硫粉在反应前用乙醇润湿的目的)(1 。
__冷凝回流__是,其作用__冷凝管__是的名称a 器仪)(2 。
检验是否存在该杂质的方__4SO 2Na __是外,最可能存在的无机杂质3SO 2Na 的产品中除了有未反应)(3。
__4SO 2Na 有溶液,若有白色沉淀,则产品中含2BaCl 加取少量产品溶于过量稀盐酸,过滤,向滤液中__是法 +2H
+2-3O 2S __:该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因)(4。
__O 2H +↑2SO +↓S ===
Ⅱ.测定产品纯度
准确称取W g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L -1碘标准溶液滴定。
反
应原理为2S 2O2-3+I 2===S 4O2-6+2I -。
__不变色s 30_持由无色变蓝色且保__:滴定至终点时,溶液颜色的变化)(5 设
(为。
产品的纯度L __m 18.10__为滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积)(6。
__100%×3.620×10-3M W
)__ M 相对分子质量为O 2·5H 3O 2S 2Na
Ⅲ.Na 2S 2O 3的应用
(7)Na 2S 2O 3的还原性较强,在溶液中易被Cl 2氧化成SO2-4,常用作脱氯剂,该反应的离子方程式为。
__+
10H +-8Cl +2-4=2SO ==O 25H +24Cl +2-3O 2S __ 解析 (1)硫粉难溶于水,微溶于乙醇,故硫粉用乙醇润湿后易扩散到溶液中。
(2)装置中仪器a(冷凝管)可以将挥发出的乙醇冷凝回流到烧瓶中。
(3)因反应物Na 2SO 3易被空气中的氧气氧化成Na 2SO 4,故可能存在的无机杂质是Na 2SO 4;检验产品中是否含有Na 2SO 4,即检验SO2-4是否存在,需要防止SO2-3的干扰,故不能用具有强氧化性的硝酸酸化,而应用盐酸酸化,过滤除去不溶物,再向滤液中滴加氯化钡溶液。
(4)产品发黄,说明产品中含有硫杂质,这是由于在酸性环境中Na 2S 2O 3不稳定,发生反应:2H ++S 2O2-3===S ↓+SO 2↑+H 2O 。
(5)滴定终点时,过量的单质碘使无色的淀粉溶液变蓝。
(6)起始读数为0.00 mL ,终点读数为18.10mL ,所以消耗碘标准溶液的体积为18.10 mL ;根据2Na 2S 2O 3·5H 2O ~2S 2O2-3~I 2,得n (Na 2S 2O 3·5H 2O)=2n (I 2)=2 × 0.100 0 mol·L -1×18.10×10-3 L =3.620×10-3 mol, 则产品的纯度=
3.620×10-3 mol×M g·mol-1W g ×100%=3.620×10-3M W
×100%。
(7)S 2O2-3被Cl 2氧化成SO2-4,Cl 2被还原为Cl -,首先根据化合价升降总值相等写出S 2O2-3+4Cl 2―→2SO2-4+8Cl -,然后根据原子守恒和电荷守
恒配平得S 2O2-3+4Cl 2+5H 2O===2SO2-4+8Cl -+10H +。