第一章 第二节 第1课时 电解质的电离 【新人教版 高中化学必修一】
- 格式:docx
- 大小:1.54 MB
- 文档页数:13



第1课时电解质的电离课后·训练提升课后·训练提升1.下列物质中,能够导电的电解质是( )。
A.铜丝B.熔融的MgCl2C.NaCl溶液D.蔗糖答案:B解析:电解质是在水溶液里或熔融状态下能导电的化合物。
A项,铜是单质;B项,氯化镁是电解质,在熔融状态下能导电;C项,氯化钠是电解质,但是氯化钠溶液是混合物,不是电解质;D 项,蔗糖不是电解质。
2.下列说法正确的是( )。
A.水的导电性很差,所以水不是电解质B.电解质在一定条件下能电离C.酸、碱和盐都属于电解质,其他化合物一定都不是电解质D.NaCl和HCl都是电解质,所以它们在熔融状态下都能导电答案:B解析:水是电解质,水自身能电离出H+和OH-而导电,但是纯水的导电能力很微弱,A项错误。
Na2O等活泼金属氧化物是电解质,C项错误。
NaCl和HCl是电解质,但HCl在熔融状态下不导电,D项错误。
3.下列各组离子均为两种化合物溶于水时电离出的离子,按照仅由酸、碱、盐依次电离的顺序排列的是( )。
①Na+、OH-、S O42-②H+、Cl-、S O42-③Na+、K+、OH-④Na+、K+、N O3-A.②③④B.②①④C.①③②D.④③②答案:A解析:①中三种离子可由NaOH(碱)、Na2SO4(盐)电离得到;②中三种离子可由HCl(酸)、H2SO4(酸)电离得到;③中三种离子可由NaOH(碱)、KOH(碱)电离得到;④中三种离子可由NaNO3(盐)、KNO3(盐)电离得到。
4.下列物质溶于水,其电离方程式正确的是( )。
A.NaHCO3Na++H++C O32-B.(NH4)2SO4N H4++S O42-C.NH4Cl N H4++Cl-D.Ba(OH)2Ba2++O H2-答案:C解析:HC O3-在水溶液中不能拆写,A项错误。
B项中电荷不守恒,原子不守恒。
D项中OH-写法错误。
5.下列说法中不正确的是( )。
①将BaSO4放入水中不能导电,所以BaSO4不是电解质;②氨溶于水得到的氨水能导电,所以氨水是电解质;③NaHSO4电离时生成的阳离子有氢离子,所以是酸;④电解质溶于水中一定能导电,不是电解质的物质放在水中一定不导电A.①④B.①③④C.②③D.①②③④答案:D解析:BaSO4难溶于水,但是在熔融状态下可以导电,所以是电解质,①错误;氨水是混合物,电解质必须是化合物,②错误;NaHSO4电离时生成的阳离子除了氢离子外还有Na+,不是酸,③错误;难溶电解质的水溶液几乎不导电,不是电解质的物质在水中也可能与水反应后生成电解质,也可导电,④错误。


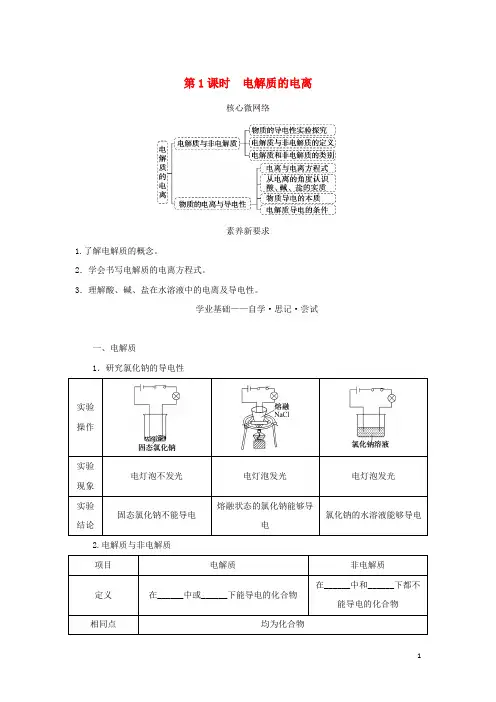
第1课时电解质的电离核心微网络素养新要求1.了解电解质的概念。
2.学会书写电解质的电离方程式。
3.理解酸、碱、盐在水溶液中的电离及导电性。
学业基础——自学·思记·尝试一、电解质1.研究氯化钠的导电性2.电解质与非电解质名师释疑概念理解二、电解质的电离1.定义:电解质在溶于水或受热熔化时,形成________________的过程。
2.电解质电离的条件酸:只能在水溶液中发生电离;碱:强碱在水溶液或熔融状态下均能电离;盐:在水溶液或熔融状态下均能电离;活泼金属氧化物:只能在熔融状态下发生电离。
3.表示方法——电离方程式(1)酸的电离(如H2SO4):________________________________________________________________________。
(2)碱的电离(如NaOH):________________________________________________________________________。
(3)盐的电离(如CuSO4):________________________________________________________________________。
4.以电离的角度认识酸、碱、盐(1)酸:电离时生成的阳离子________________________的化合物。
(2)碱:电离时生成的阴离子________________________的化合物。
(3)盐:由金属阳离子或铵根离子(NH4+)与酸根阴离子组成的化合物。
三、电解质溶液导电的原因及导电能力1.分析NaCl固体、NaCl溶液和熔融NaCl2.原因:电解质 ____________外接电源→ 定向移动形成电流。
3.导电能力:(1)电解质溶液的导电能力与单位体积内电解质电离的离子数目及相应离子所带电荷多少有关,单位体积内电解质电离的离子数目越大,相应离子所带电荷越多,导电能力越强。

人教版高中化学必修第一册第一章-1.2.1-电解质的电离(共32页)(共32张PPT)第一章物质及其变化第二节离子反应第二节01电解质的电离生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。
这是为什么呢[实验1-2]实验装置药品干燥的NaCl固体干燥的KNO3固体蒸馏水NaCl溶液KNO3溶液实验现象实验结论1、物质的导电性实验灯泡不发光灯泡不发光灯泡不发光灯泡发光灯泡发光干燥的NaCl固体不能导电干燥的KNO3固体不能导电蒸馏水不能导电NaCl溶液能够导电KNO3溶液能够导电NaCl、KNO3固体溶于水后,发生了某种变化。
形成了能只有移动的、带电荷的粒子(1)电解质概念:在水溶液里或熔融状态下能够导电的化合物。
电解质所含物质类型:酸:H2SO4、H2CO3、CH3COOH等碱:NaOH、NH3 H2O等盐:NaCl、CaCO3、AgNO3等活泼金属氧化物:Na2O、MgO、CaO等水两种情况任取一种即可。
2、电解质和非电解质(2)非电解质概念:在水溶液里和熔融状态下不能够导电的化合物。
非电解质所含物质类型:非金属化合物:SO2、CO2、CO、P2O5等非酸性气态氢化物:如NH大部分有机物:蔗糖、酒精、CH4、乙醇等两种情况必须同时满足。
(3)从微观角度比较电解质与非电解质溶液NaCl溶液蔗糖溶液(3)电解质和非电解质与物质类别的关系纯净物单质物质化合物混合物电解质非电解质既不是电解质,也不是非电解质重点判断物质是不是电解质的关键(1)判断物质是不是化合物;(2)判断物质在水溶液里或熔融状态下能自身能否发生电离。
不能仅由导电性来判断物质是不是电解质!不能仅由导电性来判断物质是不是电解质!重点(1)能导电的不一定是电解质,如石墨、盐酸等能导电,但它们不是化合物,因而不是电解质;(2)电解质本身不一定能导电,如NaCl晶体不导电;(3)某些物质的水溶液能导电,该物质不一定导电,如SO2、SO3、NH3、CO3等。

第1课时 电解质的电离[知 识 梳 理]知识点一 电解质和非电解质氯化钠注射液是输液常用的一种溶液,氯化钠在水中的溶解如图,是不是所有的物质溶于水都以离子形式存在,哪类物质在溶液中以离子形式存在?请完成下列知识点:1.电解质的概念(1)电解质:在水溶液里或熔融状态下能够导电的化合物。
如:酸、碱、盐、金属氧化物、水。
(2)非电解质:在水溶液里和熔融状态下均不能导电的化合物。
如:蔗糖、乙醇、部分非金属氧化物等。
单质和混合物不是电解质,也不是非电解质2.导电条件及原因(1)固体电解质不导电,只有在水溶液里或受热熔化时才能导电。
因为电解质在水溶液里或受热熔化时发生了电离,电离出了能自由移动的阴阳离子,阴阳离子在电场作用下发生定向移动。
(2)金属能够导电是因为金属中存在自由移动的电子,电子在外电场的作用下,定向移动形成电流而导电。
知识点二 酸、碱、盐在水溶液中的电离如氯化钠溶于水的示意图如下:它究竟是如何发生的?如何表示?1.电解质在水溶液中能够导电,是因为它们在溶液中发生了电离,产生了能够自由移动的离子,其过程常用电离方程式来表示。
电离方程式是表示电解质电离过程的式子。
2.试写出下列酸、碱、盐的电离方程式,并从电离的角度认识酸、碱、盐的本质。
(1)HCl:HCl===H++Cl-,H2SO4:H2SO4===2H++SO2-4;酸是电离时生成的阳离子全部是H+的化合物。
注意“全部”(2)NaOH:NaOH===Na++OH-,Ba(OH)2:Ba(OH)2===Ba2++2OH-;碱是电离时生成的阴离子全部是OH-的化合物。
(3)Na2CO3:Na2CO3===2Na++CO2-3,Al2(SO4)3:Al2(SO4)3===2Al3++3SO2-4;盐是电离时能生成金属阳离子(或NH+4)和酸根阴离子的化合物。
微判断(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质。
( )(2)液态H2SO4、固态NaCl均不导电,所以H2SO4、NaCl均不是电解质。
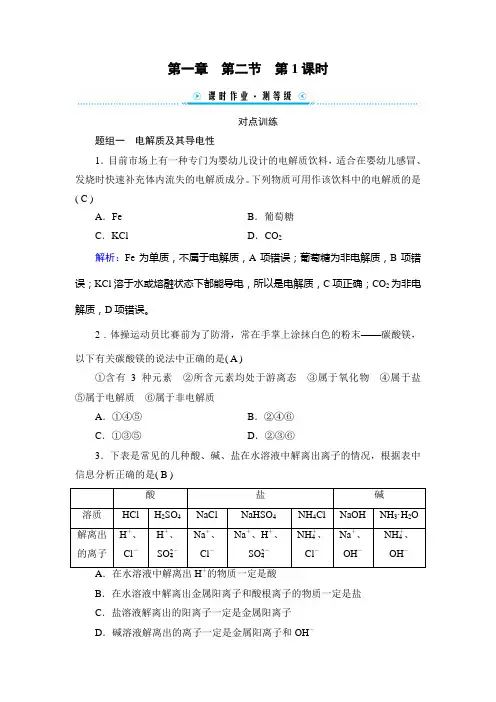
第一章第二节第1课时对点训练题组一电解质及其导电性1.目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。
下列物质可用作该饮料中的电解质的是( C )A.Fe B.葡萄糖C.KCl D.CO2解析:Fe为单质,不属于电解质,A项错误;葡萄糖为非电解质,B项错误;KCl溶于水或熔融状态下都能导电,所以是电解质,C项正确;CO2为非电解质,D项错误。
2.体操运动员比赛前为了防滑,常在手掌上涂抹白色的粉末——碳酸镁,以下有关碳酸镁的说法中正确的是( A )①含有3种元素②所含元素均处于游离态③属于氧化物④属于盐⑤属于电解质⑥属于非电解质A.①④⑤B.②④⑥C.①③⑤D.②③⑥3.下表是常见的几种酸、碱、盐在水溶液中解离出离子的情况,根据表中信息分析正确的是( B )酸盐碱溶质HCl H2SO4NaCl NaHSO4NH4Cl NaOH NH3·H2O解离出的离子H+、Cl-H+、SO2-4Na+、Cl-Na+、H+、SO2-4NH+4、Cl-Na+、OH-NH+4、OH-B.在水溶液中解离出金属阳离子和酸根离子的物质一定是盐C.盐溶液解离出的阳离子一定是金属阳离子D.碱溶液解离出的离子一定是金属阳离子和OH-解析:NaHSO4在水溶液中解离出的离子有H+,但它属于盐,不属于酸,A 错误;盐由金属阳离子(或铵根离子)和酸根离子构成,则在水溶液中解离出金属阳离子和酸根离子的物质一定是盐,B正确;NH4Cl属于盐,在水溶液中解离出的阳离子为NH+4,而不是金属阳离子,C错误;NH3·H2O属于碱,在水溶液中解离出NH+4和OH-,D错误。
4.电解质在人体中具有重要作用。
水、电解质代谢紊乱可使全身各器官系统,特别是心血管系统、神经系统的生理功能和机体的物质代谢发生相应的障碍,严重时常可导致死亡。
下列关于电解质溶液的叙述正确的是( B )A.阳离子和阴离子总数一定相等B.阳离子带的正电荷总数一定和阴离子带的负电荷总数相等C.除阴、阳离子外,溶液中不再含有其他粒子D.NaCl溶液的导电性一定与KCl溶液的导电性相同解析:电解质溶液中的离子可以带一个电荷,也可以带两个电荷或三个电荷,根据电解质溶液呈电中性,则阳离子和阴离子总数不一定相等,故A错误;电解质溶液呈电中性,存在电荷守恒,阳离子带的正电荷总数一定和阴离子带的负电荷总数相等,故B正确;电解质在溶液中,微粒有阴阳离子和水分子等,故C 错误;电解质溶液导电性强弱取决于溶液中离子的浓度和离子所带电荷数,NaCl 溶液和KCl 溶液的浓度不一定相等,二者的导电性不一定相同,故D错误。


第二节离子反应第1课时电解质的电离[核心素养发展目标] 1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。
能从电离的角度认识酸、碱、盐的概念及其各自的通性。
一、电解质及导电性1.物质的导电性实验探究(1)实验操作将如图装置中的样品依次更换为NaCl固体、KNO3固体、蒸馏水、NaCl溶液、KNO3溶液。
(2)实验现象及结论样品干燥的NaCl固体干燥的KNO3固体蒸馏水NaCl溶液KNO3溶液现象灯泡不亮灯泡不亮灯泡不亮灯泡亮灯泡亮结论干燥的NaCl固体不导电干燥的KNO3固体不导电蒸馏水不导电NaCl溶液导电KNO3溶液导电2.物质导电的原因探究(1)物质导电的原因:具有能自由移动、带电荷的粒子。
(2)化合物(以NaCl为例)导电的原因。
NaCl固体NaCl溶液熔融NaCl含有微粒Na+、Cl-水合钠离子、水合氯离子Na+、Cl-微粒能否自由移动否能能能自由移动的原因在水分子作用下Na+、Cl-脱离NaCl固体的表面受热熔化时,离子运动随温度升高而加快,克服了离子间的作用结论:化合物能导电的状态为溶液或熔融状态。
3.电解质(1)(2)非电解质(1)铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质()(2)NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质()(3)NaCl是电解质,所以NaCl固体可以导电()(4)BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质()答案(1)×(2)×(3)×(4)×判断电解质的思维流程1.金属导电和电解质溶液导电的原理分别是什么?提示金属导电是因为金属中存在自由电子,在电场中作定向移动而导电,而电解质溶液导电是阴、阳离子的定向移动形成电流而导电。
2.现有下列物质:①氢氧化钠固体②铜丝③氯化氢气体④稀硫酸⑤二氧化碳气体⑥氨水⑦碳酸钠粉末⑧蔗糖晶体⑨熔融氯化钠⑩胆矾晶体请用序号填空:(1)上述状态下可导电的是。
(2)属于电解质的是。
(3)属于非电解质的是。
(4)上述状态下的电解质不能导电的是。
答案(1)②④⑥⑨(2)①③⑦⑨⑩(3)⑤⑧(4)①③⑦⑩解析化合物中酸(如氯化氢)、碱(如氢氧化钠)、盐(如碳酸钠、胆矾)都是电解质;化合物中非金属氧化物(如二氧化碳)、大部分有机物(如蔗糖)都是非电解质;单质(如铜)和混合物(如氨水)既不是电解质,也不是非电解质。
能导电的物质有金属(如铜)、熔融电解质(如熔融氯化钠)、电解质溶液(如稀硫酸、氨水)。
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨等是非电解质)。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
(4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
(5)电解质、非电解质均必须是化合物,混合物(溶液)、单质既不是电解质也不是非电解质。
二、电解质的电离1.电解质的电离(1)电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
(2)电离方程式(表示方法)①含义:表示电解质电离的式子。
②书写要求:左边写电解质的化学式,右边写电离出的离子。
③实例:HCl===H++Cl-;NaCl===Na++Cl-;Ba(OH)2===Ba2++2OH-。
2.从电离角度认识酸、碱、盐(1)电解质发生电离,是在通电条件下才发生的()(2)NaHSO4在水溶液中可以电离出H+,所以NaHSO4属于酸()(3)液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离()答案(1)×(2)×(3)√1.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
(1)HNO3===H+1+NO-13(2)Ba(OH)2===Ba2++(OH-)2(3)Na2SO4===Na+2+SO2-4(4)Al2(SO4)3===Al3++SO2-4提示(1)不正确;改正:HNO3===H++NO-3(2)不正确;改正:Ba(OH)2===Ba2++2OH-(3)不正确;改正:Na2SO4===2Na++SO2-4(4)不正确;改正:Al2(SO4)3===2Al3++3SO2-4 2.NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。
NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为。
(2)NaHSO4在熔融状态下的电离方程式为。
(3)下列说法中正确的是(填字母)。
a.NaHSO4属于酸b.NaHSO4属于盐c.NaHSO4属于电解质d.NaHSO4溶液能与Zn反应生成氢气提示 (1)NaHSO 4===Na ++H ++SO 2-4 (2)NaHSO 4=====熔融Na ++HSO -4(3)bcd电离方程式书写的注意事项(1)符合客观事实,不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
(2)质量守恒,即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
(3)电荷守恒,即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
知识拓展 从电离角度理解电解质的分类和酸、碱、盐的分类1.电解质的分类2.酸的分类酸根据电离程度⎩⎪⎨⎪⎧强酸:HNO 3、H 2SO 4、HCl 、HBr 、HI 、HClO 4弱酸:H 2CO 3、H 3PO 4、H 2SO 3、CH 3COOH 等 酸根据电离出氢离子的个数⎩⎪⎨⎪⎧一元酸:如HCl 、HNO 3二元酸:如H 2SO 4、H 2CO 3三元酸:如H 3PO 43.碱的分类碱根据电离程度⎩⎪⎨⎪⎧强碱:NaOH 、KOH 、Ca (OH )2、Ba (OH )2弱碱:Cu (OH )2、Fe (OH )3、Mg (OH )2等4.盐的分类盐根据电离出的离子⎩⎪⎨⎪⎧正盐:如Na 2CO 3、Na 2SO 4酸式盐:如NaHSO 4、NaHCO 3碱式盐:如Cu 2(OH )2CO 31.下列说法正确的是( )A .铜、石墨均能导电,所以它们都是电解质B .氨、二氧化碳的水溶液都能导电,所以它们都是电解质C .液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质答案 D解析判断物质是否为电解质,一看物质类别必须是化合物(酸、碱、盐、水等),A不正确;二看溶于水或熔融状态下能否导电,C不正确、D正确;三看溶于水时若与水反应,其溶液导电可能是非电解质,非金属氧化物不是电解质,B不正确。
2.下列各组关于电解质、非电解质的归类,完全正确的是()答案 C解析A项,Fe是单质,既不是电解质,也不是非电解质;B项,NaCl溶液是混合物,既不是电解质,也不是非电解质,BaSO4虽难溶于水,但BaSO4是盐,属于电解质;D项,H2O是电解质。
3.(2019·天津高一期末)下列电离方程式不正确的是()A.AlCl3在溶液中的电离方程式为AlCl3===Al3++Cl3-3B.Ba(OH)2的电离方程式为Ba(OH)2===Ba2++2OH-C.NaHSO4在熔融状态下的电离方程式为NaHSO4(熔融)===Na++HSO-4D.CH3COONH4的电离方程式为CH3COONH4===NH+4+CH3COO-答案 A解析AlCl3是强电解质,在溶液中全部电离,电离方程式为AlCl3===Al3++3Cl-,A错误;Ba(OH)2是强碱,属于强电解质,在溶液中的电离方程式为Ba(OH)2===Ba2++2OH-,B正确;NaHSO4在熔融状态下的电离方程式为NaHSO4(熔融)===Na++HSO-4,C正确;CH3COONH4是强电解质,电离方程式为CH3COONH4===NH+4+CH3COO-,D正确。
4.现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法中,正确的是()A.X一定为电解质B.X可能为非电解质C.X只能是盐类D.X只能是碱类答案 A解析因为该化合物在熔融状态或溶于水能导电,所以该化合物一定是电解质,可以是盐类(如氯化钠),也可以是碱类(如氢氧化钠)等。
5.现有中学化学中常见的八种物质:①固体氢氧化钡②石墨碳棒③纯醋酸④液态氯化氢⑤硫酸氢钾固体⑥熔融氯化钠⑦蔗糖⑧碳酸钠粉末请用序号填空:(1)上述状态下可导电的是,属于非电解质的是。
(2)属于酸的是,属于碱的是,属于盐的是。
(3)写出①④⑤⑧在水溶液中的电离方程式:①;④;⑤;⑧。
答案(1)②⑥⑦(2)③④①⑤⑥⑧(3)Ba(OH)2===Ba2++2OH-HCl===H++Cl-KHSO4===K++H++SO2-4Na2CO3===2Na++CO2-3A组基础对点练题组一电解质及导电性1.下列关于电解质和非电解质的说法中正确的是()A.它们研究的对象都是化合物B.它们的水溶液都能导电C.电解质一定能导电D.不导电的物质一定是非电解质答案 A解析电解质和非电解质研究的对象都是化合物;非电解质的水溶液不导电;电解质为固体时不能导电;不导电的物质不一定是非电解质。
【考点】电解质及导电性【题点】电解质及导电性的判断2.(2020·西安中学高一调研)下列各组物质,前者属于电解质,后者属于非电解质的是() A.NaCl晶体、碱石灰B.铜、二氧化硫C.液态的HCl、酒精D.KNO3溶液、CO2答案 C解析NaCl晶体是电解质,碱石灰是氢氧化钠和氧化钙的混合物,既不是电解质也不是非电解质,A项错误;Cu属于金属单质,既不是电解质也不是非电解质,二氧化硫是非电解质,B项错误;HCl溶于水能导电,属于电解质,酒精属于非电解质,C项正确;硝酸钾溶液为混合物,既不是电解质也不是非电解质,CO2是非电解质,D项错误。
【考点】电解质【题点】电解质非电解质的判断3.下列物质分类正确的组合是()答案 B解析盐酸为混合物、铁为单质,它们既不是电解质,也不是非电解质;碳酸钠、碳酸钙为电解质。
【考点】物质分类电解质【题点】物质分类电解质非电解质的综合考查4.(2020·清华附中高一质检)下列叙述中正确的是()A.强电解质溶液的导电性一定比弱电解质溶液的导电性强B.稀盐酸溶液能导电,所以稀盐酸是电解质C.二氧化硫溶于水能导电,故二氧化硫属于电解质D.硫酸钡虽然难溶于水,但硫酸钡属于电解质答案 D解析导电能力与电解质强弱无关,与自由移动离子的浓度成正比,强电解质导电能力不一定强,弱电解质导电能力不一定弱,故A错误;稀盐酸导电是因为氯化氢在水分子的作用下电离出离子,氯化氢是电解质,稀盐酸是混合物,不是电解质,故B错误;SO2溶于水后和水反应生成亚硫酸,亚硫酸电离出阴、阳离子而使其溶液导电,电离出阴、阳离子的物质是亚硫酸而不是二氧化硫,所以SO2是非电解质,故C错误;BaSO4在水溶液中虽难溶,但溶于水的部分能完全电离:BaSO4===Ba2++SO2-4,故是电解质,且为强电解质,故D正确。