准确标记金属簇合物中的桥基配体
- 格式:pdf
- 大小:259.45 KB
- 文档页数:4






第27章 特殊类型的无机化合物27.1 复习笔记一、金属有机化合物1.定义金属有机化合物又称有机金属化合物,是指分子中含有一个或多个金属-碳键(M—C)的化合物。
2.过渡金属有机配合物(两类)(1)π-酸配合物π-酸配合物是指含有M—C键,形成反馈π配键,碳为σ电子给予体时起刘易斯碱作用,碳为π电子接受体时起刘易斯酸作用的化合物。
(2)π配合物π配合物是指配体中有直链不饱和烃,或有离域π键的环状体系,以π键电子和金属原子结合,可为π电子给予体,也可为π电子接受体的化合物。
3.金属羰基化合物(1)定义金属羰基化合物是指过渡金属元素与CO中性分子形成的配合物,通式。
(2)金属羰基化合物的特点①CO不是一个很强的刘易斯碱,它与过渡金属可形成很强的化学键;②中心原子都是过渡金属,有较低氧化态;③金属羰基化物中除个别外,都符合有效原子序数规则;④无论是单核羰基化合物还是多核羰基化合物都是典型的共价化合物。
难溶于水,易溶于有机溶剂,熔点低,易升华,受热易分解。
(3)金属羰基配合物的制备①由金属与CO 直接作用:②还原法常用的还原剂有CO 、和烷基铝等:③热解和光解法羰基配合物受热或光照下可生成新的羰基配合物:(4)有效原子序数规则有效原子序数规则是指中心原子的电子数加上配体提供的电子数之和应等于同周期的稀有气体元素的原子序数,或者中心原子的价电子数加上配体提供的电子数之和等于18的规则,EAN 规则又称18电子规则。
①EAN 可表示为:为中心原子的价电子数;为配体提供的电子数;为加合电子或与中心原子形成共价单键的原子提供的电子数。
②EAN 规则也有不少例外,如铑、钯、铱和铂等易形成四配位平面形配合物,价层电子总数通常为16也同样非常稳定。
已发现的也不符合EAN 规则。
4.烯烃、炔烃金属有机化合物过渡金属与烯烃、炔烃通过π键可形成一类含有π键的金属有机化合物,称π配合物。
(1)烯烃金属有机化合物蔡斯盐由的盐酸溶液通入乙烯、加入KCl 制得:(2)炔烃金属有机化合物乙炔既可作为二电子给予体,又可作为四电子给予体,可形成双核或三核配合物。

高中化学竞赛配合物构型问题的解题思路作者:陈晟来源:《广西教育·B版》2014年第07期【摘要】根据高中化学竞赛大纲,结合自己多年的竞赛教学经验,对竞赛中出现的配合物问题进行总结,强调配合物构型在竞赛中的重要性。
本文就配合物构型方面的问题展开论述,并对拓展知识“反位效应”和“EAN规则”进行了简要介绍,结合具体例题,总结出配合物构型问题的解题思路。
【关键词】高中化学竞赛配合物构型异构现象解题思路【中图分类号】G【文献标识码】A【文章编号】0450-9889(2014)07B-0115-03高中化学配合物构型问题在化学竞赛中都不同程度地出现,也可以说是绕不开的一道槛。
它不但在化学竞赛中屡见不鲜,而且在高中化学的其他考试中也常常出现。
在此,就高中化学竞赛配合物构型问题进行探讨。
一、配合物问题在高中化学竞赛中的考点分析2008年至2013年6届化学竞赛初赛试卷中出现的配合物问题分值统计如下。
图1从近6年考卷分析,配合物知识点在2008—2013年的化学竞赛初赛试题中占分分别为11分、12分、16分、10分、15分和14分。
赋分比例基本保持稳定,是化学竞赛中重点考核内容之一。
高中化学竞赛大纲指出,配合物的组成、结构、异构现象、配位方程式为主要考点。
近年来的考题当中,配合物构型不仅每年必考,而且占分比例较高。
二、配合物构型问题的理论基础与解题方法拓展(一)理论基础参加高中化学竞赛的考生,必须非常清楚地掌握配合物基本理论。
主要包括:1.配位键的作用形式。
熟悉配位键是由单方面提供孤对电子形成的;了解常见的中心离子的核外电子排布(如Fe3+,Cu2+等);了解常见的单齿配体(如OH-,NH3等)和多齿配体(如乙二胺,EDTA等),并了解多齿配体的多种配位方式。
2.配合物构型基本理论。
了解配合物的杂化轨道理论和晶体场理论;了解内轨型和外轨型配合物构型上的差别;了解晶体场稳定化能对配合物稳定性的影响。
(二)解题思路配合物构型解题思路,概括如下。


《金属有机化学》作业参考答案一选择题1、B;2、C;3、B;4、D;5、A;6、A;7、C;8、A;9、C;10、D;11、A;12、D;13、A;14、C;15、A;16、A;17、C;18、B;19、A;20、A;21、B;22、C;23、D;24、B;25、D;26、A;27、A;28、A;29、D;30、A.31、A;32、B;33、A;34、B;35、B; 36、D;37、A;38、A;39、A;40、B;41、D;42、C 43、C 44、A 45、D 46、A 47、D二填空题1.金属;2.聚氯乙烯稳定剂;3.双键; 4.L=(12-n)/2; 5.四腿琴凳式; 6.非键电子;7.茂; 8.聚硅氧烷; 9.光照;10.环戊二烯基钠;11.配体取代法; 12.酰基;13.活性空位; 14.2电子配体; 15.金属一金属键.; 16.d—p一dπ键; 17.福州模型;18.Dewar-Chatt-Duncanson模型; 19.π给予体簇合物;20.金属羰基原子簇; 21.d—p一dπ键;22.歧化反应。
23、有机化学无机化学24、M—C 过渡金属有机化合物非过渡(主族)金属有机化合物25、离子型化合物σ键合的化合物非经典键合的化合物26、RM R2M27、过渡金属环戊二烯基28、Grignard29、离子键化合物、共价键化合物、缺电子化合物30、有机化学无机化学31、金属-碳( M-C )键32、过渡金属环戊二烯基33、σ-π配键34、Ziegler Natta35、MR2 RMX直线36、Grignard 试剂三简答题1.韦德规则的要点:(1)硼烷和碳硼烷呈三角面多面体构型;(2)由多面体顶点全占据是封闭型;空一个顶点的是巢穴型;空两个顶点是网兜型;(3)每一个骨架B有一个H(或其它单键配体)端基连结在它上面,一对电子定域在上面,剩余的b对电子是骨架成键电子;(4)每一个B提供三个原子轨道(AO)给骨架成键,多面体的对称性由这些AO产生的(M+1)个骨架成键分子轨道(MO)决定(M是多面体顶点),即:因此,算出任一硼烷的成键MO数就能知道它的对称性,而成键MO数=骨架成键电子对数b。

配位键,又称配位共价键,或简称配键,是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
形成条件配位键的形成需要两个条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子。
当一路易斯碱供应电子对给路易斯酸而形成化合物时,配位键就形成了。
例如气态氨NH3和气体三氟化硼BF3形成固体NH3BF3化合价在配位化合物中,由电负性小的元素原子向电负性大的元素原子提供孤对电子形成配位键时,每个有一对孤对电子的前者(电负性小的原子)显示+2价,后者显示-2价。
反之,由电负性大的元素原子提供孤对电子与电负性小的元素原子之间形成配位键时,两种元素都无价态变化。
常见配位键化合物∙一氧化碳CO,其中碳氧间的三对共用电子对有一配位键,两个正常共价键。
∙铵根NH4+,其中N原子与左下右的H原子以极性键结合,与上边的H以配位键结合,由N原子提供孤对电子螯合物(英语:Chelation)是配合物的一种在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。
“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
金属EDTA螯合物螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。
正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。
使用螯合物还可以掩蔽金属离子。
可形成螯合物的配体叫螯合剂。
常见的螯合剂如下:∙乙二胺(en),二齿∙2,2'-联吡啶(bipy),二齿∙1,10-邻二氮杂菲(phen),二齿∙草酸根(ox),二齿∙乙二胺四乙酸(EDTA),六齿值得一提的是EDTA。
它能提供2个氮原子和4个羧基氧原子与金属配合,可以用1个分子把需要6配位的钙离子紧紧包裹起来,生成极稳定的产物。
螯合物在工业中用来除去金属杂质,如水的软化、去除有毒的重金属离子等。
羰基化合物的化学键形式由表1数据知CO的偶极矩较低,尽管氧原子的电负性(3.44)比碳原子的电负性(2.55)高出许多。
因为π配键的存在抵消了氧和碳原子的电负性差产生的极性,使本来电负性强的氧原子端呈现电正性,原本电负性较弱的碳原子端显示电负性,导致CO的偶极矩μ较小。
H2CO NO HI HBr HCl HF μ(D) 0 0.112 0.159 0.448 0.828 1.09 1.827 表1 偶极矩数据表在金属羰基配合物中总是配体中的碳原子提供孤电子对,与中心离子配位。
EAN规则虽能指出金属羰基配合物的稳定性(即把羰基配合物这种特殊的稳定性看作是中心原子具有稀有气体的电子构型。
但是没有从理论上说明CO能和低氧化态的金属原子形成配合物。
此时要从分子轨道理论入手来说明非经典配合物的成键情况。
CO的分子轨道能图如图一:图 1 CO的分子轨道能级图CO分子中的C和2s和2p原子轨道和O的2s和2p轨道成键。
由于原子中对称性相同的2s和2pz轨道之间轨道杂化,可形成两个sp杂化轨道,因此C原子与O原子形成分子时可以组成2个σ孤电子轨道(其中一个是氧的sp杂化轨道,另一个是碳的sp杂化轨道),一个C-Oσ成键分子轨道和一个空的C-Oσ*分子轨道。
此外还有2个充满电子的π键轨道,是由2个px 轨道和2个py轨道组合而成,分别位于yz和xz平面内。
2个孤电子对所占轨道可看成2个σ轨道,基本上可看成分别为碳原子和氧原子提供。
而中心原子的d电子形成反馈π键(如图2)图2金属M与CO中的σ配键和反馈π键这种反馈π键减少了由于生成σ配键而引起的中心原子上过多的负电荷积累,加强了σ配键,同时σ配键的形成也促进了反馈π键的形成。
这种相互促进和加强的σ—π协同作用,增加了羰基配合物的稳定性。
反馈π键的生成,伴随着碳氧间结合力的削弱,根据羰基配合物中CO的伸缩振动频率可以进一步证实这一点(如表2)化合物Mn(CO)6+Cr(CO)6V(CO)6-Mn2(CO)10Ni(CO)4Fe(CO)42-Fe(CO)5COνco/cm-12090 2018 1800 2017 2066 1790 2035 2143表2一些金属羰基化合物中CO的红外吸收频率在金属羰基簇合物中,一氧化碳分子可以和1个、2个、或3个金属原子键合,一般情况下都是通过碳原子与金属原子结合。
金属簇合物的研究摘要: 简述了20世纪90年代以来金属簇合物的研究进展,重点介绍了近年合成的几种具有新结构形式和新成键方式的金属羰基簇合物的衍生物及手性四面体金属簇合物,探讨了金属簇合物的发展趋势。
关键词: 金属簇合物合成结构簇合物化学是研究原子簇化合物的形成、结构和性质的领域。
侧重于研究新型原子簇化合物的合成、结构规律、成键理论和反应活性。
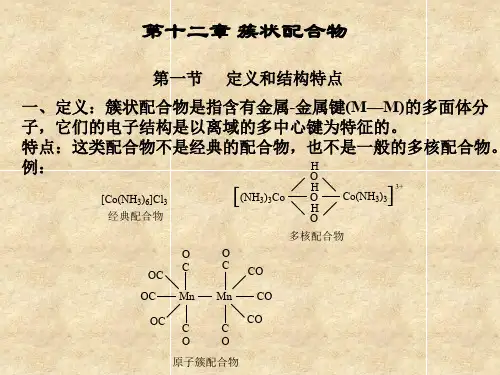
原子簇化合物的定义有不同见解,Cotton F.A.最早提出原子簇概念,指具有金属-金属键(M-M)的多核化合物。
后来,定义为含有三个以上互相结合的金属原子的配合物。
事实上,硼烷类化合物是研究得较早的一类原子簇化合物,有关其结构研究,对金属簇化合物有重大启迪。
在我看来,金属簇合物化学是原子簇中的一个重要分支,是在金属有机化学与无机配合物化学基础上发展起来的一门新兴学科。
它所研究的金属簇合物通常由两部分组成. 一是由2个以上金属原子组成的骨架,二是由有机或无机基团(或分子)组成配体. 由于金属簇合物在性质、结构和成键方式等方面的特殊性,引起了合成、材料催化及理论化学界的极大兴趣。
1 金属簇合物的发展概况过渡金属原子簇化学迅猛发展,已成为近代化学的重要交叉学科之一.。
20世纪90年代以来,人们主要致力于有目的地合成更多的金属簇合物,并进行了大量的表征和结构测定.。
磷和硫与过渡金属有较强的键合能力,配位时常以桥联形式出现,它们作为多配位、多电子配体,在过渡金属簇合物中起重要的作用.。
磷和硫是生物体富含的非金属元素,对含磷和硫配位基的过渡金属簇合物的研究期望为揭示金属酶的生物活性提供重要信息,多样化的磷硫桥基配体与金属簇合物结合,易产生新的成键方式,可以建造多种具有新型几何构型的金属羰基簇合物的衍生物,从而扩展了原子簇化学和配位化学的研究领域。
2 某些金属簇合物的合成和结构含硫过渡金属簇合物往往具有独特的结构或化学性能,近年来,又有将此类簇合物用于均相或模拟多相催化过程的报道,使这一领域研究更加活跃. 尤其是Vahren2kamp研究小组等报道了含硫手征性骨架簇合物之后,具有手征性骨架的含硫簇合物倍受化学家关注. 但Vahr2enkamp方法须使用有机砷试剂,且过程复杂. 徐峰等利用过渡金属亲硫性,以及簇本身的硫原子,在高纯氮保护下,通过较为简便的方法合成了4种含硫杂金属羰基原子簇化合物Cp3WFeC(C0)8 (μ32S) (Cp3= Py, I2a; Cp3= Py2CH3 , II2a) , (C3W) 2Fe (C0) 7 (μ32S) (Cp3= Py ,I2b; Cp3= Py2 CH3 , II2b). 在极性溶剂中HFe2 Co (CO) 9(μ32S)受到CpW3 (CO) 3 阳离子进攻的同时失去氢质子,发生亲电加成,继而碎CpW3 (CO) 3 取代Fe (CO) 3碎片,生成I2a 和II2a. I2b 和II2b 是I2a 和II2a 与CpW3(CO) 3 Cl发生二次亲电加成反应取代消除Co (CO) 3碎片的结果。
第15卷 第5期大学化学2000年10月准确标记金属簇合物中的桥基配体杨 小 兵(武汉大学化学系98级硕士生班 湖北430072) 在金属有机化学的学习中,我阅读了一篇关于环戊二烯类有机金属含硫族化学新进展的图1文献[1]。
在学习中,我发现文献中对含硫桥基配体的配位情况文字解释较清楚,但标记方法却不清晰,如标记“μ22S 2”可能是:S Cr S Cr 或S Cr S 。
又如C p 32Ir 2(μ22S 4)2(图1)中的两个S 4配体均标记为(μ22S 4)。
这样对于桥基配体的标记,很难让读者从标记上了解到清晰的信息。
考虑到桥基配体是金属簇合物中常见的一种配体,因此我特地到图书馆翻阅了20多本提及金属簇合物的教科书,并在C A 上查找了一些关于桥基配体命名及标记的文献。
结果发现,多数教科书和文献对桥基配体的标记不确切,仅少数文献[2~4]对金属簇合物中桥基配体的命名及标记在某些方面作了较为详细的说明,因此我觉得有必要详细介绍一下桥基配体准确的命名及标记方法。
在1972年以前,C A 中还没有簇合物(cluster com pound )这个主题词条。
到1972年该词条才在C A 中出现,并被定义为含有3个或3个以上互相键合或极大部分键合的金属原子的配合物。
在1987年簇合物被修订为含有3个或3个以上直接键合或以非金属原子桥连而形成的一种类似笼状结构的金属原子的配合物。
后来,由于其它类型簇合物的迅猛发展,1992年C A 又将簇合物定义的范围拓宽,其实质性内容与我国化学会在1982年[5]提出的定义基本相同,可理解为含有一定数量的金属或非金属原子结成基团或笼状结构而原子间有一定程度成键的配合物。
金属簇合物化学是原子簇中的一个重要分支,是在金属有机化学与无机配合物化学基础上发展起来的一门新兴的学科。
它所研究的金属簇合物通常由两部分组成。
其一是由两个以上金属原子组成的骨架;其二是由有机或无机基团(或分子)组成的配体。
准确标记金属簇合物中的桥基配体
作者:杨小兵, Yang Xiaobing
作者单位:武汉大学化学系98级硕士生班,湖北,430072
刊名:
大学化学
英文刊名:UNIVERSITY CHEMISTRY
年,卷(期):2000,15(5)
被引用次数:0次
1.金国新.孔庆安查看详情[期刊论文]-化学进展 1998(01)
2.河南大学.南京师范大学.河南师范大学配位化学 1989
3.陈冬玲查看详情 1987(12)
4.Cotton F A查看详情 1968(22)
5.查看详情 1982(11)
6.中国化学会无机化学命名原则 1982
7.陈慧兰.余宝源理论无机化学 1989
8.张祥麟.王曾隽应用无机化学 1992
9.徐志固现代配位化学 1987
10.张祥麟.康衡配位化学 1986
11.周公度无机化学丛书第十一卷,无机结构化学 1982
12.科顿 F A.威尔金森 G.北京师范大学.兰州大学.吉林大学高等无机化学 1981
13.沈斐凤.陈慧兰.余宝源现代无机化学 1985
14.潘道皑.赵成大.郑载兴物质结构 1989
15.拉戈斯基 J L.孟祥胜.许炳安现代无机化学 1983
16.Bulter I S.Harrod J F Inorganic Chemistry:Principles and Applications 1989
17.项斯芬无机化学新兴领域导论 1988
18.戴安邦.庄瑞舫.曾成无机化学丛书第十二卷,配位化学 1987
19.Tnomas M G.Mutterties E L查看详情 1976(15)
20.史启桢.高忆慈查看详情 1997(05)
21.Dorat R.Evans S H.Bodensieck U查看详情 1998
本文链接:/Periodical_dxhx200005015.aspx
授权使用:四川大学(scdx),授权号:8f25a40b-0673-4ec1-a8ce-9ea201601123
下载时间:2011年3月10日。