实验室制备乙烯知识讲解
- 格式:ppt
- 大小:204.50 KB
- 文档页数:5
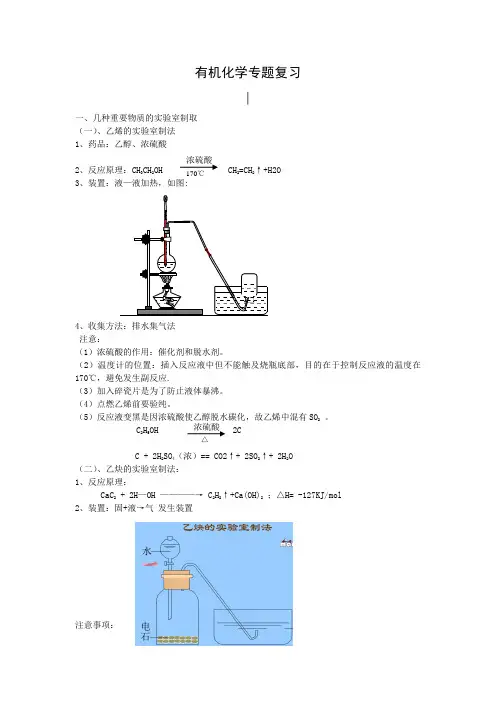
有机化学专题复习∣一、几种重要物质的实验室制取(一)、乙烯的实验室制法1、药品:乙醇、浓硫酸2、反应原理:CH 3CH 2OH CH 2=CH 2↑+H2O3、装置:液—液加热,如图:4、收集方法:排水集气法注意:(1)浓硫酸的作用:催化剂和脱水剂。
(2)温度计的位置:插入反应液中但不能触及烧瓶底部,目的在于控制反应液的温度在170℃,避免发生副反应.(3)加入碎瓷片是为了防止液体暴沸。
(4)点燃乙烯前要验纯。
(5)反应液变黑是因浓硫酸使乙醇脱水碳化,故乙烯中混有SO 2 。
C 2H 5OH 2CC + 2H 2SO 4(浓)== CO2↑+ 2SO 2↑+ 2H 2O(二)、乙炔的实验室制法:1、反应原理:CaC 2 + 2H —OH ————→ C 2H 2↑+Ca(OH)2 ;△H= -127KJ/mol2、装置:固+液→气 发生装置注意事项:浓硫酸170℃浓硫酸 △(1)反应装置不能用启普发生器,改用广口瓶和分液漏斗。
(2)实验中常用饱和食盐水代替水,目的:降低水的含量,得到平稳的乙炔气流。
(3)制取时在导气管口附近塞入少量棉花目的:为防止产生的泡沫涌入导管。
(4)纯净的乙炔气体是无色无味的气体。
用电石和水反应制取的乙炔,常闻到有恶臭气味。
(三)、苯的取代反应1、反应装置2、反应现象3、反应原理4、注意事项(1)、试剂的加入顺序怎样?各试剂在反应中所起到的作用?A 、首先加入铁粉,然后加苯,为防止溴的挥发,最后加溴。
B 、溴应是纯溴,而不是溴水。
加入铁粉起催化作用,实际上起催化作用的是FeBr3。
(2)、导管为什么要这么长?其末端为何不插入液面?C 、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
D 、导管未端不可插入锥形瓶内水面以下,因为HBr 气体易溶于水,以免倒吸。
(3)、反应后的产物是什么?如何分离?E 、导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。
F 、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。


石油化工的龙头——乙烯一、乙烯的组成和结构乙烯分子的结构简式:CH2〓 CH2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置①浓H2SO4的作用:催化剂、脱水剂。
②浓硫酸与无水乙醇的体积比:3∶1。
配制该混合液时,应先加5 mL酒精,再将15 mL浓硫酸缓缓地加入,并不断搅拌。
③由于反应温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,可以在反应混合液中加一些碎瓷片加以防止。
(防暴沸)④ 点燃酒精灯,使温度迅速升至170℃左右,是因为在该温度下副反应少,产物较纯。
⑤ 用排水法收集满之后先将导气管从水槽里取出,再熄酒精灯,停止加热。
〖讨论〗此反应中的副反应,以及NaOH 溶液的作用①乙醇与浓硫酸混合液加热会出现炭化现象,使生成的乙烯中含有CO 2、SO 2等杂质。
SO 2也能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色,因此,检验乙烯气体之前,应该使气体先通过NaOH 溶液,除去CO 2和SO 2。
②乙醇与浓硫酸共热到140℃,乙醇发生分子间脱水,生成乙醚(C 2H 5-O-C 2H 5)三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(使溴水褪色)乙烯除了与溴之外还可以与H 2O 、H 2、卤化氢、Cl 2等在一定条件下发生加成反应,如工业制酒精的原理就是利用乙烯与H 2O 的加成反应而生成乙醇。
3)聚合反应nCH2=其中 CH 2=CH 2 为单体 —CH 2—CH 2— 为链节 n 为聚合度聚乙烯的分子很大,相对分子质量可达到几万到几十万。


乙烯的制取和性质实验乙烯在石油化工等行业是一个极为重要的试剂。
它可以进行多种类型的反应,从而制出化工产品。
例如生活中塑料类物品:盛放食品的保鲜膜,有机玻璃,快餐盒等等都是以乙烯为原料制成的。
乙烯还是一种植物激素,可以用作水果和蔬菜的催熟剂。
【目的】那么在实验室里该怎样制取乙烯呢?好,下面,我们来看一下今天的实验目的,主要有两点:第一,掌握乙烯的实验室制法和性质实验操作技能;第二,联系上次甲烷的实验,了解饱和烃和不饱和烃的共性和特性。
【内容】1、乙烯的制取2、乙烯的性质:加成反应——直接将乙烯气体通入溴水里,观察溴水颜色变化。
氧化反应——直接通入被酸化的高锰酸钾溶液中,观察溶液颜色变化;直接点燃【原理】实验室制取乙烯是实验室里是将无水乙醇和浓硫酸按1:3混合迅速加热到170℃,乙醇发生分子内脱水生成乙烯。
乙醇与浓硫酸反应,首先生成硫酸氢乙酯。
硫酸氢乙酯在170℃分解,放出乙烯。
生成硫酸氢乙酯的反应是一个可逆反应,为了使反应向生成酯的方向移动,并使乙醇的利用率有所提高,常增加硫酸的用量,一般硫酸与乙醇的用量酯1:3。
在140度以下乙醇会大量挥发,140到160度之间乙醇会发生分子间脱水生成醚。
超过180度,会因温度过高,导致浓硫酸使酒精迅速脱水碳化,并将碳氧化生成二氧化碳,同时浓硫酸被还原成二氧化硫气体,不利于乙烯的生成。
发生很多副反应,生成的乙烯中含有乙醇、乙醚、二氧化碳、一氧化碳、二氧化硫、水蒸气等杂质气体。
我们知道二氧化硫和乙醚等回污染环境,并且二氧化硫具有还原性,能使溴水褪色。
【装置】从上面的实验原理可以看出,制取乙烯的反应属于液液加热型,我们会用到一种新的仪器—带支管的蒸馏烧瓶,大家要注意了,不能直接对烧瓶加热,所以在加热过程中要使用石棉网,下面我们来看一下实验装置图。
必须立即升温到170度,由于我们没有电热套,公共台上有脱脂棉,大家可以用脱脂棉沾一点酒精,放在酒精灯上加热,使温度立即上升到170度,不过大家要小心点。

乙烯的制备实验步骤一、引言乙烯是一种重要的有机化合物,广泛用于化学工业中的各种合成反应和聚合反应中。
本文将介绍乙烯的制备实验步骤。
二、实验原理乙烯可以通过蒸馏法从石油裂解气中分离得到。
在实验室中,可以通过酸催化剂催化酒精脱水反应制备乙烯。
三、实验步骤1. 实验器材准备准备好以下器材:250 mL圆底烧瓶、冷凝管、滴液漏斗、橡皮塞和夹子等。
2. 实验药品准备准备好以下药品:浓硫酸、95%无水乙醇。
3. 实验操作步骤(1)向250 mL圆底烧瓶中加入50 mL 95%无水乙醇。
(2)向圆底烧瓶中加入10 mL浓硫酸,轻轻摇晃使其充分混合。
(3)将冷凝管插入圆底烧瓶的橡皮塞上,并用夹子固定住。
(4)将圆底烧瓶放在加热板上,加热至沸腾。
(5)当乙醇完全脱水后,会产生大量气体,通过冷凝管收集气体。
四、实验注意事项1. 实验过程中要注意安全,避免接触浓硫酸。
2. 实验器材和药品要干净、干燥。
3. 在操作过程中要小心谨慎,避免发生意外事故。
五、实验结果分析通过实验可以制备出一定量的乙烯气体。
可以通过对收集到的气体进行分析,确定乙烯的纯度和产量。
六、实验拓展1. 可以改变反应条件,如温度、反应时间等参数,探究其对乙烯产量和纯度的影响。
2. 可以使用其他催化剂进行酒精脱水反应,比较不同催化剂对乙烯产率和纯度的影响。
3. 可以将制备出来的乙烯用于聚合反应或其他合成反应中。
七、总结本文介绍了通过酒精脱水反应制备乙烯的实验步骤和注意事项,并提出了实验拓展的建议。
通过实验可以了解乙烯的制备方法,同时也可以锻炼实验操作技能。

制取乙烯知识点总结乙烯是一种重要的有机化学品,广泛应用于塑料、橡胶、合成纤维等工业中。
乙烯的生产方法有多种,包括乙烯裂解法、氯乙烷氢化法、环氧乙烷水解法、醇烷酸酯法等。
本文将对乙烯制取的几种常见方法进行详细介绍。
一、乙烯裂解法乙烯裂解法是一种传统的制取乙烯的方法,通过对石油、天然气等烃类化合物进行裂解反应,生成乙烯。
裂解反应的条件通常需要高温和催化剂的作用。
此方法生产的乙烯纯度较高,但能源消耗较大,且对原料的要求也较高。
二、氯乙烷氢化法氯乙烷氢化法是一种使用氯乙烷为原料,经过氢化反应制取乙烯的方法。
氯乙烷是以乙烯为原料,通过氯化反应得到的产物,再经过催化剂的作用进行氢化反应,生成乙烯。
此方法简单,适合小规模生产,但对催化剂的选择和反应条件的控制要求较高。
三、环氧乙烷水解法环氧乙烷水解法是以环氧乙烷为原料,经过水解反应得到乙烯的方法。
环氧乙烷是一种重要的有机化合物,它具有三个原子的环氧环结构,可以通过水解反应得到乙烯。
此方法对原料的要求较高,但可以得到高纯度的乙烯。
四、醇烷酸酯法醇烷酸酯法是一种使用醇烷酸酯为原料,经过酯化反应得到乙烯的方法。
醇烷酸酯是一种重要的有机化合物,它可以通过酯化反应得到乙烯。
此方法生产工艺简单,但消耗原料较大,且对催化剂的选择和反应条件的控制要求较高。
总结:乙烯是一种重要的有机化学品,广泛应用于塑料、橡胶、合成纤维等工业中。
乙烯的生产方法有多种,包括乙烯裂解法、氯乙烷氢化法、环氧乙烷水解法、醇烷酸酯法等。
每种方法都有其适用的场合和特点,可以根据需要选择合适的生产方法进行制取乙烯。

实验室制备乙烯方程式实验室制备乙烯是一项常见的化学实验,在化学教学和科学研究中都有广泛应用。
本文将介绍乙烯的制备原理、材料、步骤和实验结果分析等方面的知识。
1. 制备原理乙烯是一种含有双键的烃类分子,可以通过催化剂促进乙烯化反应得到。
乙烯化反应的基本方程式为:C2H4 + H2 --> C2H6其中,C2H4代表乙烯,H2代表氢气,C2H6代表乙烷。
这个方程式表明,在适当的反应条件下,乙烯可以与氢气发生反应生成乙烷。
乙烯的制备就是在这个反应的基础上实现的。
2. 材料制备乙烯需要的材料有:·甲基叔丁基醚(MtBE):作为反应介质,提供反应的环境和保护氧化铝的作用。
·氢气(H2):作为还原剂,促进反应的进行。
·乙烯:作为反应产物,需要通过掌握反应条件和方法加以分离和提取。
·催化剂(ZSM-5):作为反应催化剂,加强反应的速率和效果。
3. 步骤乙烯的制备可分为以下步骤:3.1 加热首先将氧化铝加热至300℃以上,使其脱水产生活性物质,提高反应效率。
3.2 加入甲基叔丁基醚将甲基叔丁基醚加入反应釜中,并控制温度在200℃左右,使其成为反应介质。
3.3 加入催化剂在甲基叔丁基醚中加入催化剂(ZSM-5),并调整反应的pH值,使其适应反应体系的要求。
3.4 加入氢气和乙烯在反应釜中加入氢气(H2)和少量的乙烯,同时调整反应压强为2.0-2.5Mpa,使反应能够充分进行。
3.5 收集乙烯收集反应釜中产生的乙烯,通过分离和提取技术得到纯度较高的乙烯。
4. 实验结果分析通过实验制备的乙烯可进行多项性质测试和分析,如密度、沸点、燃烧特性等。
同时,在反应条件的不同变化下,可以测试不同条件下乙烯反应产量的变化情况,以便改进和优化反应条件。
乙烯是一种重要的工业原料,在化学和制造业中都有广泛应用。
通过实验制备乙烯,不仅可以锻炼实验技能,也有助于深入了解乙烯的物理和化学性质及其广泛的应用领域。



乙烯的实验室制法一、实验目的1.掌握乙烯的制备原理及方法。
2.掌握反应提高产率的措施。
二、实验原理1.实验室制取乙烯的反应原理:2.CH3-CH2-OH CH2=CH2↑+H2O,温度要迅速上升到170℃,防止140℃时生成副产物乙醚,因为:3.CH3-CH2-OH+HO-CH2-CH3CH3-CH2-O -CH2-CH3+H2O。
4.该反应属于“液体+液体生成气体型”反应,两种液体混合后,装于圆底烧瓶中,加热要用到酒精灯,只有当温度计插入液面下,但不能接触瓶底,才能准确测出反应时反应液的温度,避免副反应的发生,确保产物的纯度。
三、药品及装置乙醇、浓硫酸、圆底烧瓶、温度计、铁架台、水槽、集气瓶、双孔橡皮塞、酒精灯、导管。
四、实验装置图五、实验步骤(1)检验气密性。
在烧瓶里注入乙醇和浓硫酸(体积比1:3)的混合液约20mL(配置此混合液在冷却和搅拌下将15mL浓硫酸满满倒入5mL酒精中),并放入几片碎瓷片。
(温度计的水银球要伸入液面以下)(2)加热,使温度迅速升到170℃,酒精便脱水变成乙烯。
(3)用排水集气法收集乙烯。
(4)再将气体分别通入溴水及酸性高锰酸钾溶液,观察现象。
(5)先撤导管,后熄灯。
六、注意事项1.反应原理:(分子内的脱水反应)2.收集气体方法:排水集气法(密度与空气相近)3.现象:溶液变黑;气体使溴水及酸性高锰酸钾溶液褪色。
4注意点:(1)乙醇和浓硫酸体积比为什么是1:3?答:浓硫酸是强氧化剂,在此反应中氧化乙醇,如果浓硫酸的量少就会很快变为稀硫酸而达不到实验效果。
(2)浓硫酸在反应中的作用?答:①催化剂②脱水剂(③吸水剂)(3)为什么要迅速升温到170℃?答:如果低于170℃会有很多的副反应发生。
如:分子之间的脱水反应(4)为什么要加入碎瓷片?答:防止溶液暴沸。
(5)为什么反应过程中溶液逐渐变黑?答:因为在该反应中还伴随有乙醇与浓硫酸发生的氧化还原反应:C2H5OH +2H2SO4(浓) 2C+2SO2↑+2H2O ;C +2H2SO4(浓) CO2↑+2SO2↑+2H2O,由于有C、SO2的生成,故反应液变黑,还有刺激性气味产生。
第1篇一、实验目的1. 了解乙烯的实验室制法及其原理。
2. 掌握实验操作步骤,学习使用实验仪器。
3. 通过实验,加深对化学反应过程的理解。
二、实验原理乙烯是一种无色、具有刺激性气味的气体,化学式为C2H4。
实验室制取乙烯的方法是将乙醇在浓硫酸催化下进行消去反应,生成乙烯和水。
反应方程式如下:CH3CH2OH → CH2=CH2 + H2O三、实验仪器与试剂1. 仪器:圆底烧瓶、温度计、铁架台、水槽、集气瓶、双孔橡皮塞、酒精灯、导管。
2. 试剂:乙醇、浓硫酸。
四、实验步骤1. 准备实验装置:将圆底烧瓶固定在铁架台上,插入温度计,并用双孔橡皮塞密封。
2. 加入试剂:在圆底烧瓶中加入20毫升乙醇和60毫升浓硫酸的混合液。
3. 预热:用酒精灯加热圆底烧瓶,使温度迅速升高至170℃。
4. 收集乙烯:将集气瓶倒置于水槽中,用导管将生成的乙烯导入集气瓶中。
5. 检验乙烯:将集气瓶中的气体分别通入溴水和酸性高锰酸钾溶液中,观察现象。
6. 清理实验装置:关闭酒精灯,撤除导管,待圆底烧瓶冷却后,清理实验仪器。
五、实验现象1. 加热过程中,圆底烧瓶内液体沸腾,产生大量气泡。
2. 集气瓶中的气体通入溴水中,溴水颜色逐渐褪去。
3. 集气瓶中的气体通入酸性高锰酸钾溶液中,溶液颜色逐渐褪去。
六、实验结果分析1. 乙醇在浓硫酸催化下,加热至170℃时发生消去反应,生成乙烯和水。
2. 乙烯具有不饱和键,能与溴水发生加成反应,使溴水褪色。
3. 乙烯具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应,使溶液褪色。
七、实验讨论1. 实验过程中,温度对乙烯的生成有较大影响。
温度过高或过低都会影响乙烯的产量。
2. 实验过程中,浓硫酸的用量对乙烯的产量也有一定影响。
使用过量的浓硫酸可以提高乙醇的利用率,增加乙烯的产量。
3. 实验过程中,应确保实验装置的气密性,防止气体泄漏。
八、实验结论通过本次实验,我们成功制取了乙烯,并验证了其化学性质。
实验过程中,我们掌握了实验室制取乙烯的操作步骤,加深了对化学反应过程的理解。
实验室制乙烯注意事项
1、放入几片碎瓷片作用是什么?防止暴沸
2、浓硫酸的作用是什么?催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计水银球置于液面下但不能接触瓶底,因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。
因为浓硫酸有多种特性。
在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。
可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
9、实验室制乙烯口诀
硫酸酒精三比一。
迅速升温一百七,为防暴沸加碎瓷,排水方法集乙烯。
实验室制取乙烯方程式1. 引言大家好,今天咱们来聊聊一个很酷的实验,那就是在实验室里制取乙烯!乙烯,听起来是不是像个明星?其实,它在化学界可是大名鼎鼎的,广泛用于塑料、橡胶等材料的制造。
今天我就带大家走进这个神奇的实验室,看看如何“炼”出这个小家伙。
2. 实验原理2.1 乙烯的基本信息首先,乙烯的化学式是C₂H₄,简单得很,对吧?它其实是个气体,在常温下无色无味,闻起来也没啥特别的。
哎呀,别小看它,它可是非常重要的化工原料,简直是现代工业的“打工仔”!比如,用它来做塑料,塑料袋、塑料瓶,都是从乙烯“孵化”出来的。
2.2 制取方法那么,咱们怎么才能在实验室里制造乙烯呢?方法其实挺简单的,主要是通过“脱氢”反应。
比如说,我们可以用乙醇(对,没错,就是咱们常喝的酒精)作为原料,经过一系列的化学反应,最终就能得到乙烯。
想象一下,乙醇在高温下被加热,就像在蒸锅里“蒸”出乙烯一样,瞬间气泡四溅,哇,真是太神奇了!3. 实验步骤3.1 准备材料要开始这个实验,我们需要准备一些材料。
首先,得有乙醇,这可是咱们的主角。
其次,咱还需要一些催化剂,常用的有铝氧化物或者铂,当然,别忘了还要一些管子和烧瓶。
想象一下,你就像是个大厨,要准备好所有的“食材”,才能做出美味的“化学菜”!3.2 实验过程好了,准备工作做好后,咱就可以开始了。
首先,把乙醇倒进烧瓶里,接着加上催化剂,然后把烧瓶放在加热装置上。
接下来,火一开,温度一升高,哎呀,这气体就开始冒出来了,乙烯就这样“翩翩而至”。
一股浓浓的乙烯气体弥漫开来,简直让人陶醉!注意哦,实验的时候要小心,不然乙烯可不是好惹的,它可是个易燃气体呢,像个小火苗一样。
4. 实验总结4.1 收获与感悟实验结束后,咱们可以收集到乙烯,这时候心里那种成就感,简直就像是拿到了金牌!每当我看到那些塑料制品,心里总是忍不住想,这里面也许就有我亲手制造的乙烯呢,嘿嘿,真是自豪啊!通过这个实验,我不仅学到了制取乙烯的知识,还感受到了化学的魅力。
第1篇一、实验目的1. 了解乙烯的实验室制取原理和方法。
2. 掌握实验操作步骤,包括实验装置的组装、实验现象的观察和实验结果的记录。
3. 掌握乙烯的物理性质和化学性质,并能进行简单的性质检验。
二、实验原理乙烯是一种无色、稍有气味的气体,在常温下难溶于水,易溶于有机溶剂。
乙烯可以通过乙醇与浓硫酸的消去反应制取。
在170℃的条件下,乙醇在浓硫酸的催化作用下,发生消去反应生成乙烯和水。
反应方程式如下:CH3CH2OH → CH2=CH2 + H2O三、实验仪器与药品1. 仪器:酒精灯、圆底烧瓶、温度计、双孔橡胶塞、碎瓷片、铁架台、集气瓶、导管、酒精灯、烧杯、玻璃棒等。
2. 药品:乙醇、浓硫酸、NaOH溶液、溴水、高锰酸钾溶液等。
四、实验步骤1. 实验装置组装:将圆底烧瓶、温度计、双孔橡胶塞、碎瓷片等仪器组装成液液加热气体型装置。
2. 反应液配制:在圆底烧瓶中加入乙醇,然后慢慢加入浓硫酸,注意防止溅出。
将混合液加热至170℃。
3. 实验现象观察:在加热过程中,观察反应液的颜色变化、气体生成情况等。
4. 乙烯收集:将集气瓶倒置,通过导管将生成的乙烯气体收集在集气瓶中。
5. 乙烯性质检验:a. 物理性质检验:观察乙烯的颜色、气味、溶解性、密度等。
b. 化学性质检验:1) 氧化反应:将收集到的乙烯气体点燃,观察火焰颜色和烟雾情况。
2) 加成反应:将乙烯气体通入溴水中,观察溴水褪色情况。
3) 氧化还原反应:将乙烯气体通入酸性高锰酸钾溶液中,观察溶液颜色变化。
五、实验结果与分析1. 实验现象:a. 加热过程中,反应液颜色逐渐变深,出现少量气泡。
b. 随着反应进行,气泡逐渐增多,颜色加深。
c. 气体收集过程中,集气瓶内压力逐渐增大,气体呈无色,稍有气味。
d. 点燃乙烯气体,火焰明亮,伴有黑烟。
e. 将乙烯气体通入溴水中,溴水褪色。
f. 将乙烯气体通入酸性高锰酸钾溶液中,溶液颜色变浅。
2. 实验结果分析:a. 乙醇与浓硫酸在170℃条件下发生消去反应,生成乙烯和水。