一乙烯的实验室制法
- 格式:doc
- 大小:475.94 KB
- 文档页数:8
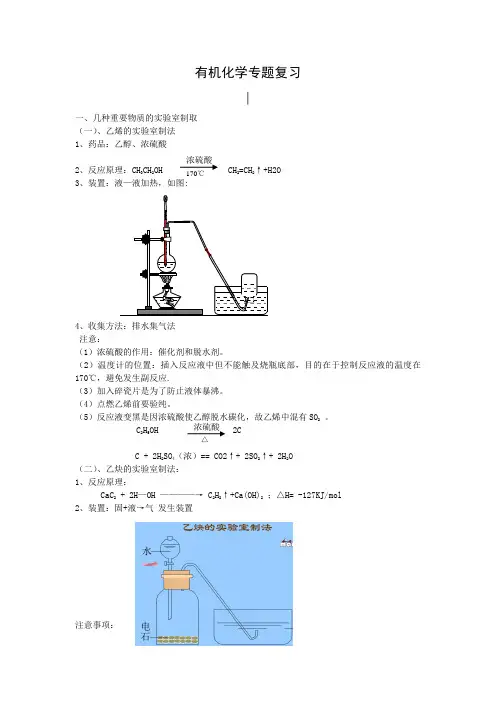
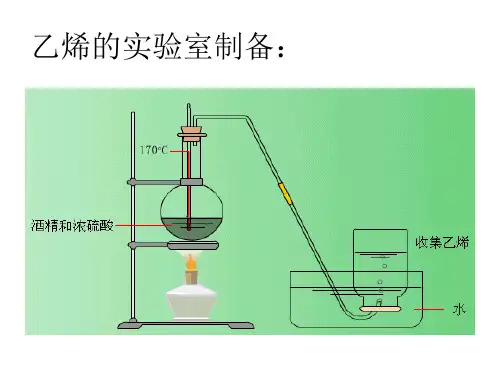
有机化学专题复习∣一、几种重要物质的实验室制取(一)、乙烯的实验室制法1、药品:乙醇、浓硫酸2、反应原理:CH 3CH 2OH CH 2=CH 2↑+H2O3、装置:液—液加热,如图:4、收集方法:排水集气法注意:(1)浓硫酸的作用:催化剂和脱水剂。
(2)温度计的位置:插入反应液中但不能触及烧瓶底部,目的在于控制反应液的温度在170℃,避免发生副反应.(3)加入碎瓷片是为了防止液体暴沸。
(4)点燃乙烯前要验纯。
(5)反应液变黑是因浓硫酸使乙醇脱水碳化,故乙烯中混有SO 2 。
C 2H 5OH 2CC + 2H 2SO 4(浓)== CO2↑+ 2SO 2↑+ 2H 2O(二)、乙炔的实验室制法:1、反应原理:CaC 2 + 2H —OH ————→ C 2H 2↑+Ca(OH)2 ;△H= -127KJ/mol2、装置:固+液→气 发生装置注意事项:浓硫酸170℃浓硫酸 △(1)反应装置不能用启普发生器,改用广口瓶和分液漏斗。
(2)实验中常用饱和食盐水代替水,目的:降低水的含量,得到平稳的乙炔气流。
(3)制取时在导气管口附近塞入少量棉花目的:为防止产生的泡沫涌入导管。
(4)纯净的乙炔气体是无色无味的气体。
用电石和水反应制取的乙炔,常闻到有恶臭气味。
(三)、苯的取代反应1、反应装置2、反应现象3、反应原理4、注意事项(1)、试剂的加入顺序怎样?各试剂在反应中所起到的作用?A 、首先加入铁粉,然后加苯,为防止溴的挥发,最后加溴。
B 、溴应是纯溴,而不是溴水。
加入铁粉起催化作用,实际上起催化作用的是FeBr3。
(2)、导管为什么要这么长?其末端为何不插入液面?C 、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
D 、导管未端不可插入锥形瓶内水面以下,因为HBr 气体易溶于水,以免倒吸。
(3)、反应后的产物是什么?如何分离?E 、导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。
F 、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。
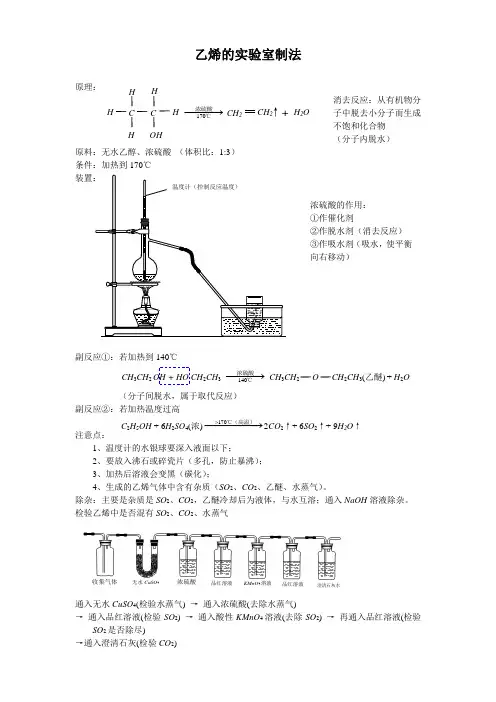
乙烯的实验室制法
原理: 消去反应:从有机物分
子中脱去小分子而生成不饱和化合物
(分子内脱水)
原料:无水乙醇、浓硫酸 (体积比:1:3)
条件:加热到170℃
副反应①:若加热到140℃
(分子间脱水,属于取代反应)
副反应②:若加热温度过高
注意点:
1、温度计的水银球要深入液面以下;
2、要放入沸石或碎瓷片(多孔,防止暴沸);
3、加热后溶液会变黑(碳化);
4、生成的乙烯气体中含有杂质(SO 2、CO 2、乙醚、水蒸气)。
除杂:主要是杂质是SO 2、CO 2,乙醚冷却后为液体,与水互溶;通入NaOH 溶液除杂。
检验乙烯中是否混有SO 2、CO 2、水蒸气
通入无水CuSO 4(检验水蒸气) → 通入浓硫酸(去除水蒸气)
→ 通入品红溶液(检验SO 2) → 通入酸性KMnO 4溶液(去除SO 2) → 再通入品红溶液(检验SO 2是否除尽)
→通入澄清石灰(检验CO 2) OH H H C C H H H 170−−−→浓硫酸℃
CH 2 CH 2 ↑+ H 2O 140−−−→浓硫酸℃CH 3CH 2 OH + HO CH 2CH 3 CH 3CH 2 O CH 2CH 3(乙醚) + H 2O C 2H 5OH + 6H 2SO 4(浓) 2CO 2↑+ 6SO 2↑+ 9H 2O ↑ 170>−−−−−→℃(高温)收集气体 浓硫酸 品红溶液 KMnO 4溶液 澄清石灰水 无水CuSO 4 品红溶液 浓硫酸的作用: ①作催化剂 ②作脱水剂(消去反应) ③作吸水剂(吸水,使平衡向右移动)。

乙烯的实验室制法1.药品:乙醇、浓硫酸2. 装置:圆底烧瓶、温度计、铁架台、双孔橡皮塞、酒精灯(实验室最好用煤气灯)、导3. 实验步骤:1)检验装置气密性。
(将导管伸入盛有水的水槽中,微微加热圆底烧瓶, 发现有气泡产生,冷却后导管内有一段水柱不下落) 2) 在烧瓶里注入乙醇和浓硫(体积比 1:3)的混合液约20mL (配置此混合液应在冷却和搅拌下缓缓将15mL 浓硫酸倒入5mL 酒精中,由于浓硫酸稀释时会放出大量的热,为了 防止乙醇受热挥发,可以待冷却后分批将浓硫酸注入),并放入几片碎瓷片。
(温度计 的水银球要伸入液面以下)3) 加热(圆底烧瓶下垫石棉网),使温度迅速升到 170 C,酒精便脱水变成乙烯。
(由于会有副反应发生,会产生 C02、SO 2等杂质气体,所以最好先将制得的气体通入10% NaOH 溶液除杂)4) 生成的乙烯通入酸性高锰酸钾溶液中,观察现象。
(正常的实验现象是紫红色褪去)5) 先撤导管,后熄灯。
(防止水倒吸使仪器破裂)4.反应原理:CH 3CH 2OH -」- CH 2= CH 2 T+ H 2O (分子内脱水,消去反应) 5. 收集气体方法(万一考理论):排水法收集(注:乙烯难溶于水,不能用排空气法,因 为乙烯的式量为28,与空气式量29接近)6. 实验现象:圆底烧瓶中溶液变黑(变黑是由于乙醇氧化生成C ,具体见后面);气体使酸性高锰酸钾溶液褪色。
7. 实验中需要注意的点:1)乙醇和浓硫酸体积比为什么是1:3 ?答:浓H2SO4在此反应中作催化剂与脱水剂的作用,浓H2SO4过量是为了促进反应向正方向进行,如果浓硫酸的量少就会很快变为稀硫酸而达不到实验效果。
2)浓硫酸在反应中的作用?答:①催化剂②脱水剂(③吸水剂)3)为什么要迅速升温到170C?答:如果低于170 C会有很多的副反应发生。
如:分子之间的脱水反应(生成乙醚)4)为什么要加入碎瓷片?答:因为反应液的温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,在反应混合液中加一些碎瓷片是为了防止暴沸,避免意外。


高中有机化学实验:乙烯乙烯的性质实验(必修2、P59)1.现象:乙烯使KMnO4酸性溶液褪色(氧化反应)(检验)乙烯使溴的四氯化碳溶液褪色(加成反应)(检验、除杂)2.乙烯的实验室制法:(1)反应原料:乙醇、浓硫酸(2)反应原理:CH3CH2OH CH2=CH2↑ + H2O副反应:2CH3CH2OH CH3CH2OCH2CH3 + H2OC2H5OH + 6H2SO4(浓)6SO2↑+ 2CO2↑+ 9H2O(3)浓硫酸:催化剂和脱水剂(混合时即将浓硫酸沿容器内壁慢慢倒入已盛在容器内的无水酒精中,并用玻璃棒不断搅拌)(4)碎瓷片,以防液体受热时爆沸;石棉网加热,以防烧瓶炸裂。
(5)实验中要通过加热使无水酒精和浓硫酸混合物的温度迅速上升到并稳定于170℃左右。
(不能用水浴)(6)温度计要选用量程在200℃~300℃之间的为宜。
温度计的水银球要置于反应物的中央位置,因为需要测量的是反应物的温度。
(7)实验结束时,要先将导气管从水中取出,再熄灭酒精灯,反之,会导致水被倒吸。
【记】倒着想,要想不被倒吸就要把水中的导管先拿出来(8)乙烯的收集方法能不能用排空气法:不能,会爆炸(9)点燃乙烯前要_验纯_。
(10)在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等(因此试管中液体变黑),而硫酸本身被还原成SO2。
故乙烯中混有_SO2_、__ CO2__。
可将气体通过碱石灰。
(11)必须注意乙醇和浓硫酸的比例为1:3,且需要的量不要太多,否则反应物升温太慢,副反应较多,从而影响了乙烯的产率。
使用过量的浓硫酸可提高乙醇的利用率,增加乙烯的产量。
(12)实验室制乙烯口诀硫酸酒精三比一。
迅速升温一百七,为防暴沸加碎瓷,排水方法集乙烯【2013新课标I卷26】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:OH浓HSO42+ H2O△可能用到的有关数据如下:相对分子质量密度/(g·cm-3)沸点/℃溶解性环己醇1000.9618161微溶于水环己烯820.810283难溶于水合成反应:在a开始缓慢加热a,控制馏出物的温度不超过90℃。

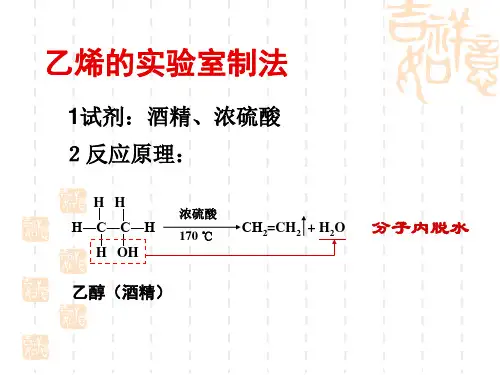
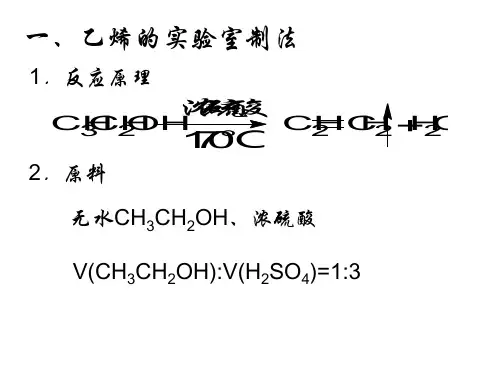
乙烯的实验室制法1。
药品:乙醇浓硫酸2. 装置:圆底烧瓶、温度计、铁架台、水槽、集气瓶、双孔橡皮塞、酒精灯、导管3.步骤:(1)检验气密性。
在烧瓶里注入乙醇和浓硫酸(体积比1:3)的混合液约20mL(配置此混合液应在冷却和搅拌下将15mL浓硫酸满满倒入5mL酒精中),并放入几片碎瓷片。
(温度计的水银球要伸入液面以下)(2)加热,使温度迅速升到170℃,酒精便脱水变成乙烯。
(3)用排水集气法收集乙烯。
(4)再将气体分别通入溴水及酸性高锰酸钾溶液,观察现象。
(5)先撤导管,后熄灯.4.反应原理:(分子内的脱水反应)5。
收集气体方法:排水集气法(密度与空气相近)6.现象:溶液变黑;气体使溴水及酸性高锰酸钾溶液褪色。
7.注意点:(1)乙醇和浓硫酸体积比为什么是1:3?答:浓硫酸是强氧化剂,在此反应中氧化乙醇,如果浓硫酸的量少就会很快变为稀硫酸而达不到实验效果.(2)浓硫酸在反应中的作用?答:①催化剂②脱水剂(③吸水剂)(3)为什么要迅速升温到170℃?答:如果低于170℃会有很多的副反应发生。
如:分子之间的脱水反应(4)为什么要加入碎瓷片?答:防止溶液暴沸。
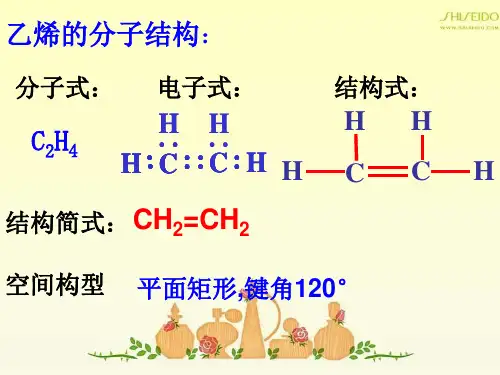
(5)为什么反应过程中溶液逐渐变黑?答:①(乙醇+浓硫酸)②(c+浓硫酸)(6)怎样证明生成气体乙烯中混有二氧化硫气体?怎样除去二氧化硫气体?答:①证明用品红溶液②除去用NaOH溶液+品红溶液(二氧化硫使溴水及酸性高锰酸钾溶液方程式)实验室制取乙烯的几个为什么河北省宣化县第一中学栾春武一、为什么温度计必须插入液面下?实验室制取乙烯的反应原理:CH3-CH2-OH CH2=CH2↑+H2O,温度要迅速上升到170℃,防止140℃时生成副产物乙醚,因为:CH3-CH2-OH+HO-CH2-CH3CH3-CH2-O-CH2-CH3+H2O。
该反应属于“液体+液体生成气体型”反应,两种液体混合后,装于圆底烧瓶中,加热要用到酒精灯,只有当温度计插入液面下,但不能接触瓶底,才能准确测出反应时反应液的温度,避免副反应的发生,确保产物的纯度。

乙烯的实验室制法1.药品: 乙醇、浓硫酸2.装置:圆底烧瓶、温度计、铁架台、双孔橡皮塞、酒精灯(实验室最好用煤气灯)、导管3.实验步骤:1)检验装置气密性。
(将导管伸入盛有水的水槽中,微微加热圆底烧瓶,发现有气泡产生,冷却后导管内有一段水柱不下落)2)在烧瓶里注入乙醇和浓硫(体积比1:3)的混合液约20mL(配置此混合液应在冷却和搅拌下缓缓将15mL浓硫酸倒入5mL酒精中,由于浓硫酸稀释时会放出大量的热,为了防止乙醇受热挥发,可以待冷却后分批将浓硫酸注入),并放入几片碎瓷片.(温度计的水银球要伸入液面以下)3)加热(圆底烧瓶下垫石棉网),使温度迅速升到170℃,酒精便脱水变成乙烯。
(由于会有副反应发生,会产生CO2、SO2等杂质气体,所以最好先将制得的气体通入10%NaOH 溶液除杂)4)生成的乙烯通入酸性高锰酸钾溶液中,观察现象。
(正常的实验现象是紫红色褪去)5)先撤导管,后熄灯.(防止水倒吸使仪器破裂)4.反应原理:CH3CH2OH CH2=CH2↑+H2O(分子内脱水,消去反应)5.收集气体方法(万一考理论):排水法收集(注:乙烯难溶于水,不能用排空气法,因为乙烯的式量为28,与空气式量29接近)6.实验现象:圆底烧瓶中溶液变黑(变黑是由于乙醇氧化生成C,具体见后面);气体使酸性高锰酸钾溶液褪色.7.实验中需要注意的点:1)乙醇和浓硫酸体积比为什么是1:3?答:浓H2SO4在此反应中作催化剂与脱水剂的作用,浓H2SO4过量是为了促进反应向正方向进行,如果浓硫酸的量少就会很快变为稀硫酸而达不到实验效果。
2)浓硫酸在反应中的作用?答:①催化剂②脱水剂(③吸水剂)3)为什么要迅速升温到170℃?答:如果低于170℃会有很多的副反应发生。
如:分子之间的脱水反应(生成乙醚)4)为什么要加入碎瓷片?答:因为反应液的温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,在反应混合液中加一些碎瓷片是为了防止暴沸,避免意外。
有机化学专题复习∣一、几种重要物质的实验室制取(一)、乙烯的实验室制法1、药品:乙醇、浓硫酸浓硫酸+H2O =CHCHOH ↑ CH2、反应原理:CH 170℃2322: 3、
装置:液—液加热,如图
4、收集方法:排水集气法注意:(1)浓硫酸的作用:催化剂和脱水剂。
)温度计的位置:插入反应液中但不能触及烧瓶底部,目的在于控制反应液的温度在(2.
170℃,避免发生副反应 3)加入碎瓷片是为了防止液体暴沸。
( 4)点燃乙烯前要验纯。
(。
(5)反应液变黑是因浓硫酸使乙醇脱水碳化,故乙烯中混有SO2浓硫酸OH 2C HC52△
C + 2HSO(浓)== CO2↑+ 2SO↑+ 2HO
、乙炔的实验室制法:
2224(二)
1、反应原理:
CaC + 2H—OH ————→ CH↑+Ca(OH) ;△H= -127KJ/mol 22222、装置:固+液→气发生装置
注意事项:
1)反应装置不能用启普发生器,改用广口瓶和分液漏斗。
( 2)实验中常用饱和食盐水代替水,(目的:降低水的含量,得到平稳的乙炔气流。
)制取时在导气管口附近塞入少量棉花(3 目的:为防止产生的泡沫涌入导管。
)纯净的乙炔气体是无色无味的气体。
(4 用电石和水反应制取的乙炔,常闻到有恶臭气味。
、苯的取代反应(三)、反应装置1
、反应现象2 、反应原理3
4、注意事项(1)、试剂的加入顺序怎样?各试剂在反应中所起到的作用? A、首先加入铁粉,然后加苯,为防止溴的挥发,最后加溴。
、溴应是纯溴,而不是溴水。
加入铁粉起催化作用,实际上起催化作用的是FeBr3。
B )、导管为什么要这么长?其末端为何不插入液面?(2 C、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
气体易溶于水,以免倒吸。
D、导管未端不可插入锥形瓶内水面以下,因为HBr 、反应后的产物是什么?如何分离?(3) E、导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。
烧杯底部是油状的褐、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,F溶液,振荡,再用分液色液体,这是因为溴苯溶有溴的缘故。
除去溴苯中的溴可加入NaOH 漏斗分离。
、实验室制备硝基苯(四)(1)药品的选用)反应原理(包括主反应和副反应)(2 )装置特点3
(.
(4)实验现象
(5)产品的分离与提纯
(6)实验的注意事项
二、重要的小实验
1.几种代表物的燃烧
(1)燃烧时的注意事项
(2)燃烧现象的比较与解释
(3)定性确定元素组成
(4)定量确定元素的质量组成
(5)烃类燃烧的计算
2.有关褪色的实验
(1)因化学反应而使溴水或溴的四氯化碳溶液褪色的物质
①发生加成反应导致褪色的烃类
②发生氧化还原反应导致褪色的无机物
③发生反应但不褪色的化合物
(2)因萃取而使溴水褪色的烃类
(3)能使酸性高锰酸钾溶液褪色的物质
①不饱和烃中的碳碳双键、碳碳叁键被氧化
②芳香烃中的侧链被氧化
③无机物被氧化
3.除杂与提纯
(1)除去CH2=CH2中的SO2
(2)除去CH≡CH中的H2S
(3)除去溴苯中的单质溴
(4)除去乙烷中的乙烯
(5)除去苯中的甲苯
(6)除去硝基苯中的硝酸
4.鉴别
(1)鉴别乙烷和乙烯
(2)鉴别乙烯和乙炔
(3)鉴别己烷和己烯
(4)鉴别己烯和苯
(5)鉴别苯和甲苯
)鉴别直馏汽油和裂化汽油6(.
三、模拟工业化工原理
1.石油的分馏
(1)工业原理
(2)工业设备
(3)工业产品
(4)模拟装置
(5)实验现象
2.石蜡的催化裂化(1)工业原理 2)工业设备( 3)工业产品()模拟装置(4 )实验现象(5
3.煤的干馏 1()工业原理 2()工业设备)工业产品3(.
(4)模拟装置
(5)实验现象
四、实验小结
1.温度计:
使用了温度计的实验
①实验室制乙烯
②实验室制硝基苯
③实验室制苯磺酸
④石油的分馏
⑤溶解度的测定
⑥乙酸乙酯的水解
温度计的位置与作用
①实验室制乙烯:液面以下——测定并控制反应混合液的温度
②实验室制硝基苯:水浴的水中——测定并控制水浴的温度
③实验室制苯磺酸:水浴的水中——测定并控制水浴的温度
④石油的分馏:蒸馏烧瓶的支管处——测定蒸气的温度,控制各种馏分的沸点范围
⑤溶解度的测定:溶液之中——测定饱和溶液的温度
⑥乙酸乙酯的水解:水浴的水中——测定并控制水浴的温度
2.使用了冷凝管的实验
①实验室制溴苯:空气冷凝管
②实验室制硝基苯:空气冷凝管
③实验室制苯磺酸:空气冷凝管
④石油的分馏:一般的冷凝管
⑤实验室制酚醛树脂:空气冷凝管
⑥乙酸乙酯的水解:空气冷凝管
3.四种加热的方式
(1)直接加热——石蜡的催化裂化
(2)喷灯加热——木材的干馏、煤的干馏
(3)隔着石棉网加热——实验室制乙烯、石油的分馏
(4)水浴加热——实验室制硝基苯、苯磺酸、酚醛树脂、银镜反应、乙酸乙酯制取、蔗糖水解、纤维素水解
4.需要水浴加热的有机实验
①实验室制硝基苯50℃~60℃
②实验室制苯磺酸70℃~80℃
③银镜反应(热水浴)
④实验室制酚醛树脂(沸水浴)
⑤乙酸乙酯的水解70℃~80℃
)
热水浴(⑥蔗糖的水解.。