乙烯的实验室制备
- 格式:ppt
- 大小:591.00 KB
- 文档页数:19
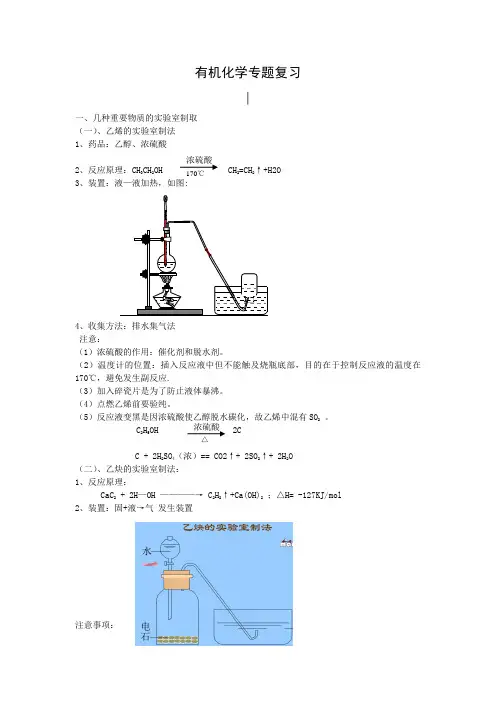
有机化学专题复习∣一、几种重要物质的实验室制取(一)、乙烯的实验室制法1、药品:乙醇、浓硫酸2、反应原理:CH 3CH 2OH CH 2=CH 2↑+H2O3、装置:液—液加热,如图:4、收集方法:排水集气法注意:(1)浓硫酸的作用:催化剂和脱水剂。
(2)温度计的位置:插入反应液中但不能触及烧瓶底部,目的在于控制反应液的温度在170℃,避免发生副反应.(3)加入碎瓷片是为了防止液体暴沸。
(4)点燃乙烯前要验纯。
(5)反应液变黑是因浓硫酸使乙醇脱水碳化,故乙烯中混有SO 2 。
C 2H 5OH 2CC + 2H 2SO 4(浓)== CO2↑+ 2SO 2↑+ 2H 2O(二)、乙炔的实验室制法:1、反应原理:CaC 2 + 2H —OH ————→ C 2H 2↑+Ca(OH)2 ;△H= -127KJ/mol2、装置:固+液→气 发生装置注意事项:浓硫酸170℃浓硫酸 △(1)反应装置不能用启普发生器,改用广口瓶和分液漏斗。
(2)实验中常用饱和食盐水代替水,目的:降低水的含量,得到平稳的乙炔气流。
(3)制取时在导气管口附近塞入少量棉花目的:为防止产生的泡沫涌入导管。
(4)纯净的乙炔气体是无色无味的气体。
用电石和水反应制取的乙炔,常闻到有恶臭气味。
(三)、苯的取代反应1、反应装置2、反应现象3、反应原理4、注意事项(1)、试剂的加入顺序怎样?各试剂在反应中所起到的作用?A 、首先加入铁粉,然后加苯,为防止溴的挥发,最后加溴。
B 、溴应是纯溴,而不是溴水。
加入铁粉起催化作用,实际上起催化作用的是FeBr3。
(2)、导管为什么要这么长?其末端为何不插入液面?C 、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
D 、导管未端不可插入锥形瓶内水面以下,因为HBr 气体易溶于水,以免倒吸。
(3)、反应后的产物是什么?如何分离?E 、导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。
F 、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。

高中化学知识点:乙烯的制取
高中化学知识点:乙烯的制取
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。
浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6OCH2=CH2↑+H2O
(2)装置图:
(3)注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。
装置连接时由下至上,由左至右。
温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内
的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。
制得的C2H4中往往混有等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有等多种物质。
相关反应方程式为:。

乙烯的制备实验步骤一、引言乙烯是一种重要的有机化合物,广泛用于化学工业中的各种合成反应和聚合反应中。
本文将介绍乙烯的制备实验步骤。
二、实验原理乙烯可以通过蒸馏法从石油裂解气中分离得到。
在实验室中,可以通过酸催化剂催化酒精脱水反应制备乙烯。
三、实验步骤1. 实验器材准备准备好以下器材:250 mL圆底烧瓶、冷凝管、滴液漏斗、橡皮塞和夹子等。
2. 实验药品准备准备好以下药品:浓硫酸、95%无水乙醇。
3. 实验操作步骤(1)向250 mL圆底烧瓶中加入50 mL 95%无水乙醇。
(2)向圆底烧瓶中加入10 mL浓硫酸,轻轻摇晃使其充分混合。
(3)将冷凝管插入圆底烧瓶的橡皮塞上,并用夹子固定住。
(4)将圆底烧瓶放在加热板上,加热至沸腾。
(5)当乙醇完全脱水后,会产生大量气体,通过冷凝管收集气体。
四、实验注意事项1. 实验过程中要注意安全,避免接触浓硫酸。
2. 实验器材和药品要干净、干燥。
3. 在操作过程中要小心谨慎,避免发生意外事故。
五、实验结果分析通过实验可以制备出一定量的乙烯气体。
可以通过对收集到的气体进行分析,确定乙烯的纯度和产量。
六、实验拓展1. 可以改变反应条件,如温度、反应时间等参数,探究其对乙烯产量和纯度的影响。
2. 可以使用其他催化剂进行酒精脱水反应,比较不同催化剂对乙烯产率和纯度的影响。
3. 可以将制备出来的乙烯用于聚合反应或其他合成反应中。
七、总结本文介绍了通过酒精脱水反应制备乙烯的实验步骤和注意事项,并提出了实验拓展的建议。
通过实验可以了解乙烯的制备方法,同时也可以锻炼实验操作技能。

②(c+浓硫酸)(6)怎样证明生成气体乙烯中混有二氧化硫气体?怎样除去二氧化硫气体?答:①证明用品红溶液②除去用NaOH溶液+品红溶液(二氧化硫使溴水及酸性高锰酸钾溶液方程式)实验室制取乙烯的几个为什么河北省宣化县第一中学栾春武一、为什么温度计必须插入液面下?实验室制取乙烯的反应原理:CH3-CH2-OHCH2=CH2↑+H2O,温度要迅速上升到170℃,防止140℃时生成副产物乙醚,因为:CH3-CH2-OH+HO-CH2-CH3CH3-CH2-O-CH2-CH3+H2O。
该反应属于“液体+液体生成气体型”反应,两种液体混合后,装于圆底烧瓶中,加热要用到酒精灯,只有当温度计插入液面下,但不能接触瓶底,才能准确测出反应时反应液的温度,避免副反应的发生,确保产物的纯度。
二、为什么在圆底烧瓶中要加少量碎瓷片?因为反应液的温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,在反应混合液中加一些碎瓷片是为了防止暴沸,避免意外。
三、为什么收集乙烯用的是排水集气法?因为乙烯的密度和空气的密度相接近,而且乙烯又难溶于水,故采用该方法。
四、为什么浓硫酸与乙醇的体积比按3:1混合?因为浓H2SO4在该反应中除了起催化作用外,还起脱水作用,保持其过量的原因主要是为了使浓H2SO4保持较高的浓度,促使反应向正反应方向进行。
五、为什么制取乙烯时反应液会变黑,还会有刺激性气味产生?因为在该反应中还伴随有乙醇与浓硫酸发生的氧化还原反应:C2H5OH + 2H2SO4(浓) 2C+2SO2↑+2H2O ;C + 2H2SO4(浓) CO2↑+2SO2↑+2H2O,由于有C、SO2的生成,故反应液变黑,还有刺激性气味产生。
例题 1.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的C和SO2。
某同学设计下列实验以确定上述气体中含有C2H4和SO2。
(1)试解释装置Ⅰ中反应液变黑的原因:________。
并写出装置Ⅰ中发生反应的化学方程式__________。

乙烯的制备方法有哪些?一、直接蒸馏法通过直接蒸馏法进行乙烯的制备是一种常用的方法。
采用此法可以利用石油、天然气、煤、矿石等作为原料,通过高温蒸馏的过程,将乙烷转化成乙烯。
在蒸馏过程中,可以利用催化剂来促进反应速度,提高乙烯的产率。
二、石油裂解法石油裂解法是一种常见的乙烯制备方法。
利用此方法可以将石油中的长链烃分子分解成较短链分子,并进一步转化成乙烯。
裂解反应通常在高温和高压的条件下进行,利用催化剂可以提高反应效率和产率。
石油裂解法具有反应速度快、产率高的特点。
三、乙烯水合物法乙烯水合物法是一种利用乙烯和水直接反应生成乙醇的方法。
在此过程中,乙烯与水在特定催化剂的存在下进行氧化反应,生成乙醇。
乙烯水合物法是一种环保的制备方法,由于其通过水来制备乙烯醇,可以有效减少对环境的污染。
四、烷基化法烷基化法是一种利用乙酸酯与甲醇在催化剂的存在下反应生成乙酸甲酯,然后再将乙酸甲酯进行分解得到乙烯的方法。
烷基化法具有操作简便、产率高的特点,在工业生产中得到广泛应用。
五、乙醇脱水法乙醇脱水法是一种将乙醇脱水生成乙烯的方法。
在此过程中,乙醇经过蒸馏分离得到纯乙醇后,通过高温或催化剂的存在下进行脱水反应,生成乙烯。
乙醇脱水法是一种简便易行的制备乙烯的方法,但由于乙醇的来源有限,制备规模相对较小。
总结起来,乙烯的制备方法主要包括直接蒸馏法、石油裂解法、乙烯水合物法、烷基化法和乙醇脱水法。
这些方法各有其特点和适用范围,可以根据实际需要选择合适的方法进行乙烯的制备。
在未来,随着科学技术的不断发展,可能会出现更多的制备方法,为乙烯工业生产带来更多的选择和发展机会。

高中有机化学实验:乙烯乙烯的性质实验(必修2、P59)1.现象:乙烯使KMnO4酸性溶液褪色(氧化反应)(检验)乙烯使溴的四氯化碳溶液褪色(加成反应)(检验、除杂)2.乙烯的实验室制法:(1)反应原料:乙醇、浓硫酸(2)反应原理:CH3CH2OH CH2=CH2↑ + H2O副反应:2CH3CH2OH CH3CH2OCH2CH3 + H2OC2H5OH + 6H2SO4(浓)6SO2↑+ 2CO2↑+ 9H2O(3)浓硫酸:催化剂和脱水剂(混合时即将浓硫酸沿容器内壁慢慢倒入已盛在容器内的无水酒精中,并用玻璃棒不断搅拌)(4)碎瓷片,以防液体受热时爆沸;石棉网加热,以防烧瓶炸裂。
(5)实验中要通过加热使无水酒精和浓硫酸混合物的温度迅速上升到并稳定于170℃左右。
(不能用水浴)(6)温度计要选用量程在200℃~300℃之间的为宜。
温度计的水银球要置于反应物的中央位置,因为需要测量的是反应物的温度。
(7)实验结束时,要先将导气管从水中取出,再熄灭酒精灯,反之,会导致水被倒吸。
【记】倒着想,要想不被倒吸就要把水中的导管先拿出来(8)乙烯的收集方法能不能用排空气法:不能,会爆炸(9)点燃乙烯前要_验纯_。
(10)在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等(因此试管中液体变黑),而硫酸本身被还原成SO2。
故乙烯中混有_SO2_、__ CO2__。
可将气体通过碱石灰。
(11)必须注意乙醇和浓硫酸的比例为1:3,且需要的量不要太多,否则反应物升温太慢,副反应较多,从而影响了乙烯的产率。
使用过量的浓硫酸可提高乙醇的利用率,增加乙烯的产量。
(12)实验室制乙烯口诀硫酸酒精三比一。
迅速升温一百七,为防暴沸加碎瓷,排水方法集乙烯【2013新课标I卷26】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:OH浓HSO42+ H2O△可能用到的有关数据如下:相对分子质量密度/(g·cm-3)沸点/℃溶解性环己醇1000.9618161微溶于水环己烯820.810283难溶于水合成反应:在a开始缓慢加热a,控制馏出物的温度不超过90℃。

乙烯的制备
工业制法:工业上所用的乙烯,主要是从石油炼制工厂和石油化工厂所生产的气体里分离出来的。
实验室制法:实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。
浓硫酸在反应过程里起催化剂和脱水剂的作用。
实验室制法注意事项
(1)酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。
装置连接时由下至上,由左至右。
温度计插入液面下。
(2)烧瓶内加沸石以避免暴沸。
(3)温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
(4)要使液面温度迅速升到170摄氏度,以避免副反应发生。

化学乙烯的制备方法有哪些
乙烯的制备方法有以下几种:
1. 石油裂解法:通过加热石油馏分,使其裂解产生乙烯和其他烃类化合物。
2. 乙烯水解法:将乙烷与水加热反应,利用催化剂将乙烷转化为乙烯。
3. 乙醇脱水法:将乙醇加热至高温,去除水分,生成乙烯。
4. 乙烯烷酮法:通过乙烯与酸烷醇的酯类反应,在碱性催化剂存在下,生成相应的烷酮,并通过加热酮类产物解离生成乙烯。
5. 乙烯氯化法:将乙烷与氯气在高温条件下反应,生成1,2-二氯乙烷,再通过碱性催化剂的作用分解生成乙烯。
以上是常用的乙烯制备方法,具体使用哪种方法取决于实际生产需求和技术条件。
乙烯的实验室制法1.药品: 乙醇、浓硫酸2.装置:圆底烧瓶、温度计、铁架台、双孔橡皮塞、酒精灯(实验室最好用煤气灯)、导管3.实验步骤:1)检验装置气密性。
(将导管伸入盛有水的水槽中,微微加热圆底烧瓶,发现有气泡产生,冷却后导管内有一段水柱不下落)2)在烧瓶里注入乙醇和浓硫(体积比1:3)的混合液约20mL(配置此混合液应在冷却和搅拌下缓缓将15mL浓硫酸倒入5mL酒精中,由于浓硫酸稀释时会放出大量的热,为了防止乙醇受热挥发,可以待冷却后分批将浓硫酸注入),并放入几片碎瓷片。
(温度计的水银球要伸入液面以下)3)加热(圆底烧瓶下垫石棉网),使温度迅速升到170℃,酒精便脱水变成乙烯。
(由于会有副反应发生,会产生CO2、SO2等杂质气体,所以最好先将制得的气体通入10%NaOH溶液除杂)4)生成的乙烯通入酸性高锰酸钾溶液中,观察现象。
(正常的实验现象是紫红色褪去)5)先撤导管,后熄灯。
(防止水倒吸使仪器破裂)4.反应原理:CH3CH2OH CH2=CH2↑+H2O(分子内脱水,消去反应)5.收集气体方法(万一考理论):排水法收集(注:乙烯难溶于水,不能用排空气法,因为乙烯的式量为28,与空气式量29接近)6.实验现象:圆底烧瓶中溶液变黑(变黑是由于乙醇氧化生成C,具体见后面);气体使酸性高锰酸钾溶液褪色。
7.实验中需要注意的点:1)乙醇和浓硫酸体积比为什么是1:3?答:浓H2SO4在此反应中作催化剂与脱水剂的作用,浓H2SO4过量是为了促进反应向正方向进行,如果浓硫酸的量少就会很快变为稀硫酸而达不到实验效果。
2)浓硫酸在反应中的作用?答:①催化剂②脱水剂(③吸水剂)3)为什么要迅速升温到170℃?答:如果低于170℃会有很多的副反应发生.如:分子之间的脱水反应(生成乙醚)4)为什么要加入碎瓷片?答:因为反应液的温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,在反应混合液中加一些碎瓷片是为了防止暴沸,避免意外。
制备乙烯的反应方程式
制取乙烯的化学方程式为:CH3CH2OH→CH2=CH2+H2O。
反应条件为浓硫酸,并迅速加热至170℃,否则会生成副产物,同时要加入碎瓷片防止暴沸。
乙烯的实验室制法:
实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。
浓硫酸在反应过程里起催化剂和脱水剂的作用。
方程式为:CH3CH2OH(浓H2SO4,170℃)→CH2=CH2↑+H2O。
什么是乙烯
乙烯是由两个碳原子和四个氢原子组成的化合物。
两个碳原子之间以双键连接。
乙烯存在于植物的某些组织、器官中,是由蛋氨酸在供氧充足的条件下转化而成的。
乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。
世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。