高二化学选修4学案及例题
- 格式:pdf
- 大小:325.55 KB
- 文档页数:16
第一章化学反应与能量复习课一、焓变与反应热1.化学反应中的能量变化【思考】化学反应中的两大变化、两大守恒、能量转化形式是什么?(1)化学反应中的两大变化: 变化和变化。
(2)化学反应中的两大守恒: 守恒和守恒。
(3)化学反应中的能量转化形式: 、光能、电能等。
通常主要表现为的变化。
2.焓变【思考】焓变的定义、符号、单位是什么?(1)定义:在条件下进行的反应的。
(2)符号: 。
(3)单位: 或。
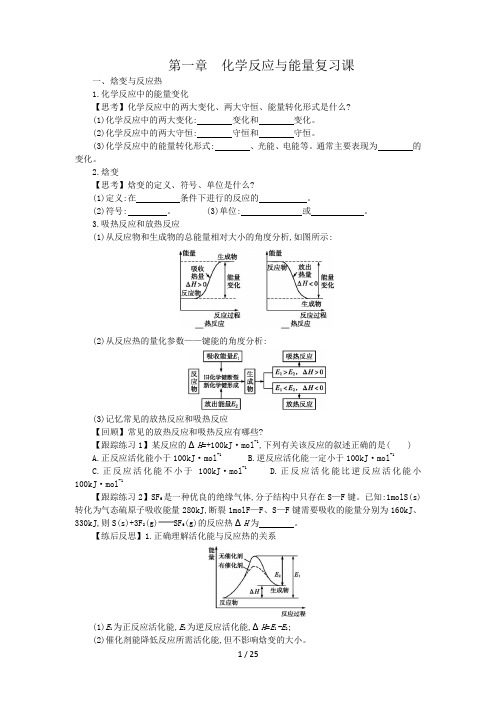
3.吸热反应和放热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示:(2)从反应热的量化参数——键能的角度分析:(3)记忆常见的放热反应和吸热反应【回顾】常见的放热反应和吸热反应有哪些?【跟踪练习1】某反应的ΔH=+100kJ·mol-1,下列有关该反应的叙述正确的是( )A.正反应活化能小于100kJ·mol-1B.逆反应活化能一定小于100kJ·mol-1C.正反应活化能不小于100kJ·mol-1D.正反应活化能比逆反应活化能小100kJ·mol-1【跟踪练习2】SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF—F、S—F键需要吸收的能量分别为160kJ、330kJ,则S(s)+3F2(g)SF6(g)的反应热ΔH为。
【练后反思】1.正确理解活化能与反应热的关系(1)E1为正反应活化能,E2为逆反应活化能,ΔH=E1-E2;(2)催化剂能降低反应所需活化能,但不影响焓变的大小。
2.熟记反应热ΔH的基本计算公式ΔH=生成物的总能量-反应物的总能量ΔH=反应物的总键能之和-生成物的总键能之和二、热化学方程式【思考】热化学方程式的概念、意义及书写时的注意事项有哪些?1.概念:表示参加反应和的关系的化学方程式。
2.意义:表明了化学反应中的变化和变化。
如:2H2(g)+O2(g)2H2O(l) ΔH=-571.6kJ·mol-1表示: 氢气和氧气反应生成液态水时放出kJ的热量。

导学案第二章化学反响速率和化学平衡第二节影响化学反响速率的因素〔第一课时〕编写人:战鹰【学习目标】1知道活化能的含义及其对化学反响速率的影响。
2.初步学会运用有效碰撞模型解释浓度、压强对化学反响速率的影响。
3.理解外界条件浓度、压强对化学反响速率的影响,认识其一般规律。
【学习重点】浓度、压强对化学反响速率的影响及微观解释【学习难点】用有效碰撞模型微观解释浓度、压强化学反响速率影响的实质【学法指导】利用课本中的数据、图片、实验等引发学生思考,把表征的现象深入到微观领域,认识影响化学反响速率的本质原因。
【知识梳理】一、有效碰撞理论〔1〕有效碰撞:能够发生的碰撞。
〔2〕能够发生有效碰撞的分子,必须具备:①;②。
有效碰撞是发生化学反响的充分条件。
(3)活化分子:能够发生的分子。
但活化分子的每一次碰撞,不一定都是有效碰撞,即发生化学反响。
〔4〕活化能:。
小结:化学反响的快慢本质上是由决定的,越多,那么化学反响速率,反之那么慢。
二、影响化学反响速率的因素1.内因〔主要因素〕2.外因〔1〕浓度【讨论与探究】【实验探究2-2】化学反响方程式:反响在其他条件不变时,增加反响物的浓度,单位体积内分子的数量,活化分子百分数,单位体积内活化分子的数量,有效碰撞的频率,导致反响速率增大。
〔2〕压强对于有气体参加的反响来说,当温度一定时,体系的压强增大〔减少容器体积〕,单位体积内分子的数量,活化分子百分数,单位体积内活化分子的数量,有效碰撞的频率,反响速率增大。
【方法总结】1、对于有气体参加的反响,压强对化学反响速率的影响实质是影响,压强的变化要引起变化,反响速率才相应的变化。
2、对于可逆反响来说,增大体系的压强,反响物和生成物的浓度,所以,正反响的速率和逆反响的速率。
3、对于没有气体参与的化学反响,由于改变压强时反响物浓度变化很小,可忽略不计,因此对化学反响速率4、对于向反响体系中,化学反响速率的影响分为以下两种情况:〔1〕恒温恒容时,充入无关气体,由于物质的浓度→反响速率。

第一章化学反应与能量知识要点:一、焓变(△H)反应热在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓差值即焓变(△H)决定。
在恒压条件下,反应的热效应等于焓变。
放热反应△H 0吸热反应△H 0焓变(△H)单位:KJ/mol二、热化学方程式定义:能表示参加反应物质的量和反应热的关系的化学方程式。
书写时应注意:1.指明反应时的温度和压强(对于25℃、101KPa时进行的反应,可以不注明)。
2.所有反应物和产物都用括号注明它们在反应时的状态。
3.各物质前的系数指实际参加反应的物质的量,可以是整数也可以是分数。
4.△H单位KJ/mol中每摩尔指的是每摩尔反应体系,非每摩尔某物质,其大小与反应物的物质的量成正比。
5.对于可逆反应中的△H指的是正向完全进行时的焓变。
三、燃烧热定义:25℃、101KPa时,1mol纯物质完全燃烧生成稳定化合物时所放出的热量,叫做该物质的燃烧热。
单位:KJ/mol注意点:1.测定条件:25℃、101KPa,非标况。
2.量:纯物质1mol3.最终生成稳定的化合物。
如C→CO2,H→H2O(l)书写燃烧热化学方程式应以燃烧1mol纯物质为标准来配平其余物质的化学计量数。
四、中和热定义:在稀溶液中,酸与碱发生中和反应生成1mol H2O时所释放的热量称为中和热。
强酸与强碱反应生成可溶性盐的热化学方程式为:H+(aq)+ OH- (aq) == H2O(l) △H= -57.3KJ/mol实验:中和热的测定见课本第4~5页思考:1.环形玻璃棒的作用2.烧杯间填满碎泡沫塑料的作用3.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”)五、化学反应热的计算盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
即化学反应的反应热只与反应体系的始态和终态有关,而与反应途径无关。
假设反应体系的始态为S,终态为L,若S→L,△H﹤0;则L→S,△H﹥0。

最新整理高二化学教学高二化学选修4第一章学案(含答案)第二节燃烧热能源班别姓名序号评分一、具体内容(一)燃烧热1.概念2.注意事项3.表示意义4.有关燃烧热的计算(二)能源1.能源2.能源的分类3.解决能源危机的方法4.如何提高煤的燃烧效率二、过关作业(请将选择题的答案写在后面的答题表中)1.下列说法中不正确的是()A.化石燃料在任何条件下都能充分燃烧B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体C.直接燃烧煤不如将煤进行深加工后再燃烧的效果好D.固体煤变为气体燃料后,燃烧效率将提高2.(双项)下列叙述正确的是()A.电能是二级能源B.水力是二级能源[C.天然气是一级能源D.水煤气是一级能源3.下列叙述中正确的是()A.在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热B.在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热C.热化学方程式中,各物质前的化学计量数不表示分子个数D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应4.已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量②1molCl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量下列叙述正确的是A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)B.氢气和氯气反应生成2mol氯化氢气体,反应的H=183kJ/mol C.氢气和氯气反应生成2mol氯化氢气体,反应的H=-183kJ/mol D.氢气和氯气反应生成1mol氯化氢气体,反应的H=-183kJ/mol5.下列关于热化学反应的描述中正确的是()A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/molB.CO(g)的燃烧热是-283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=2×283.0kJ/molC.需要加热才能发生的反应一定是吸热反应D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热6.2008年9月25日,“神州七号”载人飞船成功升空,实现了华夏民族千百年来的航天梦。

第二章化学反应速率和化学平衡第二节影响化学反应速率的因素第2课时温度、催化剂对化学反应速率的影响学习目标1.理解温度、催化剂对化学反应速率的影响。
2.能初步运用有效碰撞理论和活化分子等知识来解释温度、催化剂等条件对化学反应速率的影响。
学习过程探究三:温度对化学反应速率的影响【分组实验】10mL同浓度的Na2S2O3溶液分别在不同温度下与10mL0.1mol·L-1的H2SO4溶液反应的对比实验。
【实验结论】实验证明,在其他条件相同时,升高温度,反应速率会,降低温度,反应速率会。
【小结】当反应物浓度一定时,分子总数一定,升高温度,反应物分子的能量,活化分子的百分比,因而活化分子数量,有效碰撞频率,所以,反应速率。
【跟踪练习1】硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是()探究四:催化剂对化学反应速率的影响【分组实验】过氧化氢分解的对比实验。
【实验结论】使用催化剂,能化学反应。
【小结】当温度和反应物浓度一定时,使用催化剂可使反应途径发生改变,从而了反应的活化能,使得活化分子的百分比,因此活化分子的数目,有效碰撞频率,故化学反应速率。
【跟踪练习2】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列顺序正确的是()甲:在500℃时,SO2和O2各10mol反应乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2起反应丙:在450℃时,8mol SO2和5mol O2反应丁:在500℃时,8mol SO2和5mol O2反应A.甲、乙、丙、丁B.乙、甲、丙、丁C.乙、甲、丁、丙D.丁、丙、乙、甲【总结】随堂检测1.在C(s)+CO2(g)2CO(g)反应中,可使化学反应速率增大的措施是()①增大压强②升高温度③通入CO2④增加C的质量⑤降低压强A.①②③④B.②③④⑤C.①②③D.②③④2.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是()①增大反应物的浓度②升高温度③增大压强④移动生成物⑤加入催化剂A.①③⑤B.②⑤C.②③⑤D.①③④3.在C(s)+CO2(g)2CO(g)的反应中。

第二节燃烧热能源学习目标]1.理解燃烧热的概念。
2.了解化学在解决能源危机中的重要作用,知道节约能源、提高能量利用率的实际意义。
基础知识]一、燃烧热1、燃烧热(1)概念:在101kPa时,mol纯物质燃烧生成的氧化物时所的热量。
(2)要点:①研究条件:25℃ ,101 kPa②反应程度:完全燃烧,产物是________________。
③燃烧物的物质的量:mol。
④研究内容:的热量。
(ΔH<0,单位kJ/mol)⑤燃烧热通常可利用仪器由实验测得的⑥在未有特别说明的情况下,外界压强一般指101 kPa。
所谓完全燃烧也是完全氧化,它是指物质中的下列元素完全转变成对应的稳定的氧化物。
如: C→、S→、H→、P(s)→P2O5 (s)。
【思考1】已知:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036kJ/mol①C8H18的燃烧热是多少? _____________________②1mol C8H18燃烧时放出了多少热? _______________2、燃烧热与中和热的区别与联系例1A.1 mol物质燃烧所放出的热量B.常温下,可燃物燃烧放出的热量C.在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量D.燃烧热随化学方程式前的化学计量数的改变而改变答案 C例2.以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是()A.C(s)+12O2(g)===CO (g)ΔH=+110.5 kJ·mol-1B.C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1D.H2(g)+12O2(g)===H2O(g)ΔH=-241.8 kJ·mol-1答案 B二、能源1.能源是能提供能量的资源,它包括化石燃料 (煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。

(人教版)化学高中选修4(全册)精品同步学案汇总第一节原电池【今日目标】1.通过实验体验由化学能转为电能的探究。
2.掌握原电池的工作原理。
3.能正确书写电极反应和电池反应方程式。
【学习过程】一、原电池1.原理(以铜、锌原电池为例)原电池是利用氧化还原反应原理将化学能转化为电能的装置。
装置举例2.电极反应锌片负极,发生氧化反应电极反应式:Zn-2e-===Zn2+铜片正极,发生还原反应电极反应式:Cu2++2e-===Cu总电极反应式为:Cu2++Zn===Cu+Zn2+3.构成条件条件两个活泼性不同的电极,较活泼的做负极。
电解质溶液形成闭合回路能自发地发生氧化还原反应4.原电池的设计(1).用还原性较强的物质作负极,向外电路提供电子;用氧化性较强的物质作正极,从外电路得到电子。
(2).将两极浸在电解质溶液中,通过阴、阳离子的定向移动形成内电路。
(3).放电时负极上的电子通过导线流向正极,再通过溶液中离子移动形成的内电路构成闭合回路。
【思考】1. (1)原电池的两电极必须是金属吗?【提示】不一定,如可用石墨做电极。
(2)Cu与稀H2SO4能否设计成原电池?【提示】不能。
Cu与稀H2SO4不能自发发生氧化还原反应。
2.在内电路中,阴、阳离子分别向哪个极板移动?【提示】阴离子→负极,阳离子→正极。
3.①原电池中,电子流出的极是正极还是负极?【提示】负极。
②若某电极在反应过程中增重,是原电池的正极还是负极?【提示】正极。
【总结】1.由组成原电池的两极材料判断较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流向判断外电路中,电流由正极流向负极,电子由负极流向正极。
3.根据原电池电解质溶液中离子的移动方向判断在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
4.根据原电池中两极发生的反应判断原电池中,负极总是发生氧化反应,正极总是发生还原反应。
若给出一个总方程式,则可根据化合价升降来判断。

第四章电化学基础第三节电解池第2课时电解原理的应用学习目标1.了解电解反应的一般规律。
2.了解氯碱工业、电镀、电冶金、电解精炼铜的原理。
复习回顾1.电解池的构成条件?2.水溶液中离子的放电顺序?3.分析书写电解池电极反应的一般思路?课堂探究【交流研讨】以石墨为电极电解下列溶液,请写出电极反应式及总反应的化学方程式。
(1)CuCl2溶液:。
(2)NaCl溶液:。
(3)CuSO4溶液:。
(4)Na2SO4溶液:。
思考:通过对以上电解过程的分析,你发现了什么规律?CuCl2Cu+Cl2↑2NaCl+2H2O H2↑+Cl2↑+2NaOH2CuSO4+2H2O2Cu+O2↑+2H2SO42H2O2H2↑+O2↑一、电解规律试完成下表:二、电解原理的应用1.氯碱工业习惯上把电解饱和食盐水的工业叫做氯碱工业。
(1)在NaCl溶液中,NaCl电离出,H2O电离出。
通电后,在电场的作用下,向阴极移动,向阳极移动。
在阳极,由于容易失去电子,被氧化生成。
阳极反应:。
在阴极,由于容易得到电子被还原生成,使H2O电离平衡向右移动,因此阴极浓度增大,pH。
阴极反应:。
由此,你能得出什么结论?(2)电解前向溶液中滴加酚酞,通电后现象是什么?(3)两极极板上都有气体产生,如何检验两种气体?(4)在氯碱工业中需要注意哪些问题?怎么解决?2.铜的电解精炼已知粗铜中含有Zn、Fe、Ni、Ag、Au等杂质,试讨论如何通过电解的方法将粗铜提纯。
阴、阳极上分别发生什么反应?3.电镀应用电解原理在某些金属表面镀上一层其他金属或合金的过程。
(1)试讨论如何通过电解的方法在金属铁上镀铜,阴、阳极上分别发生什么反应。
(2)试分析在粗铜精炼和在金属铁上镀铜的过程中,电解液的成分变化是否相同。
4.电冶金电解饱和NaCl溶液能否得到金属钠?如何能通过电解的方法得到金属钠?你能得出什么结论?随堂检测1.在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是()A.都是轻金属B.都是活泼金属C.成本低廉D.这些金属的化合物熔点较低2.火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。

第一章 化学反应与能量 第三节 反应热的计算第一课时练习题:〖课前练习1〗298K ,101KPa 时,将1 g 钠与足量的氯气反应,生成氯化钠晶体并放出 18 KJ 的热量,求生成1mol 氯化钠的反应热?〖课前练习2〗乙醇的燃烧热是△H=-1367KJ/mol ,在此温度下,46Kg 乙醇充分燃烧后放出多少热量?思考题:如何测出这个反应的反应热:C(s)+1/2O 2(g)==CO(g)①C(s)+1/2O 2(g)==CO(g) ΔH 1=?②CO(g)+1/2O 2(g)== CO 2(g) ΔH 2=-283.0kJ/mol ③C(s)+O 2(g)==CO 2(g) ΔH 3=-393.5kJ/mol1、盖斯定律:内容:1840年,瑞典化学家盖斯通过大量实验证明:不管化学反应是_______完成或 __________完成,其反应热是_______的。
也就是说,化学反应的反应热只与反应体系的 _____和______有关而与反应的途径无关。
(2)对盖斯定律的理解:①________________________________________________________________, ②________________________________________________________________,2、能量的释放或吸收是以发生变化的________为基础的,二者密不可分,但以___为主。
3、计算的步骤:找出能量守恒的等量的关系△H 1、△H 2、△H 3 三种之间的关系如何?计算的步骤?1、【例1】如何测出这个反应的反应热:C(s)+1/2O 2(g)==CO(g)①C(s)+1/2O 2(g)==CO(g) ΔH 1=?②CO(g)+1/2O 2(g)== CO 2(g) ΔH 2=-283.0kJ/mol ③C(s)+O 2(g)==CO 2(g) ΔH 3=-393.5kJ/mol方法1:以盖斯定律原理求解, 以要求的反应为基准(1) 找起点C(s), (2) 终点是CO(g),(3) 总共经历了两个反应C →CO ; C →CO 2→CO(4) 也就说C →CO 的焓变为C →CO 2;CO 2→CO 之和。

第一章 化学反应与能量复习课一、焓变与反应热1.化学反应中的能量变化【思考】化学反应中的两大变化、两大守恒、能量转化形式是什么? (1)化学反应中的两大变化: 变化和 变化。
(2)化学反应中的两大守恒: 守恒和 守恒。
(3)化学反应中的能量转化形式: 、光能、电能等。
通常主要表现为 的变化。
2.焓变【思考】焓变的定义、符号、单位是什么?(1)定义:在 条件下进行的反应的 。
(2)符号: 。
(3)单位: 或 。
3.吸热反应和放热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示:(2)从反应热的量化参数——键能的角度分析:(3)记忆常见的放热反应和吸热反应【回顾】常见的放热反应和吸热反应有哪些?【跟踪练习1】某反应的ΔH =+100kJ·mol -1,下列有关该反应的叙述正确的是( )A.正反应活化能小于100kJ·mol -1B.逆反应活化能一定小于100kJ·mol -1C.正反应活化能不小于100kJ·mol -1D.正反应活化能比逆反应活化能小100kJ·mol -1【跟踪练习2】SF 6是一种优良的绝缘气体,分子结构中只存在S —F 键。
已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF —F 、S —F 键需要吸收的能量分别为160kJ 、330kJ,则S(s)+3F 2(g)SF 6(g)的反应热ΔH为。
【练后反思】 1.正确理解活化能与反应热的关系(1)E 1为正反应活化能,E 2为逆反应活化能,ΔH =E 1-E 2;(2)催化剂能降低反应所需活化能,但不影响焓变的大小。
2.熟记反应热ΔH 的基本计算公式ΔH =生成物的总能量-反应物的总能量 ΔH =反应物的总键能之和-生成物的总键能之和 二、热化学方程式【思考】热化学方程式的概念、意义及书写时的注意事项有哪些? 1.概念:表示参加反应 和 的关系的化学方程式。
![[精品]人教版高中化学高二化学选修四全套导学案](https://img.taocdn.com/s1/m/b77a65dddb38376baf1ffc4ffe4733687e21fc7d.png)
[精品]人教版高中化学高二化学选修四全套导学案人教版高中化学选修四全套导学案目录第一章化学反应与能量............................................................................ (2)第一节化学反应和能量变化(1)2第一节化学反应和能量变化(2)4第二节燃烧热能6第三节化学反应热的计算(1)8第三节化学反应热的计算(2)10第二章化学反应速率和化学平衡第一节化学反应速率............................................................................ ......................................................11第二节影响化学反应速率的因素............................................................................ .................................13第三节化学平衡(1)......................................................................... ......................................................14第三节化学平衡(2)......................................................................... ......................................................15第三节化学平衡(3)......................................................................... ......................................................16第四节化学反应进行的方向............................................................................ .........................................18第三章水溶液中的离子平衡............................................................................ .. (20)第一节弱电解质电离(1)20第一节弱电解质电离(2)21秒,节水和溶液酸碱度电离(1)23秒,节水的电离和溶液的酸碱度(2)25第二种节水电离溶液的酸碱度(3)27第三节盐的水解(1)28第三节盐的水解(2)30第三节盐的水解(3)32第四节不溶性电解质的溶解平衡34第四章电化学基础37第一节原电池............................................................................ ...................................................................37第二节化学电源............................................................................ . (39)第三节电解槽(1)41第三节电解槽(2)43第四节金属的电化学腐蚀和防护45第一章化学反应与能量第一节化学反应与能量变化(1)编写:高二化学备课组――成杰、王爱芹、余传继[学习目标]1.了解化学反应中能量转化的原因和常见的能量转化形式;2.了解反应热和焓变的涵义;【要点】化学反应中的能量变化△ h[初步知识]1.化学反应中物质变化的实质是。


第一章化教反应与能量之阳早格格创做第一节化教反应与能量的变更-----第1课时焓变反应热[教习目标] 1.相识反应热的观念,知讲化教反应、热效力与反应的焓变之间的关系.2.知讲反应热与化教键的关系.3.知讲反应热与反应物、死成物总能量的关系.一、焓变反应热:定义:正在化教反应历程中,不然而有物量的变更,共时还伴随能量变更.1.焓战焓变焓变是_______________________________.单位:______________,标记:__________.2.化教反应中能量变更的本果化教反应的真量是_________________________________________________________.所有化教反应皆有反应热,那是由于正在化教反应历程中,当反应物分子间的化教键_____时,需要__________的相互效率,那需要__________能量;当____________________,即新化教键___________时,又要___________能量.ΔH=反应物分子的______-死成物分子的____________.3.搁热反应与吸热反应当反应完毕时,死成物释搁的总能量与反应物吸支的总能量的相对于大小,决断化教反应是吸热反应仍旧搁热反应.(1)当ΔH为“____”或者ΔH_____0时,为搁热反应,反应体系能量_____.(2)当ΔH为“___”或者ΔH_________0时,为吸热反应,反应体系能量__________.4.反应热思维模型(1)搁热反应战吸热反应____________________(2)反应热的真量(以H2(g)+Cl2(g)===2HCl(g)ΔH=-186 kJ·mol-1为例)E1:_________________E2:_________________ΔH=________________化教反应中能量变更与反应物战死成物总能量的关系图二5、化教反应中的能量变更顺序化教反应所释搁的能量是新颖能量的主要根源之一.化教反应普遍是以热量战功的形式跟中界环境举止能量接换的,而其中多以热量的形式举止能量接换.(1)化教反应的特性是有新物量死成,死成物与反应物所具备的总能量分歧.(2)所有化教反应除按照品量守恒中,共样也皆按照能量守恒.(3)反应物与死成物的能量好若以热量形式表示即为搁热反应或者吸热反应.1.下列道法透彻的是()A.需要加热才搞爆收的反应一定是吸热反应B.搁热反应正在常温下一定很简单爆收C.吸热反应正在一定的条件下也能爆收D.焓变的标记是ΔH,单位是kJ·mol-1,反应热的单位是kJ2.已知正在相共情景下,要使共一化教键断裂需要吸支的能量等于产死该化教键搁出的能量.下列道法透彻的是()A.电解熔融的Al2O3不妨制得金属铝战氧气,该反应是一个搁出能量的反应B.火领会爆收氢气战氧气时搁出能量C.相共情景下,反应2SO2+O2===2SO3是一个搁热反应,则反应2SO3===2SO2+O2是一个吸热反应D.氯化氢领会成氢气战氯气时搁出能量3.通通常人们把拆启1 mol某化教键所吸支的能量瞅成该化教键的键能.现给出化教键的键能(睹下表):请估计H2(g)+Cl2(g)===2HCl(g)的反应热()A.+862 kJ·mol-1B.+679 kJ·mol-1C.-183 kJ·mol-1D.+183 kJ·mol-1,分子的空间构型是正四周体(如图).黑磷正在气氛中焚烧死成十氧化4四磷(P4O10),正在十氧化四磷分子里只存留P—O战P===O二种共价键.已知键能:P—O 360 kJ·mol-1;P===O 585 kJ·mol-1;P—P 198 kJ·mol-1;O===O 498 kJ·mol-1.请问:正在P4(s)+5O2(g)===P4O10(s)中,ΔH=______________.5.对于搁热反应:A+B===C+D,以下道法一定透彻的是(E A、E B、E C、E D分别表示物量A、B、C、D所具备的能量()A.E A>E B B.E A>E B+E C C.E A+E B>E C+E D D.E A+E B<E C+E D.由上图领会,有关道述透彻的是()A.A―→B+C战B+C―→A二个反应吸支或者搁出的能量不等B.A―→B+C是搁热反应C.A具备的能量下于B战C具备的能量总战D.A―→B+C是吸热反应,则B+C―→A必定是搁热反应1.下列道法不透彻的是()A.所有化教反应皆伴伴着能量变更B.化教反应中的能量变更皆表示为热量变更C.反应物的总能量下于死成物的总能量时,爆收搁热反应D.反应物的总能量矮于死成物的总能量时,爆收吸热反应2.已知H—H键键能(断裂时吸支或者死成时释搁的能量)为436 kJ·mol -1,H—N键键能为391 kJ·mol-1,根据热化教圆程式:N2(g)+3H2(g)===2NH3(g)ΔH=-92.4 kJ·mol-1.则N≡N键的键能是() A.431 kJ·mol-1B.945.6 kJ·mol-1C.649 kJ·mol-1D.896 kJ·mol-1 3.已知氢气正在氯气中焚烧时爆收惨红色火焰.正在反应历程中,益害1 mol氢气中的化教键消耗的能量为Q1 kJ,益害1 mol氯气中的化教键消耗的能量为Q2 kJ,产死1 mol氯化氢中的化教键释搁的能量为Q3 kJ,下列关系式透彻的是()A.Q1+Q2>Q3B.Q1+Q2>2Q3C.Q1+Q2<Q3D.Q1+Q2<2Q3练要领本领思维模型的使用已知H2(g)+12O2(g)===H2O(g)反应历程中能量变更如图,问:a、b、c 分别代表什么意思?该反应是搁热反应仍旧吸热反应,ΔH大于整仍旧小于整?5.下表中的数据是益害1 mol物量中的化教键所消耗的能量(kJ):根据上述数据回问(1)~(5)题.(1)下列物量自己具备的能量最矮的是()A.H2B.Cl2 C.Br2D.I2(2)下列氢化物中,最宁静的是()A.HCl B.HBr C.HI(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应仍旧搁热反应?问:____________________.(4)相共条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物量的量的氢气时,搁出或者吸支的热量最多的是__________.(5)若无上表中的数据,您能透彻回问出问题(4)吗?问:________,您的根据是__________________________________________________.6.已知1 g氢气真足焚烧死成火蒸气时搁出热量121 kJ,且氧气中1 mol O===O键真足断裂时吸支热量496 kJ,火蒸气中1 mol H—O键产死时搁出热量463 kJ,则氢气中1 mol H—H键断裂时吸支热量是?.第1课时焓变反应热问案知识面一有关反应热的观念1.问案C2.问案C知识面二反应热与化教键键能的关系3.问案C4.问案-2 982 kJ·mol-15.问案C6. 问案D练前提降真 1、问案B2.问案B3.问案D练要领本领思维模型的使用4.问案a代表旧键断裂吸支的能量,b代表新键死成释搁的能量,c代表反应热;该反应为搁热反应,ΔH<0.练概括拓展5.问案(1)A(2)A(3)搁热反应(4)Cl2(5)能元素的非金属性越强,死成的氢化物越宁静,反应搁出的热量便越多6问案436 kJ第一章化教反应与能量第一节化教反应与能量的变更---第2课时热化教圆程式[目标央供] 1.知讲热化教圆程式的意思.知讲效率反应热大小的果素.2.会写热化教圆程式..能流利推断热化教圆程式的正误.3.相识中战热的含意及测定要领.一、热化教圆程式1.观念:能表示介进反应的_______________战_____________的关系的化教圆程式喊搞热化教圆程式2.表示意思(1)热化教圆程式不然而标明黑化教反应中的____变更,也标明黑化教反应中的_____变更.(2)热化教圆程式中物量的化教计量数,表示本量介进反应的反应物的__________战本量死成的死成物的___________.(3)热化教圆程式中的反应热与反应物、死成物的___________相对于应.3.书籍写热化教圆程式的注意事项(1)__________________ ______;(2)________________ ___________(3)________________ _______________________________.二、中战热的测定1.真验本理:正在稀溶液中,_____________爆收中战反应死成________,那时的反应热喊搞中战热.2.注意事项(1)碱液稍过量的手段是_________________.(2)支配时动做要快手段是____________________.(3)真验中若使用了强酸或者强碱,会使测得中战热的数值_____________.训练:50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液正在如图所示的拆置中举止中战反应.通过测定反应历程中所搁出的热量可估计中战热.回问下列问题:(1)从真验拆置上瞅,图中尚缺少的一种玻璃用品是___________________________.(2)烧杯间挖谦碎纸条的效率是_____________________________________________.(3)大烧杯上如不盖硬纸板,供得的中战热数值__________________(挖“偏偏大”“偏偏小”“无效率”).(4)真验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液举止反应,与上述真验相比,所搁出的热量_________(挖“相等”“不相等”),所供中战热_________(挖“相等”“不相等”),简述缘由_____________________________________________.(5)用相共浓度战体积的氨火代替NaOH溶液举止上述真验,测得的中战热的数值会______;用50 mL 0.50 mol/L NaOH溶液举止上述真验,测得的中战热的数值会__________________.(均挖“偏偏大”“偏偏小”“无效率”)问案:(1)环形玻璃搅拌棒(2)缩小真验历程中的热量益坏(3)偏偏小(4)不等相等果为中战热是指酸跟碱爆收中战反应死成1 molH2O所搁出的能量,与酸碱的用量无关(5)偏偏小偏偏小.疑易面拨-----阐明中战热测定真验中几个为什么?1、是可所有酸与碱的中战热皆是相共的?正在稀溶液中,强酸战强碱真足电离,所以它们的反应便是H+与OH-分散成H2O的反应,每死成lmol火搁出的热量(中战热)是相共的,均为 57.3 kJ/mol.然而强酸、强碱正在火溶液中不克不迭真足电离,存留着电离仄稳.强酸或者强碱介进中战反应的共时,伴伴着电离,电离历程要吸支热量,此热量便要由H+与OH-分散成火分子搁出的热量去补偿,所以总的去道中战热小于 57.3 kJ/mol.2、真验中对于盐酸、NaOH溶液浓度有何央供?盐酸战NaOH溶液浓度的配制须准确,且NaOH溶液的浓度须稍大于盐酸的浓度.为使测得的中战热更准确,所用盐酸战NaOH溶液的浓度宜小不宜大,如果浓度偏偏大,则溶液中阳、阳离子间的相互遏制效率便大,表瞅电离度便会减小,那样酸碱中战时爆收的热量势需要用去一部分去补偿已电离分子的离解热,制成较大缺面(偏偏矮).NaOH溶液必须现配,往往由于吸支气氛中二氧化碳而引导浓度禁绝,效率真验截止.还要注意新配制的NaOH溶液要充分热却至室温后才搞使用. 3、真验中何如采用温度计及读数时应注意哪些事项?宜用有0.1分刻度的温度计,量程100℃,中战前酸战碱溶液的温度要相共,且皆为室温,且丈量时应尽大概读准,并估读到小数面后第二位.温度计的火银球部分要真足浸出正在溶液中,而且要宁静一段时间后再读数,以普及所测温度的粗度℃.一般温度计不克不迭达到此透彻度,需用贝克曼温度计举止丈量).4、使中战热测定截止往往偏偏矮的本果有哪些?(1)用二个大、小烧杯组拆量热器时,二个烧杯不克不迭相仄,纸板孔偏偏大,搅拌不匀称皆可引导截止偏偏矮;(2)倒进NaOH溶液缓.要一次性、赶快天将NaOH溶液倒进盐酸里,坐时用硬纸板或者泡沫塑料板盖佳,即时瞅察温度降下情况.反正真验时动做要快,以尽管缩小热量的益坏.(3)仪器保温本能好;那是偏偏矮的主要本果,用保温杯搞真验更能靠近表里值;(4)真验中忽略了仪器所吸支的热量,果此也使截止偏偏矮;(5)估计中假定溶液比热容为4.18 J/(g·℃),稀度为 1g/cm3,本量上那是火的比热容战稀度,酸碱溶液的比热容、稀度均较此数大,所以也使截止偏偏矮.5、酸碱中战反应的真量可表示为:H++OH-=H2O,是可用此代表所有中战反应的离子圆程式?酸碱中战反应的真量不克不迭与离子圆程式意思中的“真量”混共.根据离子圆程式书籍写央供:将易电离或者易溶的物量以及气体等用化教式表示,所以强酸、强碱介进中战反当令应以分子的形式死存.比圆,醋酸战氢氧化钠的离子圆程式便应当写为:HAC+OH-=Ac-+H2O,惟有可溶性强酸强碱的离子圆程式才大概如许表示.知识面一热化教圆程式的观念战意思1.下列道法透彻的是()A.书籍写热化教圆程式时,只消正在化教圆程式的左端写上热量的标记战数值即可B.通常是正在加热或者面焚条件下举止的反应皆是吸热反应C.标明反应所搁出或者吸支热量的化教圆程式喊搞热化教圆程式D.氢气正在氧气中焚烧的热化教圆程式是2H2(g)+O2(g)===2H2O(l)ΔH=-483.6 kJ2.热化教圆程式C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131.3 kJ·mol-1表示()A.碳战火反应吸支131.3 kJ能量B.1 mol碳战1 mol火反应死成1 mol一氧化碳战1 mol氢气并吸支131.3 kJ热量C.1 mol固态碳战1 mol火蒸气反应死成1 mol一氧化碳气体战1 mol 氢气并吸支131.3 kJ热量D.1个固态碳本子战1分子火蒸气反应吸热131.3 kJ知识面二热化教圆程式的书籍写及正误推断3.领会图中的能量变更情况,下列透彻的是()A.2A+B===2CΔH<0B.2C===2A+BΔH<0C.2A(g)+B(g)===2C(g)ΔH<0D.2A(g)+B(g)===2C(g)ΔH>0 4.已知正在1×105 Pa、298 K条件下,2 mol氢气焚烧死成火蒸气搁出484 kJ热量,下列热化教圆程式透彻的是()A.H2O(g)===H2(g)+12O2(g)ΔH=+242 kJ·mol-1B.2H2(g)+O2(g)===2H2O(l)ΔH=-484 kJ·mol-1C.H2(g)+12O2(g)===H2O(g)ΔH=+242 kJ·mol-1D.2H2(g)+O2(g)===2H2O(g)ΔH=+484 kJ·mol-1知识面三中战热5.50 mL 0.50 mol·L-15 mol·L-1NaOH溶液正在如图所示的拆置中举止中战反应,通过测定反应历程中所搁出的热量可估计中战热.试回问下列问题:(1)大小烧杯间挖谦碎纸条的效率是_____________________________________________________________ ___________.(2)大烧杯上如不盖硬纸板,供得的中战热数值将________(挖“偏偏大”、“偏偏小”或者“无效率”).分散通常是死计的本量该真验正在______中举止效验更佳.(3)真验中改用60 m L 0.50 mol·L-1盐酸与 50 m L 0.55 mol·L-1 NaOH溶液举止反应,与上述真验相比,所搁出的热量________(挖“相等”或者“不相等”),所供中战热________(挖“相等”或者“不相等”),简述缘由__________________________________________.(4)用相共浓度战体积的氨火代替NaOH溶液举止上述真验,测得的中战热的数值会________;用50 m L 0.5 mol·L-1 NaOH溶液举止上述真验,测得的中战热的数值会_______________________________________________________.(均挖“偏偏大”、“偏偏小”或者“无效率”)练前提降真1.已知热化教圆程式:2H2(g)+O2(g)===2H2O(l)ΔH1=-571.6 kJ·mol-1,则关于热化教圆程式:2H2O(l)===2H2(g)+O2(g)ΔH2=?的道法中透彻的是()A.热化教圆程式中化教计量数表示分子数B.该反应ΔH2大于整C.该反应的ΔH2=-571.6 kJ·mol-1D.该反应可表示36 g火领会时的热效力2.已知:H2(g)+F2(g)===2HF(g)ΔH=-270 kJ·mol-1,下列道法透彻的是()A.2 L氟化氢气体领会成1 L氢气与1 L氟气吸支270 kJ热量B.1 mol氢气与1 mol氟气反应死成2 mol液态氟化氢搁出的热量小于270 kJC.正在相共条件下,1 mol氢气与1 mol氟气的能量总战大于2 mol氟化氢气体的能量D.1个氢气分子与1个氟气分子反应死成2个氟化氢气体分子搁出270 kJ热量3.已知充分焚烧a g乙炔气体时死成1 mol二氧化碳气体战液态火,并搁出热量b kJ,则乙炔焚烧的热化教圆程式透彻的是()A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1B.C2H2(g)+52O2(g)===2CO2(g)+H2O(l)ΔH=+2b kJ·mol-1C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=+b kJ·mol-14.已知强酸与强碱正在稀溶液里反应的中战热可表示为H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1对于下列反应:CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-Q1 kJ·mol-112H2SO4(浓)+NaOH(aq)===12Na2SO4(aq)+H2O(l)ΔH=-Q2 kJ·mol-1HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)ΔH=-Q3 kJ·mol-1上述反应均正在溶液中举止,则下列Q1、Q2、Q3的关系透彻的是() A.Q2>Q3>Q1 B.Q2>Q1>Q3C.Q1=Q2=Q3D.Q2=Q3>Q15.已知:(1)H2(g)+12O2(g)===H2O(g)ΔH1=a kJ·mol-1(2)2H2(g)+O2(g)===2H2O(g)ΔH2=b kJ·mol-1(3)H2(g)+12O2(g)===H2O(l)ΔH3=c kJ·mol-1(4)2H2(g)+O2(g)===2H2O(l)ΔH4=d kJ·mol-1下列关系式中透彻的是()A.a<c<0 B.b>d>0C.2a=b<0 D.2c=d>0练要领本领可顺反应的反应热领会本领6.工业死产硫酸历程中,SO2正在交战室中被催化氧化为SO3气体,已知该反应为搁热反应.现将2 mol SO2、1 mol O2充进一稀关容器充分反应后,搁出热量98.3 kJ,此时测得SO2的转移率为50%,则下列热化教圆程式透彻的是()A.2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1B.2SO2(g)+O2(g) 3(g)ΔH=-98.3 kJ·mol-1C.SO2(g)+12O2(g) 3(g)ΔH=+98.3 kJ·mol-1D.SO2(g)+12O2(g) SO3(g)ΔH=-196.6 kJ·mol-1练概括拓展7.已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1.则HCN正在火溶液中电离的ΔH等于()A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1C.+43.5 kJ·mol-1D.+67.7 kJ·mol-1第2课时热化教圆程式问案1.问案C2问案C3.问案D4.问案A练前提降真1 问案B2.问案C3问案A4.问案A5.问案C6.问案A7.问案C第一章化教反应与能量第二节焚烧热能源[目标央供] 1.明黑焚烧热的观念.2.相识化教正在办理能源紧急中的要害效率,知讲俭朴能源、普及能量利用率的本量意思.一、焚烧热1.观念__________________时,____________杂物量____________焚烧死成_______________时所搁出的热量,喊搞该物量的焚烧热,单位_____________2.焚烧热与中战热的要害辨别(1)反应环境的辨别:焚烧热必须是焚烧反应而且是真足焚烧,有O2介进;而中战热是___________中的______________反应.(2)反应真量分歧:焚烧反应是氧化还本反应;中战反应是_______________.(3)确定物量分歧:焚烧热是1 mol杂物量被焚烧;中战热是__________________.二、能源1.能源是能提供__________的资材,它包罗_____________(煤、石油、天然气)、_________、_____、_________、__________以及柴草等. 2.办理能源紧急的要领(1)科教天统制________反应,使焚料充分_________,普及能源的____________.(2)觅找新的能源,现正探索的新能源有_____、________、________、_________、_________战______等,它们资材歉富,不妨_________,不传染或者很罕见传染.训练:下列关于焚烧的道法,推断正误:(1) 2C(s)+O2(g)=2CO(g) △H=120KJ/mol 焚烧热为: 120KJ/mol△△(4) CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802KJ/mol 焚烧热为:802KJ/mol思索2:对于焚烧热的明黑:(1) _______________________________________________.(2) _______________________________________________.(3) _______________________________________________.(4) _______________________________________________.训练:书籍写1mol甲烷战1mol H2、1molCO、1mol酒粗焚烧的热化教圆程式:思索3:从以下几个角度对于上述的几种焚料举止比较:★从单位物量的量焚烧热值的角度思量:采用_________较佳.★从环境传染(浑净能源)的角度思量:采用_________较佳.★从使用仄安的角度思量:家庭焚烧不修议用_________.★从成本角度考,修议采用 _________ .概括上述:您采用_________动做家庭的主要焚料.思索4:仿照中战热测定拆置,安排测定焚烧热的拆置,并绘出相关图形?思索5:三大化石焚料有_________ _________ _________,动做焚料的劣缺面__________________ ____________________________________ _________ .其中_________是较浑净的能源.接流思索:(1)比较H2、CH4谁的热值下?(2)比较CH4战C2H5OH谁更环保?(3)为什么尔国使用乙醇汽油动做汽油的代用品?知识面一焚烧热1.下列关于焚烧热的道法中透彻的是()A.1 mol物量焚烧所搁出的热量B.常温下,可焚物焚烧搁出的热量C.正在25℃、1.01×105 Pa时,1 mol杂物量真足焚烧死成宁静的氧化物时所搁出的热量D.焚烧热随化教圆程式前的化教计量数的改变而改变2.以下几个热化教圆程式,能表示有关物量焚烧时的焚烧热的热化教圆程式是()A.C(s)+12O2(g)===CO(g)ΔH=+110.5 kJ·mol-1B.C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1D.H2(g)+12O2(g)===H2O(g)ΔH=-241.8 kJ·mol-1知识面二能源3.关于能源,以下道法中不透彻的是()A.煤、石油、天然气等焚料的最初根源皆可逃溯到太阳能B.柴草焚烧时释搁的能量是死物能C.核能战天热能去自天球自己D.潮汐能根源于月球引力搞功4.下列道述透彻的是()A.火能是二次能源B.电能是二次能源C.天然气是可复活能源D.火煤气是可复活能源练前提降真1.下列热化教圆程式中ΔH的数值表示可焚物焚烧热的是()A.CO(g)+12O2(g)===CO2(g)ΔH=-283 kJ·mol-1B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1D.H2(g)+Cl2(g)===2HCl(g)ΔH=-184.6 kJ·mol-12.已知H2的焚烧热为-285.8 kJ·mol-1,CO的焚烧热为-282.8 kJ·mol -1;现有H2战CO组成的混同气体5.6 L(尺度情景),经充分焚烧后,搁出总热量为71.15 kJ,并死成液态火.下列道法透彻的是() A.CO焚烧的热化教圆程式为2CO(g)+O2(g)===2CO2(g)ΔH=-282.8 kJ·mol-1B.H2焚烧的热化教圆程式为2H2(g)+O2(g)===2H2O(g)ΔH=-571.6 kJ·mol-1C.焚烧前混同气体中CO的体积分数为60%D.焚烧后的产品局部与脚量的过氧化钠效率可爆收0.125 mol O2 3.根据以下3个热化教圆程式2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)ΔH=-Q1 kJ·mol-12H2S(g)+O2(g)===2S(s)+2H2O(l)ΔH=-Q2 kJ·mol-12H2S(g)+O2(g)===2S(s)+2H2O(g)ΔH=-Q3kJ·mol-1推断Q1、Q2、Q3三者关系透彻的是()A.Q1>Q2>Q3B.Q1>Q3>Q2C.Q3>Q2>Q1 D.Q2>Q1>Q34.已知化教反应:C(s)+1/2O2(g)===CO(g)ΔH1<0CO(g)+1/2O2(g)===CO2(g)ΔH2<0C(s)+O2(g)===CO2(g)ΔH3<0;下列道法透彻的是(相共条件下)()A.56 g CO战32 g O2所具备的总能量小于88 g CO2所具备的总能量B.碳的焚烧热是ΔH3C.ΔH1<ΔH3D.28 g CO的总能量比44 g CO2的总能量下5.下列热化教圆程式书籍写透彻的是(ΔH的千万于值均透彻)() A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1 367.0 kJ·mol-1(焚烧热)B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1(中战热)C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(反应热)D.2NO2===O2+2NOΔH=+116.2 kJ·mol-1(反应热)6.一些烷烃的焚烧热如下表:下列道法透彻的是()A.正戊烷的焚烧热约莫是-3 540 kJ·mol-1B.热宁静性:正丁烷>同丁烷C.乙烷焚烧的热化教圆程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g)ΔH=-1 560.8 kJ·mol-1D.相共品量的烷烃,碳的品量分数越大,焚烧搁出的热量越多练要领本领焚烧热的热化教圆程式的书籍写要领7.(1)正在101 kPa时,H2正在1 mol O2中真足焚烧死成2 mol液态火,搁出571.6 kJ的热量,H2的焚烧热为________,表示H2焚烧热的热化教圆程式为__________________________.(2)1.00 L 1.00 mol·L-1L 1.00 mol·L-1 NaOH溶液真足反应,搁出114.6 kJ的热量,该反应的中战热为____________,表示其中战热的热化教圆程式为__________________.8.0.3 mol气态下能焚料乙硼烷(B2H6)正在氧气中焚烧,死成固态三氧化二硼战液态火,搁出649. 5 kJ热量,其热化教圆程式为________________________;又已知H2O(l)===H2O(g)ΔH=+44 kJ·mol-1L(尺度情景)乙硼烷真足焚烧死成气态火时搁出的热量是________kJ.练概括拓展9.皆会使用的焚料,现大多用煤气、液化石油气.煤气的主要身分是一氧化碳战氢气的混同气体,它由煤冰与火(蒸气)反应制得,故又称火煤气.(1)试写出制与火煤气的主要化教圆程式:_____________________________________________________________ ________________________________________________________________________ ___________.(2)液化石油气的主要身分是丙烷,丙烷焚烧的热化教圆程式为C3H8(g)+5O 2(g)===3CO 2(g)+4H 2O(l) ΔH =-2 220.0 kJ·mol -1,已知CO 气体焚烧的热化教圆程式为CO(g)+12O 2(g)===CO 2(g) ΔH =-282.57kJ·mol -1,则相共物量的量的C 3H 8战CO 焚烧爆收的热量比值约为______________.(3)已知氢气焚烧的热化教圆程式为2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol -1,则相共品量的氢气战丙烷焚烧,爆收的热量的比值约为______________.(4)氢气是已去的能源,除爆收的热量大除中,还具备的便宜是____________________________________________________________. 10.暂时上海大部分皆会住户所使用的焚料主假如管讲煤气,浦东新区住户启初使用东海天然气动做民用焚料,管讲煤气的主要身分是CO 、H 2战少量烃类,天然气的主要身分是CH 4,它们的焚烧反应如下:2CO +O 2=====面焚2CO 22H 2+O 2=====面焚2H 2O CH 4+2O 2――→面焚CO 2+2H 2O 根据以上化教圆程式推断:焚烧相共体积的管讲煤气战天然气,消耗气氛体积较大的是__________,果此焚烧管讲煤气的灶具如需改烧天然气,灶具的矫正要领是________________________________________________________________________(挖“删大”或者“减小”)进风心,如不做矫正大概爆收的不良截止是_______________.管讲煤气中含有的烃类,除甲烷中,另有少量乙烷、丙烷、丁烷等,它们的某些本量睹下表:乙烷 丙烷 丁烷 熔面(℃) 沸面(℃)试根据以上某个关键数据阐明冬天热热的季节偶尔管讲煤气火焰很小,而且呈断绝状态的本果是________________________________________________________________________________________________________________________________________________.第二节 焚烧热 能源问案1. 问案 C2.问案 B3. 问案 B4. 问案 B 练前提降真1.问案 A2.问案 D3.问案 A4. 问案 B5.问案 C6. 问案 A7. 问案 (1)-285.8 kJ·mol -1H 2(g)+12O 2(g)===H 2O(l) ΔH =-285.8kJ·mol-1(2)-57.3 kJ·mol -112H 2SO 4(aq)+NaOH(aq)===12Na 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ·mol -1 8.问案 B 2H 6(g)+3O 2(g)===B 2O 3(s)+3H 2O(l) ΔH =-2 165 kJ·mol -19. 问案 (1)C +H 2O(g)=====下温CO +H 2 (2)7.9∶1 (3)2.8∶1(4)①不爆收CO 2,进而不引起温室效力;②H 2根源歉富;③产品不传染环境10.问案天然气删大天然气不克不迭充分焚烧,死成有毒的CO 丁烷逢热凝结为液体,使管讲内气流不畅第一章化教反应与能量第三节化教反应热的估计第1课时化教反应热的估计[目标央供] 1.明黑盖斯定律的意思.2.能用盖斯定律战热化教圆程式举止有关反应热的简朴估计.一、盖斯定律1.含意(1)不管化教反应是____完毕或者分______完毕,其反应热是_________的.(2)化教反应的反应热只与反应体系的初态战终态有关,而与反应的道路无关.比圆,ΔH1、ΔH2、ΔH3之间犹如下的关系:_____________________.2.意思利用盖斯定律,不妨__________估计一些易以测定的_____________.比圆:C(s)+12O2(g)===CO(g)上述反应正在O2供应充分时,可焚烧死成CO2;O2供应不充分时,虽可死成CO,然而共时还部分死成CO2.果此该反应的ΔH_____________-,然而是下述二个反应的ΔH却不妨间接测得:(1)C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1(2)CO(g)+12O2(g)===CO2(g)ΔH2=-283.0 kJ·mol-1根据盖斯定律,便不妨估计出欲供反应的ΔH.领会上述二个反应的关系,即知:ΔH=_______________.则C(s)与O2(g)死成CO(g)的热化教圆程式为C(s)+12O2(g)===CO(g)ΔH=-110.5 kJ·mol-1.错误!二、反应热的估计1.根据热化教圆程式举止物量战反应热之间的供算例1由氢气战氧气反应死成4.5 g火蒸气搁出60.45 kJ的热量,则反应:2H2(g)+O2(g)===2H2O(g)的ΔH为()A.-483.6 kJ·mol-1B.-241.8 kJ·mol-1C.-120.6 kJ·mol-1 D.+241.8 kJ·mol-12.利用焚烧热数据,供算焚烧反应中的其余物理量例2甲烷的焚烧热ΔH=-890.3 kJ·mol-11 kg CH4正在25℃,101 kPa时充分焚烧死成液态火搁出的热量约为()A.-5.56×104 kJ·mol-1B.5.56×104 kJ·mol-1C.5.56×104 kJ D.-5.56×104 kJ3.利用盖斯定律的估计例3已知下列热化教圆程式:①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)ΔH1=-26.7 kJ·mol-1②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g)ΔH2=-50.75 kJ·mol-1③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH3=-36.5 kJ·mol-1则反应FeO(s)+CO(g)===Fe(s)+CO 2(g)的焓形成() A .+7.28 kJ·mol -1 B .-7.28 kJ·mol-1C .+43.68 kJ·mol -1D .-43.68 kJ·mol -1训练1、2009广东22·4由金黑石TiO 2制与单量Ti ,波及到的步调为:TiO 2TiCl 4−−−−→−ArC /800/0镁Ti 已知:①C s+O 2g=CO 2g ; H =393 5kJ ·mol 1②2CO g +O 2g =2CO 2g ;H =566 kJ ·mol1③ TiO 2s+2Cl 2g=TiCl 4s+O 2g ;H =+141kJ ·mol 1 则TiO 2s +2Cl 2g+2C s =TiCl 4s +2CO g 的H =.问案:80 kJ ·mol1训练2、已知下列热化教圆程式:(1);△H =-25 KJ/mol (2);△H =-47 KJ/mol (3);△H =+19 KJ/mol 写出FeO(S) 被CO 还本成Fe 战CO 2的热化教圆程式___________________________________ 知识面一 盖斯定律及应用1.使用盖斯定律解问问题常常有二种要领:其一,假制路径法:如C(s)+O 2(g)===CO 2(g),可树坐如下:ΔH 1=ΔH 2+ΔH 3其二:加合(或者叠加)法:即使用所给圆程式便可通过加减的要领得到新化教圆程式.如:供P 4(黑磷)===4P(黑磷)的热化教圆程式.已知:P4(s,黑磷)+5O2(g)===P4O10(s)ΔH1①4P(s,黑磷)+5O2(g)===P4O10(s)ΔH2②即可用①-②得出黑磷转移为黑磷的热化教圆程式.2.已知:H2O(g)===H2O(l)ΔH=Q1 kJ·mol-1C2H5OH(g)===C2H5OH(l)ΔH=Q2 kJ·mol-1C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1若使46 g酒粗液体真足焚烧,终尾回复到室温,则搁出的热量为() A.(Q1+Q2+Q3) KjB.0.5(Q1+Q2+Q3) kJQ1Q2Q3) kJD.(3Q1-Q2+Q3) kJ知识面二反应热的估计3.已知葡萄糖的焚烧热是ΔH=-2 840 kJ·mol-1,当它氧化死成1 g液态火时搁出的热量是()A.26.0 kJ B.51.9 kJC.155.8 kJ D.467.3 kJ4.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1CO(g)+12O2(g)===CO2(g)ΔH=-282.8 kJ·mol-1现有CO、H2、CO2L (尺度情景),经真足焚烧后搁出的总热量为710.0 kJ,并死成18 g液态火,则焚烧前混同气体中CO的体积分数为() A.80% B.50% C.60% D.20%练前提降真1.已知:(1)Zn(s)+1/2O2(g)===ZnO(s)ΔH=-348.3 kJ·mol-1(2)2Ag(s)+1/2O2(g)===Ag2O(s)ΔH=-31.0 kJ·mol-1则Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)的ΔH等于()A.-317.3 kJ·mol-1B.-379.3 kJ·mol-1C.-332.8 kJ·mol-1D.+317.3 kJ·mol-12.已知25℃、101 kPa条件下:4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2 834.9 kJ·mol-14Al(s)+2O3(g)===2Al2O3(s)ΔH=-3 119.1 kJ·mol-1由此得出的透彻论断是()A.等品量的O2比O3能量矮,由O2形成O3为吸热反应B.等品量的O2比O3能量矮,由O2形成O3为搁热反应C.O3比O2宁静,由O2形成O3为吸热反应D.O2比O3宁静,由O2形成O3为搁热反应3.能源问题是人类社会里临的要害课题,H2、CO、CH3OH皆是要害的能源物量,它们的焚烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1.已知CO战H2正在一定条件下不妨合成甲醇CO(g)+2H2(g)===CH3OH(l).则CO与H2反应合成甲醇的热化教圆程式为()A.CO(g)+2H2(g)===CH3OH(l)ΔH=-127.4 kJ·mol-1B.CO(g)+2H2(g)===CH3OH(l)ΔH=+127.4 kJ·mol-1C.CO(g)+2H2(g)===CH3OH(g)ΔH=-127.4 kJ·mol-1D.CO(g)+2H2(g)===CH3OH(g)ΔH=+127.4 kJ·mol-14.已知火箭焚料二甲基肼(CH3—NH—NH—CH3)的焚烧热为-6 000 kJ·mol-1,则30 g二甲基肼真足焚烧搁出的热量为()A.1 500 kJ B.3 000 KjC.6 000 kJ D.12 000 kJ。

第一章化学反应与能量知识要点:一、焓变(△H)反应热在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓差值即焓变(△H)决定。
在恒压条件下,反应的热效应等于焓变。
放热反应△H 0吸热反应△H 0焓变(△H)单位:KJ/mol二、热化学方程式定义:能表示参加反应物质的量和反应热的关系的化学方程式。
书写时应注意:1.指明反应时的温度和压强(对于25℃、101KPa时进行的反应,可以不注明)。
2.所有反应物和产物都用括号注明它们在反应时的状态。
3.各物质前的系数指实际参加反应的物质的量,可以是整数也可以是分数。
4.△H单位KJ/mol中每摩尔指的是每摩尔反应体系,非每摩尔某物质,其大小与反应物的物质的量成正比。
5.对于可逆反应中的△H指的是正向完全进行时的焓变。
三、燃烧热定义:25℃、101KPa时,1mol纯物质完全燃烧生成稳定化合物时所放出的热量,叫做该物质的燃烧热。
单位:KJ/mol注意点:1.测定条件:25℃、101KPa,非标况。
2.量:纯物质1mol3.最终生成稳定的化合物。
如C→CO2,H→H2O(l)书写燃烧热化学方程式应以燃烧1mol纯物质为标准来配平其余物质的化学计量数。
四、中和热定义:在稀溶液中,酸与碱发生中和反应生成1mol H2O时所释放的热量称为中和热。
强酸与强碱反应生成可溶性盐的热化学方程式为:H+(aq)+ OH- (aq) == H2O(l) △H= -57.3KJ/mol实验:中和热的测定见课本第4~5页思考:1.环形玻璃棒的作用2.烧杯间填满碎泡沫塑料的作用3.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”)五、化学反应热的计算盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
即化学反应的反应热只与反应体系的始态和终态有关,而与反应途径无关。
假设反应体系的始态为S,终态为L,若S→L,△H﹤0;则L→S,△H﹥0。

第四节化学反应进行的方向1.了解放热反应的自发性和某些吸热反应的自发性。
2.通过“有序”和“无序”的对比,理解熵的概念。
3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和熵变说明化学反应进行的方向。
自发过程与自发反应1.自发过程(1)含义:在一定条件下,不用借助于外力就可以自动进行的过程。
(2)特点①体系趋向于从高能状态转变为低能状态(体系对外部做功或者释放热量)。
②在密闭条件下,体系有从有序自发转变为无序的倾向。
2.自发反应在一定条件下无需外界帮助就能自发进行的反应。
1.正误判断:正确的打“√”,错误的打“×”,并阐释错因或列举反例。
语句描述正误阐释错因或列举反例(1)自发过程不需任何条件就能发生(2)水由高处向低处流属于自发过程(3)铁在潮湿空气中生锈属于非自发过程(4)从高能转变为低能的过程,一定是自发过程(5)日常生活中,气温升高时冰雪自动融化属于自发过程(2)√(3)×该过程属于自发过程(4)×不一定,如4NO2+O2===2N2O5反应放热,其不是自发过程(5)√2.自发反应一定能发生反应,而非自发反应一定不能发生反应吗?说明理由。
答案:不一定。
自发反应和非自发反应是指该反应过程是否有自发进行的倾向,而这个过程是否一定会发生则不能确定。
例如,碳的燃烧是一个自发反应,但需要借助外界条件“点燃”反应才能发生。
1.下列过程是非自发的是()A.水由高处向低处流B.室温下水结成冰C.气体从高密度处向低密度处扩散D.煤气的燃烧解析:选B。
自然界中水由高处向低处流、煤气的燃烧、气体从高密度处向低密度处扩散、室温下冰的融化都是自发过程,其逆向都是非自发的。
2.下列过程是自发进行的吸热反应的是()A.NaOH与HCl反应B.CO与O2点燃条件下发生反应C.消石灰与氯化铵晶体的反应D.SO3与H2O反应解析:选C。
题中四个反应都可自发进行,但A、B、D三项中的反应都为放热反应,只有C项是吸热反应。