2019年精选初中科学七年级下册4 配制溶液华师大版习题精选【含答案解析】四十三
- 格式:docx
- 大小:842.90 KB
- 文档页数:10

2019-2020年华师大版初中科学七年级下册第1章水4 配制溶液课后练习二十二第1题【单选题】向100g10%的氢氧化钠溶液中加入12.5g氢氧化钠固体,完全溶解后所得溶液中溶质质量分数为( )A、12.5%B、25%C、20%D、22.5%【答案】:【解析】:第2题【单选题】如要将100g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为( )A、50gB、90gC、100gD、200g【答案】:【解析】:第3题【单选题】下列实验操作不能达到相应目的的是( ) A、B、C、D、【答案】:【解析】:第4题【单选题】t℃时,向一只盛有0.15 g熟石灰的烧杯中加入50 g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体。
下列相关叙述正确的是( )A、升高温度后,溶液变为不饱和溶液B、t ℃时,熟石灰的溶解度为0.3 gC、烧杯中溶液的质量小于50.15 gD、上层清液中溶质质量分数大于0.3%【答案】:【解析】:第5题【单选题】电解水时,常在水中加入少量的硫酸以增强水的导电性.若用8%的硫酸溶液200g,通以直流电进行电解水实验,过一段时间后,溶液中硫酸的质量分数为10%,则已电解的水的质量为( )A、10gB、20gC、32gD、40g【答案】:【解析】:第6题【单选题】一定温度下,一定质量的氢氧化钠固体溶于水制成溶液.下列有关的量不随水的质量改变而改变的是( )?A、溶液质量分数B、溶液的pHC、氢氧化钠的溶解度D、最多能吸收二氧化碳的质量【答案】:【解析】:第7题【填空题】实验室配制500g溶质的质量分数为0,5%的KMnO4溶液,用于对种子进行消毒,现准备如下实验用品,请回答下列问题:(1)称量KMnO4固体时,药品应放在托盘天平______(填“左”或“右”)盘的纸片上,天平上的游码位置应是图中的______(填字母).(2)量取所需水时,除上述准备的实验用品外,还需要的一种仪器是______(填名称).若仰视读数,则所配制的溶液,其溶质的质量分数会______(填“偏大”、“偏小”或“不变”).【答案】:【解析】:第8题【填空题】实验室配制溶质质量分数为10%的碳酸钠溶液400g,需碳酸钠______ g,需水______g.【答案】:【解析】:第9题【计算题】咸鸭蛋是一种很普通的早餐小菜。

2019年精选初中七年级下册科学4 配制溶液华师大版习题精选七十一第1题【单选题】如图是甲、乙、丙三种固体物质溶解度曲线,下列叙述正确的( )A、t<sub style="line-height: 22px;">2℃时乙物质的饱和溶液溶质的质量分数为20%B、t<sub style="line-height: 22px;">2℃时三种物质溶解度关系为:甲>乙>丙C、随温度的升高,甲、乙、丙三种物质溶解度都增大D、甲物质的饱和溶液从t<sub style="line-height: 22px;">1℃升温到t<sub style="line-height:22px;">3℃时,溶质质量分数增大【答案】:【解析】:第2题【单选题】向m g硝酸钾的不饱和溶液中加入硝酸钾晶体,在此变化过程中溶液里溶质的质量分数p%与加入硝酸钾晶体的质量m′的关系正确的是( )A、B、C、D、【答案】:【解析】:第3题【单选题】已知:硝酸钾的溶解度随温度升高而增大。
下图是有关硝酸钾溶液的实验操作及变化情况。
下列说法正确的是( )A、操作I一定是加溶质B、整个实验过程中硝酸钾的溶解度一定不变C、①与②的溶质质量可能相等D、②与③的溶质质量分数可能相等【答案】:【解析】:第4题【单选题】A、KCl 饱和溶液中不能再溶解其他物质B、20℃时,100gKCl 饱和溶液中含KCl 34.0gC、60℃的KCl 饱和溶液降温至20℃肯定有晶体析出D、40℃时,KCl 饱和溶液的质量分数为40.0%【答案】:【解析】:第5题【单选题】有40g质量分数为5%的CaCl2溶液,若将其质量分数增大到10%,应采用的方法是( )A、把溶剂蒸发掉一半B、加入40g溶质质量分数为15%的CaCl2溶液C、把溶剂蒸发掉10gD、加入2g CaCl2固体【答案】:【解析】:第6题【填空题】某科学小组做了如下实验,请仔细观察下面实验的操作及现象并回答下列问题:B中溶液变浑浊的原因是______。

配制溶液一、选择题1.配制一定质量分数的食盐溶液,步骤正确的是(A )计算,称量,量取,溶解 (B )称量,计算,量取,溶解(C )量取,称量,溶解,计算 (D )计算,量取,溶解,称量2.下列有关溶液(固体溶质)的叙述,正确的是(A )某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小(B )在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大(C )任何物质的饱和溶液,当温度降低时一定会析出溶质(D )饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小3.将下列物质各10充分别投入到90克水中,最终所得溶液中溶质的质量分数为10%的是(A )O Na 2 (B )CaO (C )NaCl (D )3SO4.在25℃时,向100克NaCl 饱和溶液中加入10克水,不发生变化的是(A )溶液的质量 (B )溶质的质量分数(C )溶剂的质量 (D )溶质的质量5.要配制 245克溶质质量分数为 20%的硫酸溶液,需要溶质质量分数为98%的硫酸(A )50克 (B )l95克 (C )196克 (D )49克6.将5克硝酸钠固体放入45克水中,完全溶解后,溶液中溶质的质量分数是(A )5% (B )10% (C )11.1% (D )15%7.将20℃时的硝酸钾饱和溶液升温至50℃(不考虑水分的蒸发),一定发生改变的是(A )溶质的质量分数 (B )溶液的质量(C )硝酸钾的溶解度 (D )溶质的质量8.将10克4CuSO 白色固体溶解在90克水中配成溶液,该4CuSO 溶液中 2Cu 与水分子的个数比为(A )1:9 (B )1:32(C )1:80 (D )l :1259.在25℃时,向饱和的澄清石灰水中加入少量氧化钙,恢复到25℃时,关于该溶液的下列说法中正确的是(A)溶质质量不变(B)溶质质量减少(C)溶质的质量分数减小(D)溶质的质量分数增大10.注射用链霉素试验针的药液配制方法如下:(1)把1.0g链霉素溶于水制成4.0mL溶液①(2)取0.1mL溶液①加水稀释至1.0mL,得溶液②(3)取0.1mL溶液②加水稀释至1.0mL,得溶液③(4)取0.2mL溶液③加水稀释至1.0mL,得溶液④最终得到的试验针药液中,链霉素的质量分数是(由于整个过程中药液很稀,密度近似看做1g/mL)(A)25% (B)0.05% (C)0.25% (D)2.5%11.将质量分数为50%和30%的氯化钠溶液混合,配制成质量分数为40%的氯化钠溶液,应取这两种溶液的质量比为(A)1:3 (B)1:1 (C)5:3 (D)3:112.在一定温度下,向氯化钠的饱和溶液中,加入少量氯化钠的晶体,则(A)晶体质量减少(B)溶质的质量分数增大(C)晶体质量不变(D)溶质的溶解度增大13.溶液在稀释前后保持不变的是(A)溶质的质量分数(B)溶质的质量(C)溶液的质量(D)溶剂的质量14.将下列物质各10g分别放入90g水中,充分溶解后,所得溶液中溶质的质量分数最大的是SO(D)NaOH(A)NaCl(B)CaO(C)315.在一定温度下,向一定量的氯化钠稀溶液中不断加入氯化钠固体,并搅拌,在此过程中溶液里溶质的质量分数( )与加入氯化钠质量(m)的变化关系如下图所示,其中图像正确的是。


一、选择题1. 下列有关溶液的说法中正确的是( )A.均一、稳定的液体都是溶液B.在其他条件不变时,氧气的溶解度随温度的升高而升高C.饱和溶液一定比不饱和溶液浓D.餐具上的油污用热水比冷水更容易洗去2. 溶液在稀释前后保持不变的是A.溶质的质量分数B.溶质的质量C.溶液的质量D.溶剂的质量3. 向滴有石蕊试液的稀盐酸中,慢慢滴入过量氢氧化钠溶液,石蕊颜色变化的过程是( )A.红→蓝→紫B.紫→蓝→红C.蓝→紫→红D.红→紫→蓝二、填空题4. 在实验室,小科分别用甲盐的晶体配制了溶质质量分数为5%的A的溶液和30%的B溶液,但忘了帖标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液,请写出简要的实验方案和明确的判断依据,有下列仪器、物品供选择,量筒、天平、小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜萝卜、甲盐的晶体、弹簧测力计,(实验室的室温为30℃,30℃甲盐的溶解度为50g)方案1:____________________________________判别依据___________________。
方案2:____________________________________判别依据___________________。
5. 某温度时,蒸干35g硝酸钾饱和溶液后得到10g硝酸钾,该温度时硝酸钾的溶解度为克。
一木块漂浮于50℃时的硝酸钾饱和溶液中(如图),温度改变时)随时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积(V排间(t)发生了如图丙所示的变化。
由此推测出温度的改变方式是(填“升温”“降温”),同时观察到烧杯底部硝酸钾晶体(填“增多”“减少”)。
三、探究题6. 探究硝酸铵溶于水后液体温度的变化的实验操作如下图所示.请回答问题:(1)指出图示中的操作存在的两处错误, _______________;。
(2)图示中的错误操作改正后,上述实验能否测得硝酸铵溶解前后液体温度的改变,为什么?___ 。
华师大版七年级下册科学第一章第四节配置溶液练习题1.在90g水中溶解了10g的食盐,则食盐溶液的质量分数是多少?2.江邵培训学校想配置30kg质量分数是75%的酒精消毒液来消毒,需要酒精和水各多少千克?3.用9g氯化钠可以配置多少g质量分数是0.9%的氯化钠溶液?4.把5g的氢氧化钠固体溶解在45g 的水中,可以得到多少g氢氧化钠溶液?此时溶液的质量分数是多少?5.从50g15%的硫酸铜溶液中取出10g,这10g溶液里含有多少g溶质?6.将50g20%的氯化钾溶液中加入150g水,所得溶液的质量分数是多少?7.100g质量分数是20%的硝酸钾溶液,加入多少g水可以变成质量分数是10%的硝酸钾溶液?8. 浓度为10%的盐水60千克,再加入多少千克浓度为30%的盐水可以得到浓度22%的盐水?9.有75%的酒精溶液100g,需要加入多少g质量分数是25%的酒精溶液,可以变成质量分数是50%的酒精溶液?10. 现在有浓度是10%的氯化钠溶液800克,需要蒸发多少g的水,才能得到浓度是20%的氯化钠溶液?11. 现在有浓度是10%的氯化钠溶液800克,要加入多少g氯化钠,才能得到浓度是20%的氯化钠溶液?12.有两种酒精溶液,甲有300克,含酒精27克,乙有500克,含酒精40克。
现在要得到浓度是8.2%的酒精200克,甲乙两种酒精溶液各取多少克?华师大版七年级下册科学第一章第四节配置溶液练习题(参考答案)1.在90g水中溶解了10g的食盐,则食盐溶液的质量分数是多少?10g×100%=10%90g+10g2.江邵培训学校想配置30kg质量分数是75%的酒精消毒液来消毒,需要酒精和水各多少千克?30kg×75%=22.5kg 30kg-22.5kg=7.5kg3.用9g氯化钠可以配置多少g质量分数是0.9%的氯化钠溶液?9g÷0.9%=1000g4.把5g的氢氧化钠固体溶解在45g 的水中,可以得到多少g氢氧化钠溶液?此时溶液的质量分数是多少?×100%=10%5g+45g=50g 5g5g+45g5.从50g15%的硫酸铜溶液中取出10g,这10g溶液里含有多少g溶质?10×15%=1.5g6.将50g20%的氯化钾溶液中加入150g水,所得溶液的质量分数是多少?50g×20%×100%=5%50g+150g7.100g质量分数是20%的硝酸钾溶液,加入多少g水可以变成质量分数是10%的硝酸钾溶液?解设:加入Xg水可以变成质量分数是10%的硝酸钾溶液100g×20%=(100+x)×10%X=100g8. 浓度为10%的盐水60千克,再加入多少千克浓度为30%的盐水可以得到浓度22%的盐水?解设:再加入Xkg浓度是30%的盐水可以得到60kg×10%+Xkg×30%=(60kg+Xkg)×22%X=90kg9.有75%的酒精溶液100g,需要加入多少g质量分数是25%的酒精溶液,可以变成质量分数是50%的酒精溶液?解设:再加入Xg质量分数是25%的酒精溶液100g×75%+Xg×25%=(100g+Xg)×50%X=100g10. 现在有浓度是10%的氯化钠溶液800克,需要蒸发多少g的水,才能得到浓度是20%的氯化钠溶液?解设:需要蒸发Xg水800g×10%=(800g-Xg)×20%X=400g11. 现在有浓度是10%的氯化钠溶液800克,要加入多少g氯化钠,才能得到浓度是20%的氯化钠溶液?解设:加入Xg氯化钠800g×(1-10%)=(800g+Xg)×(1-20%)X=100g12.有两种酒精溶液,甲有300克,含酒精27克,乙有500克,含酒精40克。
配制溶液一、填空题1.配制500 mL 20%(密度为1.14 g/cm 3)的硫酸,需要98%(密度为1.84 g/cm 3)的硫酸____________mL ,需水____________mL 。
2.有100 g 10%的食盐溶液,要使其质量分数变为20%,有三种方法,按要求填空:(1)继续加入食盐,其质量为____________g ;(2)蒸发水分,其质量为____________g ;(3)与质量分数大于20%的浓食盐溶液混合,若混入25%的食盐溶液,其溶液质量为____________g 。
二、选择题3.对“10%的食盐溶液”含义的解释错误的是A.100 g 水中溶解了10 g 食盐B.100 g 食盐溶液中溶解有10 g 食盐C.将10 g 食盐溶解于90 g 水中所得的溶液D.将食盐与水按1∶10的质量比配成的溶液4.含溶质a g ,溶剂b g 的溶液,溶质的质量分数是 A.ba ×100% B.b a a +×100% C.b a b +×100% D.a b ×100% 5.溶液在稀释前后保持不变的是A.溶质的质量分数B.溶质的质量C.溶液的质量D.溶剂的质量6.室温下,饱和食盐水露置在空气中一段时间后,有少量固体析出,这是因为A.氯化钠的溶解度变小B.溶液中溶质的质量分数变小C.溶剂的质量减小D.溶液变成不饱和溶液7.向质量分数为20%的氢氧化钠溶液中加入3 g 固体氢氧化钠和12 g 水,所得溶液中溶质的质量分数是A.25%B.23%C.20.5%D.20%8.有一定质量的质量分数为12%的KCl溶液,当蒸发掉120 g水后,溶质的质量分数变为24%,则原溶液中溶质的质量为A.12 gB.14.4 gC.24 gD.28.8 g9.某硝酸钠饱和溶液,溶质的质量分数能发生改变的是A.温度不变,蒸发掉一部分水B.降低温度,析出硝酸钠晶体C.升高温度,水的质量不变D.温度不变,加入少量硝酸钠晶体10.将溶质质量分数为10%的溶液100 g,如果分别做如下四种处理:①蒸发10 g水无晶体析出;②加入10 g 10%的同种溶质的溶液;③加入10 g同溶质,且使之全部溶解;④加入10 g水,混合均匀,四种方法处理后的溶液中溶质的质量分数从大到小的顺序正确的是A.④③②①B.③①②④C.①③②④D.③④①②三、实验题11.下图是某同学配制一定质量的0.9%的生理盐水的全过程。
第4节 配制溶液(1)知识点1.表示溶液组成的方法有很多,在化学上常用__溶质的质量分数__表示溶液的组成。
2.溶质质量分数为溶液中__溶质__质量和__溶液__质量的比值,用公式表示为: 溶质的质量分数=__溶质质量溶液质量×100%__。
3.溶质的质量分数越大,表示溶液中溶质的相对含量__越大__,溶液越__浓__(填“浓”或“稀”)。
练习1.关于100 g 5%的氯化钠溶液,下列叙述正确的是( B ) A .100 g 水溶解了5 g 氯化钠 B .5 g 氯化钠溶解在95 g 水中C .溶液中氯化钠和水的质量比为1∶20D .溶液中氯化钠和水的质量比为19∶12.含溶质a g 、溶剂b g 的溶液,溶质的质量分数是( B ) A.a b ×100% B.a a +b ×100% C.b a +b×100% D.b a ×100%3.下列关于“溶质的质量分数为10%的硝酸钾溶液”的含义的说法中,错误的是( A )A .100 g 水中溶解了10 g 硝酸钾B .100 g 硝酸钾溶液中有10 g 硝酸钾C .将10 g 硝酸钾溶于90 g 水中所得的溶液D .将硝酸钾与水按1∶9的质量比配制的溶液4.一定温度下,有一杯食盐水,杯底尚有少量食盐固体不能溶解,现在将新鲜的萝卜块放入其中,放置一段时间。
下列说法错误的是( C )A .原食盐水一定是饱和溶液B .萝卜块质量一定减少C .杯中的食盐固体一定全部溶解D .溶液的质量一定增加5.每天补充适量的维生素C ,有利于提高人体的免疫力。
某维生素C 泡腾片每片含1克维生素C 。
将一片该泡腾片投入适量的水中,最终得到250克溶液,此溶液中维生素C 的质量分数为( A )A .0.4%B .1%C .2.5%D .4%6.一种抗生素为粉末状固体,每瓶含0.5 g ,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( B )A .1.5 gB .2 gC .3 gD .4 g7.若将100克20%的某溶液的浓度降低到5%,需加水( C ) A .150克 B .200克 C .300克 D .400克8.将50 g 20%的氯化钾溶液加水稀释到200 g ,稀释后所得溶液中溶质的质量分数是( B )A .1%B .5%C .10%D .20%9.20 ℃时,氯化钠的溶解度是36 g ,则20 ℃时氯化钠的饱和溶液中溶质的质量分数为( D )A .40%B .28.6%C .36%D .26.5%10.无土栽培的某种营养液中,含硝酸钾的质量分数为7.1%,某蔬菜生产基地欲配制该营养液200 kg ,需要硝酸钾的质量为( B )A .7.1 kgB .14.2 kgC .71 kgD .142 kg11.某物质(仅含一种溶质)的溶液在t ℃时,恒温蒸发掉10 g 水,析出了2 g 晶体,再恒温蒸发掉10 g 水,又析出了3 g 晶体,则下列说法错误的是(假设溶液中晶体未全部析出)( C )A .在t ℃时,原溶液是不饱和溶液B .在t ℃时,剩余溶液一定是饱和溶液C .剩余溶液的溶质质量分数为16.7%D .剩余溶液的溶质质量分数为23%12.现有一瓶质量分数为20%的某溶液,倒出34体积后再加水,直到所得溶液质量和原来溶液的质量相等,又倒出23体积,最后剩下溶液中溶质的质量分数为( C )A .3%B .4%C .5%D .6%13.把一定质量的硝酸钾不饱和溶液恒温蒸发水分直至有少量晶体析出。
精选2019-2020年华师大版科学七年级下册[第1章水4 配制溶液]复习特训[含答案解析]第五十五篇第1题【单选题】室温时,对100毫升氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液( )A、溶质质量相同B、溶质质量分数相同C、均为不饱和溶液D、溶剂质量相同【答案】:【解析】:第2题【单选题】泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,下列操作导致溶液浓度偏小的是( )A、称取氯化钠固体质量偏大B、转移称好的氯化钠固体时,有少量洒在桌上C、转移配好的氯化钠溶液时,有少量液体溅出D、量取稀释用的水体积偏小【答案】:【解析】:第3题【单选题】实验室配制50g质量分数为6%的氯化钠溶液,下列描述不正确的是( )、A、计算需氯化钠3g、水47gB、将氯化钠固体放于纸上称量C、将氯化钠固体放入量筒中溶解D、将配好的氯化钠溶液装瓶并贴好标签【答案】:【解析】:第4题【单选题】化学科学的发展离不开定量研究.下列有关定量实验的误差分析中,不正确的是( )A、配制10%的氯化钠溶液时,若烧杯内有水会导致所配溶液溶质的质量分数偏小B、粗盐提纯实验中,若蒸发过程中晶体飞溅会导致测得的氯化钠纯度偏低C、测定空气中氧气含量的实验中,铜粉质量的多少不影响实验结果D、用白磷燃烧探究质量守恒的实验中,白磷质量的多少不影响实验结果【答案】:【解析】:第5题【单选题】在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )A、用量筒量取水时俯视读数B、用来配制溶液的烧杯刚用少量蒸馏水润洗过C、用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码D、用了含少量杂质的蔗糖配制溶液【答案】:【解析】:第6题【填空题】如图是甲乙两种固体物质(均不含结晶水)的溶解度曲线,请你根据曲线回答一下问题.(1)50℃时,60g的甲物质加入到100g水中充分溶解,最终形成溶液的质量为______g.(2)30℃时,甲的饱和溶液比乙的饱和溶液溶质质量分数______(填“大”、“小”或“相等”).(3)50℃时,等质量的甲、乙饱和溶液降温到20℃,析出晶体多的是______(填“甲”或“乙”).【答案】:【解析】:第7题【填空题】如图为甲、乙、丙三种物质的溶解度曲线.(1)图中A点表示的乙溶液为______(填“饱和”或“不饱和”)溶液;(2)t3℃时,将40g甲物质加入到50g水中,所得溶液溶质质量分数为______;(3)t3℃时,将等质量甲和丙的饱和溶液降温到t2℃,所得溶液质量大小关系为:甲______丙(填“<”、“>”或“=”);(4)将t1℃时丙的不饱和溶液变为饱和溶液可采取的方法为______(填一种即可).【答案】:【解析】:第8题【填空题】根据问题填空:在农业生产上,需要质量分数为16%的氯化钠溶液来选种,现要配制100kg这种溶液,需要氯化钠______kg,需要水______kg.化学实验室取用16g硫酸铜粉末,可配制8%的硫酸铜溶液______g;若用20%的硫酸铜溶液100g加水稀释,可得8%的硫酸铜溶液______g.【答案】:【解析】:第9题【解答题】下图是我校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:这瓶浓硫酸溶液的质量为______克,其中含溶质质量是______克。
2019年精选初中科学七年级下册4 配制溶液华师大版习题精选【含答案解析】
四十三
第1题【单选题】
某病人静脉注射了质量分数为5%的葡萄糖注射液500g,其中含葡萄糖(C6H12O6)的质量是( )
A、125 g
B、100 g
C、50 g
D、25 g
【答案】:
【解析】:
第2题【单选题】
酒精分子的化学式为C2H5OH,某酒精溶液中酒精分子所含氢原子数与水分子所含氢原子数相等,则该溶液中酒精的质量分数为( )
A、46%
B、50%
C、56.1%
D、71.9%
【答案】:
【解析】:
第3题【单选题】
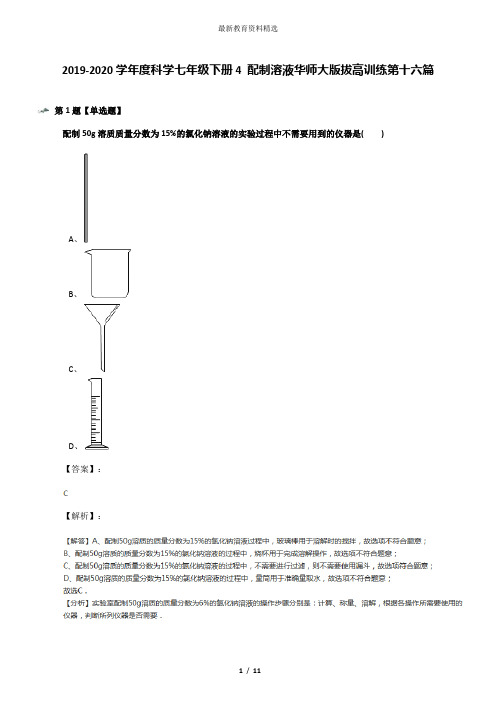
用氯化钠固体配制一定质量分数的氯化钠溶液,不需要用到的仪器是( )
A、托盘天平
B、烧杯
C、蒸发皿
D、量筒
【答案】:
【解析】:
第4题【填空题】
t2 ℃时,将等质量的a、b两种可溶性固体分别加入盛有相同质量水的烧杯中,充分搅拌后的现象如图(1)所示,a、b两种物质的溶解度曲线如图:
图(1)中,______(填“a”或“b”)物质的溶解一定达到了饱和状态。
图(2)中,______(填“甲”或“乙”)表示a的溶解度曲线。
将图1中a溶液的温度从t2 ℃降低到t1 ℃,所得溶液与原溶液相比较,通常没有发生变化的是(填序号)。
2·1·c·n·j·y
A、溶液的浓度
B、溶剂的质量
C、溶解度
【答案】:
【解析】:
第5题【填空题】
配制50g质量分数为10%的氢氧化钠溶液,下列失误会导致所配溶液溶质质量分数偏大的是______.
A.装瓶时,有溶液洒出B.将量筒中的水倒入烧杯时有水溅出C.溶解时未用玻璃棒搅拌
D.______ .
【答案】:
【解析】:
第6题【填空题】
【答案】:
【解析】:
第7题【解答题】
如图:在一根长100cm,粗细均匀的轻质木棒左端挂有100g砝码,右端挂有内盛66g氧化钙和碳酸钙的混合粉末的小桶(小桶质量为34g)。
以A点为支点时,木棒平衡。
向小桶内加入304.4g的稀盐酸,恰好完全反应后,生成二氧化碳气体4.4g,木棒失衡。
如果将支点移动,木棒再次平衡。
移动支点后,支点A距离a点的距离是______cm。
求原混合物中氧化钙和碳酸钙的各自质量。
所得溶液中溶质的质量分数是多少?(计算结果保留到0.1%)
【答案】:
【解析】:
第8题【解答题】
第2次测得剩余固体质量为74g,其成分中含______物质。
该黄铜样品中铜和锌的质量比是______。
计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图。
【答案】:
【解析】:
第9题【解答题】
20℃时,KNO3的溶解度为31.6g,将20gKNO3投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数.
【答案】:
【解析】:
第10题【解答题】
某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到100g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是195.6g,将溶液蒸干,得到15.6g硫酸钠.
计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%).
【答案】:
【解析】:
第11题【解答题】
【答案】:
【解析】:
第12题【实验探究题】
水中溶解了食盐后还能再溶解糖吗?小明同学带着问题进行了如下实验探究:
【提出问题】:不能再继续溶解食盐的溶液中,还能溶解其他溶质吗?
【猜想预测】:根据生活经验,一个容器盛满大豆后,还能再装入小米,因此不能再继
续溶解食盐的溶液中,还能溶解其他溶质。
【查阅资料】:高锰酸钾的水溶液为紫红色
【设计实验】:
1)向20 毫升水中加入食盐直到不能再溶解。
2)向所得溶液中加入一粒高锰酸钾固体,发现固体消失,溶液颜色变成紫红色。
3)再向溶液中加入少量的食盐,搅拌之后发现食盐仍不能再溶解。
4)【解释结论】①______。
②高锰酸钾溶解后再加入食盐,食盐不能再溶解,说明加入其它溶质后______增加食盐的溶解量(填“能”或“不能”)。
5)【拓展反思】若向不能再溶解食盐的溶液中加入蔗糖,食盐的质量分数会______(填“变大”“不变”或“减小”)。
【答案】:
【解析】:。