蛋白质和氨基酸性质
- 格式:doc
- 大小:47.50 KB
- 文档页数:5

糖类、蛋白质、氨基酸的结构特点及主要化学性质糖类、蛋白质均为食物中重要的营养素,是维持人体物质组成和生理机能不可缺少的要素,也是生命活动的物质基础,它们的结构特点及主要化学性质如下:一、糖类的组成、结构和分类:糖类由C 、H 、O 三种元素组成,多数糖类可用通式Cm(H 2O)n 来表示(m 和n 可以相同,也可以不同);从结构上看,糖类是多羟基醛或多羟基酮或水解后可生成多羟基醛或多羟基酮的化合物。
根据能否水解以及水解后的产物,糖类可分为单糖、二糖和多糖。
单糖是不能水解的糖,一般为多羟基醛或多羟基酮,葡萄糖是一种重要的单糖,它是一种多羟基醛;二糖和多糖均可水解,常见的二糖有麦芽糖、蔗糖;常见的多糖有淀粉、纤维素,它们是天然高分子化合物。
二、糖类的化学性质:糖类物质主要含羟基和羰基两种官能团,可发生以下几种反应。
1、氧化反应①与氧气反应 如C 6H 12O 6 (s)+ 6O 2(g) →6CO 2(g) + 6H 2O(l) △H =-2804kJ/ mol②被银氨溶液或新制的Cu(OH)2氧化:分子中含醛基的糖(如葡萄糖、麦芽糖)有还原性,均可发生此反应。
如 CH 2OH(CHOH)4CHO + 2Cu(OH)2 →CH 2OH(CHOH)4COOH + Cu 2O ↓ +2 H 2OCH 2OH(CHOH)4CHO + 2[Ag(NH 3)2]OH →CH 2OH(CHOH)4COO NH 4 +2Ag ↓+H 2O +3NH 32、酯化反应:糖类分子中含羟基,故可发生酯化反应,如葡萄糖与乙酸作用生成葡萄糖五乙酸酯、纤维素与硝酸作用生成纤维素硝酸酯。
3、加成反应:糖中含羰基,能与氢氰酸、氨及氨的衍生物、醇等发生加成反应。
4、水解反应:二糖和多糖均可水解。
(C 6H 10O 5)n + nH 2O → n C 6H 12O 6 (催化剂:硫酸)淀粉 (葡萄糖)5、淀粉的特性:遇碘单质变蓝色。
三、氨基酸的结构和性质1、氨基酸的结构:氨基酸是羧酸分子中H 原子被—NH 2取代得到的衍生物,分子中含有氨基—NH 2和羧基—COOH 两种官能团。



5.6 氨基酸、蛋白质的性质一、实验目的1.熟悉蛋白质的化学性质。
2.掌握蛋白质的鉴别方法。
二、实验原理蛋白质是含氮的复杂生物高分子,是由各种L构型的α氨基酸通过肽键相连而成的多聚物,并且具有稳定的构象。
在酸、碱或酶的作用下,单纯蛋白质发生水解,其最终产物是α氨基酸。
1.呈色反应蛋白质中的某些氨基酸的特殊基团可以与特定的化学试剂作用呈现出各种颜色,这种呈色反应可以作为蛋白质或氨基酸的定性检验和定量测定的依据。
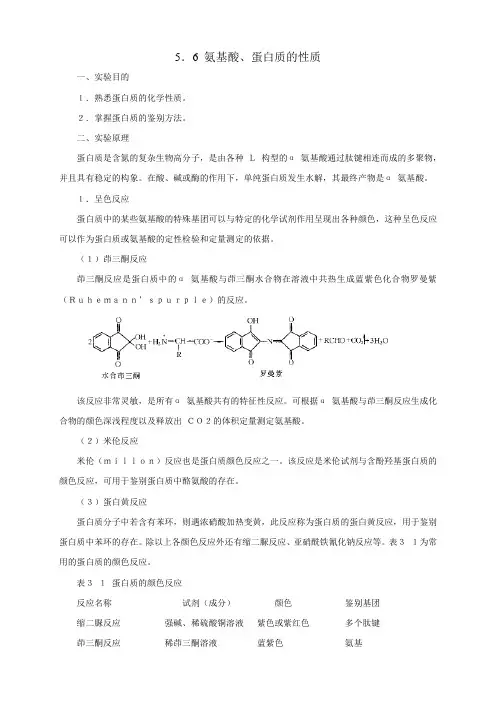
(1)茚三酮反应茚三酮反应是蛋白质中的α氨基酸与茚三酮水合物在溶液中共热生成蓝紫色化合物罗曼紫(Ruhemann’spurple)的反应。
该反应非常灵敏,是所有α氨基酸共有的特征性反应。
可根据α氨基酸与茚三酮反应生成化合物的颜色深浅程度以及释放出CO2的体积定量测定氨基酸。
(2)米伦反应米伦(millon)反应也是蛋白质颜色反应之一。
该反应是米伦试剂与含酚羟基蛋白质的颜色反应,可用于鉴别蛋白质中酪氨酸的存在。
(3)蛋白黄反应蛋白质分子中若含有苯环,则遇浓硝酸加热变黄,此反应称为蛋白质的蛋白黄反应,用于鉴别蛋白质中苯环的存在。
除以上各颜色反应外还有缩二脲反应、亚硝酰铁氰化钠反应等。
表31为常用的蛋白质的颜色反应。
表31蛋白质的颜色反应反应名称试剂(成分)颜色鉴别基团缩二脲反应强碱、稀硫酸铜溶液紫色或紫红色多个肽键茚三酮反应稀茚三酮溶液蓝紫色氨基蛋白黄反应浓硝酸深黄色或橙红色苯环米伦反应汞或亚汞的硝酸盐、亚硝酸盐红色酚羟基亚硝酰铁氰化钠反应亚硝酰铁氰化钠溶液红色巯基2.沉淀反应蛋白质分子末端具有游离的α—NH3+和α—COO-,因此,蛋白质和氨基酸一样,也具有两性解离和等电点的性质。
在等电状态下,蛋白质颗粒容易聚集而析出沉淀;在非等电状态时,蛋白质分子表面总带有一定的同性电荷,由于电荷之间的相互排斥作用阻止蛋白质分子凝聚。
蛋白质是高分子化合物,具有溶胶的一些性质,蛋白质分子表面带有许多极性基团,可与水结合,并使水分子在其表面定向排列形成一层水化膜,这使蛋白质颗粒均匀分散在水中难以聚集沉淀。

氨基酸和蛋白质结构和功能一、组成蛋白质的20种氨基酸的分类1、非极性氨基酸包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸2、极性氨基酸极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸酸性氨基酸:天冬氨酸、谷氨酸碱性氨基酸:赖氨酸、精氨酸、组氨酸其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸属于亚氨基酸的是:脯氨酸含硫氨基酸包括:半胱氨酸、蛋氨酸注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组二、氨基酸的理化性质1、两性解离及等电点氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。
在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
2、氨基酸的紫外吸收性质芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。
3、茚三酮反应氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。
由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。
(注意与实验一结合)三、肽两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。
二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。
10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。
多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。
人体内存在许多具有生物活性的肽,重要的有:谷胱甘肽(GSH):是由谷、半胱和甘氨酸组成的三肽。
半胱氨酸的巯基是该化合物的主要功能基团。
GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。

氨基酸与蛋白质的结构和功能氨基酸和蛋白质是生命体中重要的化学成分。
氨基酸是构成蛋白质的基本单元,蛋白质则是生命体中尤其重要的大分子有机化合物。
蛋白质在人体中扮演着各种关键的生物学功能。
例如,蛋白质可以作为酶、信号传递者、携带氧气或其它物质的运输者、重要的基因调控元件、建立细胞骨架和肌肉纤维等。
此篇文章即将深入探讨氨基酸和蛋白质的结构和生物学功能。
氨基酸的结构和分类氨基酸是一种有机化合物,它包含有一个氨基和一个羧基。
氨基酸的结构是相当标致的,并且可以使用化学公式来表示。
总之,每一种氨基酸都具有一种氨基和一种羧基,另外还具有一种特别分子。
这个分子被称为“侧链”,其作用是不同氨基酸之间的区分和分类。
这个侧链结构决定了氨基酸的生物学性质和特征。
因此,在分类氨基酸时,通常会参考它们侧链的结构来确定它们所属的类别。
从总体上看,氨基酸能够分为两大类:非极性氨基酸和极性氨基酸。
非极性氨基酸的结构一般比较简单,由于它们的侧链结构具有不同程度的疏水性和亲油性,因此通常都藏于蛋白质的内部。
极性氨基酸则具有更加复杂的侧链结构,它们更容易与环境联系,或者与其他分子发生相互作用,从而与生物学功能相关。
蛋白质的结构和功能蛋白质以特定的三维构形形态存在,这种结构有助于蛋白质发挥它的生物学功能。
蛋白质的结构可以分为四个级别:原生结构、次级结构、三级结构和四级结构。
原生结构:原生结构代表着蛋白质刚刚突然保存时的折叠状态。
它代表了一个弯曲的线性结构,能够保障蛋白质分子的稳定性。
原生结构是由不可逆的剪切作用形成的,例如,高温或极端酸碱环境会破坏蛋白质分子的原生结构,这通常称为蛋白质的变性。
次级结构:次级结构主要基于氢键,是由多个氨基酸残基的序列形成的。
这种结构通常有着两个最基本的形式:α-螺旋和β-折叠。
α-螺旋是一种形态较为紧凑的形式,而β-折叠则形成一组平行或反平行的空间结构。
三级结构:三级结构是指由许多次级结构单元组成的多肽链。

有机化学实验教案实验名称:氨基酸和蛋白质的性质11化学班yingshou【实验原理】蛋白质是存在于细胞中的一种含氮的生物高分子化合物,在酸、碱存在下,或受酶的作用,水解成相对分子质量较小的月示、胨、多肽和二羧胡椒嗪,而水解的最终产物为各种氨基酸,其中以α-氨基酸为主。
关于氨基酸和蛋白质的性质我们只做蛋白质的沉淀、蛋白质的颜色反应和蛋白质的分解等性质实验,这些性质有助于认识或鉴定氨基酸和蛋白质。
一、蛋白质的沉淀反应原理:蛋白质是亲水胶体,当其稳定因素被破坏或与某些试剂结合成不溶性盐类后,即自溶液中沉淀析出二、颜色反应原理:蛋白质的呈色反应是指蛋白质所含的某些氨基酸及其特殊结构,在一定条件下可与某些试剂发生了生成有色的物质的反应。
不同蛋白质分子所含的氨基酸残基也是不完全相同,因此所发生的成色反应也不完全一样。
另外呈色反应并不是蛋白质的专一反应,某些非蛋白质类物质(含有-CS-NH、-CH2-NH2、-CRH-NH2、-CHOH-CH2NH2等基团的物质)也能发生类似的颜色反应。
因此,不能仅仅根据呈色反应的结果为阳性就来判断被测物质一定是蛋白质。
三、用碱分解蛋白质原理蛋白质因受某些物理或化学因素的影响,分子的空间构象被破坏,从而导致其理化性质发生改变并失去原有的生物学活性的现象称为蛋白质的变性作用。
【仪器和药品】仪器:试管、量筒、滴管、药品:清蛋白溶液、硫酸铜、碱性醋酸铅、氯化汞、饱和硫酸铵、5%醋酸、饱和苦味酸、饱和鞣酸、1%甘氨酸、络氨酸、色氨酸、茚三酮试剂、浓硝酸、20%氢氧化钠、硝酸汞、30&碱液、10%硝酸铅【实验过程和步骤】1.蛋白质的沉淀(1)用重金属盐沉淀蛋白质取3支试管,标明号码,各盛1mL清蛋白溶液,分别加入饱和硫酸铜、碱性醋酸铅、氯化汞2-3滴(小心有毒),观察有无蛋白质沉淀析出?(2)蛋白质的可逆沉淀取2mL清蛋白溶液,放在试管里,加入同体积的饱和硫酸铵溶液,将混合物稍加振荡,析出蛋白质沉淀使溶液变浑或呈絮状沉淀。


氨基酸和蛋白质的性质一、实验目的:验证氨基酸和蛋白质的某些重要化学性质。
二、实验原理:蛋白质是存在于细胞中的一种含氮的生物高分子化合物,在酸、碱存在下,或受酶的作用,水解成相对分子质量较小的 、胨、多肽和二羧胡椒嗪,而水解的最终产物为各种氨基酸,其中以α-氨基酸为主。
关于氨基酸和蛋白质的性质我们只做蛋白质的沉淀、蛋白质的颜色反应和蛋白质的分解等性质实验,这些性质有助于认识或鉴定氨基酸和蛋白质。
三、实验步骤1.蛋白质的沉淀(1)用重金属盐沉淀蛋白质取3支试管,标明号码,各盛1mL清蛋白溶液,分别加入饱和硫酸铜、碱性醋酸铅、氯化汞2-3滴(小心有毒),观察有无蛋白质沉淀析出?(2)蛋白质的可逆沉淀取2mL清蛋白溶液,放在试管里,加入同体积的饱和硫酸铵溶液,将混合物稍加振荡,析出蛋白质沉淀使溶液变浑或呈絮状沉淀。
将1mL浑浊的液体倾入;另一支试管中,加入1-3mL水,振荡时,蛋白质沉淀是否溶解?(3)蛋白质与生物碱试剂反应取2支试管,各加0.5mL蛋白质溶液,并滴加5%的醋酸使之呈酸性。
然后分别滴加饱和的苦味酸溶液和饱和的鞣酸溶液,直到沉淀发生为止。
2.蛋白质的颜色反应(1)与茚三酮反应在4支试管里,分别加入1%的甘氨酸、酪氨酸、色氨酸和鸡蛋白溶液各1mL,再分别滴加茚三酮试剂2-3滴,在沸水浴中加热10-15min观察有什么现象?(2)黄蛋白反应于试管中加入1-2mL清蛋白溶液和1mL农硝酸,此时呈现白色沉淀或浑浊。
在灯焰上加热煮沸,此时溶液和沉淀是否都呈黄色?有时由于煮沸使析出的沉淀水解,而使沉淀全部或部分溶解,溶液的黄色是否变化?(3)蛋白质的二缩脲反应取1-2mL 20%氢氧化钠溶液放在试管中,再加几滴硫酸铜溶液共热,现象如何?是否由于蛋白质与硫酸铜生成了络合物而呈紫色?取1%甘氨酸溶液作对比试验,此时仅有氢氧化铜沉淀析出。
(4)蛋白质与硝酸汞试剂作用取2mL清蛋白溶液放入试管中,加硝酸汞试剂2-3滴,现象如何?小心加热,此时原先析出的白色絮状是否聚集成块状?并显砖红色,有时溶液也呈红色。
实验一蛋白质与氨基酸的理化性质实验
一、实验目的
1.了解蛋白质和某些氨基酸的颜色反应原理。
2.学习几种常用的鉴定蛋白质和氨基酸的方法。
3.学习蛋白质等电点的测定。
二、蛋白质的盐析与变性
1.原理
在水溶液中的蛋白质分子由于表面生成水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水破坏水化层和双电层而沉淀。
蛋白质的沉淀反应分为可逆反应和不可逆反应两类。
(1)可逆的沉淀反应此时蛋白质分子的结构尚未发生显著变化,除去引起沉淀的因素后,沉淀的蛋白质仍能重新溶解于溶剂中,并保持其天然性质而不变性。
如大多数蛋白质的盐析作用或在低温下用乙醇(或丙酮)短时间作用与蛋白质。
提纯蛋白质时,常利用此类反应分离蛋白质。
(2)不可逆的沉淀反应此时蛋白质分子内部结构发生重大变化,蛋白质常因变性而发生沉淀现象,沉淀后的蛋白质不再复溶于同类的溶剂中,加热引起的蛋白质沉淀与凝固、蛋白质与重金属离子或某些有机酸的反应都属于此类反应。
有时蛋白质变性后,由于维持溶液稳定的条件仍然存在(如电荷层),蛋白质并不絮凝析出。
因此变性后的蛋白质并不一定都表现出沉淀现象。
反之沉淀的蛋白质也未必都已变性。
2.试剂与材料
(1)蛋白质溶液[5%卵清蛋白溶液或鸡蛋清的水溶液 500ml
(新鲜鸡蛋清:水=1:9)]
(2)pH4.7乙酸-醋酸钠的缓冲溶液 100 ml
(3)3%硝酸银溶液 10 ml
(4)5%三氯乙酸溶液 50 ml
(5)95%乙醇 250 ml
(6)饱和硫酸铵溶液 250 ml
(7)硫酸铵结晶粉末 1000g
(8)0.1mol/L盐酸溶液 300 ml
(9)0.1mol/L氢氧化钠溶液 100ml
(10)0.05mol/L碳酸钠溶液 100ml
(11)0.1mol/L乙酸溶液 100ml
(12)2%氯化钡溶液 150 ml
3.实验步骤
(1)蛋白质的盐析加入无机盐(硫酸铵、硫酸钠、氯化钠等)的浓溶液后,蛋白质水溶液溶解度发生变化,过饱和的蛋白质会发生絮凝沉淀,这种加入盐溶液或固体盐能析出蛋白质的现象称为盐析。
加入的盐浓度不同,析出的蛋白质现象也不同,人们常用逐步提高蛋白质溶液中盐浓度的方法,使蛋白质分批沉淀,此类盐析方法称为分段盐析。
例如,球蛋白可在半饱和硫酸铵溶液中析出,而清蛋白则在饱和硫酸铵溶液中才能析出。
通过盐析来制备的蛋白质沉淀物,当加水稀释降低盐类浓度时,它又能再溶解,故蛋白质的盐析作用是一种可逆沉淀过程。
加5%卵清蛋白溶液5ml于试管中,再加等量的饱和硫酸铵溶液,搅拌均匀后静置数分钟则析出球蛋白的沉淀。
倒出少量沉淀物,加少量水,观察是否溶解,试解释实验现象。
将试管内沉淀物过滤,向滤液中逐渐添加硫酸铵粉末,并慢速搅拌直到硫酸铵粉末不再溶解为止(饱和状态),此时析出的沉淀为清蛋白。
取出部分清蛋白沉淀物,加少量蒸馏水,观察沉淀的再溶解现象。
(2)重金属离子沉淀蛋白质重金属离子与蛋白质结合成不溶于水的复合物。
取1支试管,加入蛋白质溶液2ml,再加3%硝酸银溶液1~2滴,震荡试管,观察是否有沉淀产生。
放置片刻,倾去上层清液,加入少量的蒸馏水,观察沉淀是否溶解。
(3)某些有机酸沉淀蛋白质取1支试管,加入蛋白质溶液2ml,再加入1ml5%三氯乙酸溶液,振荡试管,观察沉淀的生成。
放置片刻,倾出上清液,加入少量蒸馏水,观察沉淀是否溶解。
(4)有机溶剂沉淀蛋白质取1支试管,加入2ml蛋白质溶液,再加入2ml95%乙醇。
混匀,观察沉淀的产生。
加入少量的蒸馏水,观察沉淀是否溶解。
三、蛋白质的颜色反应
(1)原理尿素加热至180℃左右,生成双缩脲并放出一份子氨。
双缩脲在碱性环境下能与Cu2+结合生成紫红色化合物,此反应称为双缩脲反应。
因蛋白质分子中有许多肽键,也能发生此反应。
双缩脲反应可用于蛋白质的定性或定量测定。
(2)试剂尿素、10%氢氧化钠溶液、1%硫酸铜溶液、2%卵清蛋白溶液。
(3)实验步骤取少量尿素结晶,放在干燥试管中。
用微火加热使尿素溶化。
溶化的尿素开始硬化时,停止加热,尿素放出氨,形成双缩脲。
冷后,加10%氢氧化钠溶液约1ml,震荡混匀,再加1%硫酸铜溶液1滴,再震荡。
观察出现的粉红颜色。
要避免添加过量硫酸铜,否则,生成的蓝色氢氧化铜能掩盖粉红色。
向另一试管加卵清蛋白溶液约1ml和10%氢氧化钠溶液约2ml,摇匀,再加1%硫酸铜溶液2滴,随加随摇。
观察紫玫瑰色的出现。
2.茚三酮反应
(1)原理除脯氨酸、羟脯氨酸和茚三酮反应产生黄色物质外,所有α-氨基酸及一切蛋白质都能和茚三酮反应生成蓝紫色物质。
虽然蛋白质和氨基酸均有茚三酮反应,但能与茚三酮成阳性反应的不一定就是蛋白质或氨基酸。
在定性、定量测定中,应严防干扰物存在。
在反应十分灵敏,1:1.5×106浓度的氨基酸水溶液即能出现该反应,这是一种常用的氨基酸定量测定方法。
此反应的适宜pH为5~7,同一浓度的蛋白质或氨基酸在不同pH条件下的颜色深浅不同,酸度过大时甚至不显色。
(2)试剂蛋白质溶液100ml、2%卵清蛋白或新鲜鸡蛋清溶液(蛋清:水=1:9)、0.5%甘氨酸溶液10ml、0.1%茚三酮水溶液10ml、0.1%茚三酮-乙醇溶液10ml。
(3)实验步骤取2支试管分别加入蛋白质溶液和甘氨酸溶液1ml,再各加5ml0.1%茚三酮水溶液,均匀,在沸水浴中加热1~2分钟,观察颜色由粉色变紫色再变蓝。
在一小块滤纸上滴1滴0.5%甘氨酸溶液,风干后,再在原处滴一滴0.1%茚三酮-乙醇溶液,在微火旁烘干显色,观察紫红色斑点的出现。
3.黄色反应
(1)实验原理含有苯环结构的氨基酸,如酪氨酸和色氨酸,遇硝酸后,可被硝化成黄色物质,该化合物在碱性溶液中进一步形成深橙色的硝醌酸钠。
多数蛋白质分子含有带苯环的氨基酸,所以有黄色反应。
苯丙氨酸不易硝化,需加入少量浓硫酸才有
(2)试剂鸡蛋清溶液100ml(将新鲜鸡蛋的蛋清与水按1:20混匀,然后用6层纱布过滤)、大豆提取液100ml、头发、指甲、0.5%苯酚溶液50ml、浓硝酸200ml、0.3%色氨酸溶液10ml、3%酪氨酸溶液10ml、10%氢氧化钠溶液100ml。
(3)实验步骤向7个试管中分别按表1加入试剂,观察各管出现的现象,有的试管反应慢可略放置或用微火加热。
待各管出现黄色后,于室温下逐滴加入10%氢氧化钠溶液至碱性,观察颜色变化。
表1
四、蛋白质等电点的测定
(1)原理蛋白质是两性电解质。
蛋白质分子的解离状态和解离程度受溶液的酸碱度影响。
当溶液的pH达到一定数值时,蛋白质颗粒上正负电荷的数目相等,在电场中,蛋白质既不向阴极移动,也不向阳极移动,此时溶液pH成为此种蛋白质的等电点。
不同蛋白质各有其特异的等电点。
在等电位时,蛋白质的理化性质都有变化,可利用此种性质的变化测定各种蛋白质的等电点。
最常用的方法是测其溶解度最低时溶液的pH。
本实验借观察在不同pH溶液中的溶解度以测定酪蛋白的等电点。
用乙酸与醋酸钠(醋酸钠混合在酪蛋白溶液中)配制成各种不同pH的缓冲溶液。
向诸缓冲溶液中加入酪蛋白后,沉淀出现最多的缓冲溶液的pH即为酪蛋白的等电点。
(2)器材水浴锅、温度计、200ml锥形瓶、100ml容量瓶、吸管、试管、试管架、研钵。
(3)试剂 0.4%酪蛋白-醋酸钠溶液200ml、1.00mol/L乙酸溶液100ml、0.10mol/L 乙酸溶液100ml、0.01mol/L乙酸溶液50ml。
0.4%酪蛋白-醋酸钠溶液配制方法:取0.4g酪蛋白,加少量水在研钵中仔细的研磨;将所得的蛋白质悬胶液移入锥形瓶内,用少量40~50℃的温水洗涤研钵,将洗涤液也移入锥形瓶内;加入10ml 1mol/L醋酸钠溶液;把锥形瓶放到50℃水浴中,并小心地旋转锥形瓶,直到酪蛋白完全溶解为止;将锥形瓶内的溶液全部移至100ml容量瓶内,加水至刻度,塞紧玻璃塞,摇匀。
(4)实验步骤
①取同样规格的试管4支,按表2顺序分别精确地加入各试剂,然后混匀。
表2
②在上表的试管中各加酪蛋白-醋酸钠溶液1ml,加一管,摇匀一管。
此时1、2、
3、4管的pH依次为5.9、5.3、4.7、3.5。
观察其混浊度。
静置10min后,再观察其混浊度。
最混浊的一管的pH即为酪蛋白的等电点。
五、实验思考题
1.何谓蛋白质的沉淀作用?可逆沉淀与不可逆沉淀的主要区别是什么?
2.茚三酮反应的条件有哪些?若实验时未得到阳性结果,其原因可能是什么?
3.如果蛋白质的水解作用一直进行到双缩脲反应成阴性结果,能对此现象作何结论?
4.测定蛋白质的等电点为什么应在缓冲溶液中进行?在本实验中,根据蛋白质的什么
性质测定其等电点?
5.蛋白质沉淀现象与无机盐沉淀有何不同?沉淀出现速度是快或是慢?。