第2节 物质转化的规律2
- 格式:doc
- 大小:47.08 KB
- 文档页数:2
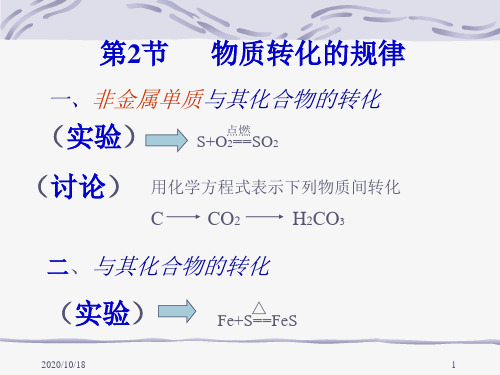




第2节 单质、氧化物、酸、碱、盐相互转化规律知识回顾各物质都具有一定的性质,同时各物质之间都相互联系,即有一定的相互转化规律。
1.金属(1)与氧气反应生成金属氧化物。
如:MgO O Mg 222点燃+;CuO O Cu 222∆+(2)活泼金属与酸反应生成盐和氢气。
如:↑+==+2442H FeSO SO H Fe ;↑+==+222H MgCI HCI Mg 金属与盐溶液反应生成新盐和新金属。
如:44FeSO Cu CuSO Fe +==+;Ag NO Cu Cu AgNO 2)(2233+==+。
2.非金属(1)与氧气反应生成非金属氧化物。
如:O H O H 22222点燃+;22SO O S 点燃+(2)与金属反应生成无氧酸盐。
NaCI CI Na 222点燃+;FeS S Fe ∆+3.碱性氧化物(1)与水反应生成碱。
如:22)(OH Ca O H CaO ==+。
(2)与酸反应生成盐和水。
如:O H SO Fe SO H O Fe 234242323)(3+==+(3)与酸性氧化物反应生成含氧酸盐。
如:32CaSiO SiO CaO 高温+4.酸性氧化物(1)与水反应生成酸。
如:3222CO H O H CO ==+。
(2)与碱反应生成盐和水。
如:O H CaCO OH Ca CO 2322)(+↓==+(3)与碱性氧化物反应生成含氧酸盐。
如:32CaSiO SiO CaO 高温+5.酸(1)与活泼金属反应生成盐和氢气。
如:↑+==+2442H ZnSO SO H Zn(2)与碱性氧化物反应生成盐和水。
如:O H FeCI HCI O Fe 2332326+==+。
(3)与碱反应生成盐和水。
如:4224222SO Na O H NaOH SO H +==+(4)与某些盐反应生成新盐和新酸。
如:33HNO AgCI AgNO HCI +↓==+6.碱(1)与酸性氧化物反应生成盐和水。
如: O H SO Na SO NaOH 2+==+(2)与酸反应生成盐和水。
第二节物质转化的规律姓名:日期:【教材知识全解】一.物质的转化规律:1.金属+氧==金属氧化物①钠放置在空气中。
现象:银白色逐渐退去。
反应:4Na+O2 ==②镁条燃烧。
现象:,反应:2Mg+O2③加热金属铝片。
现象:铝箔熔化,失去光泽,熔化的铝并不滴落,产生这一现象的原因是:铝表面生成了氧化铝薄膜,构成薄膜的氧化铝的熔点高于金属铝的熔点,包在铝的外面,所以熔化的液态铝不会落下来。
反应:4Al+3O2④铝在空气中生锈:4Al+3O2 == Al2O3是一层极薄的物,可阻碍反应的进行。
⑤铁丝在氧气中燃烧。
现象:,反应:3Fe+2O2。
铁钉在空气中生锈。
现象:,反应:4Fe+3O2= 。
相关知识点:(1)铁生锈的条件:、(2)Fe可做中的抗氧化剂(去除)。
⑥加热金属铜丝。
现象:。
反应:2Cu+O2== .2.+还原剂=金属+非金属氧化物①2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2FeO3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2;现象:总结:金属与金属氧化物之间的转换①活泼金属在空气中易与氧气反应,表面生成一层氧化物。
有的氧化膜疏松,不能保护内层金属,如:;有的氧化膜致密,可以保护内层金属不被继续氧化,如:表面的氧化层。
在点燃镁条或铝片前,常用砂纸镁条或铝片。
②除Ag、Pt、Au外的金属, 一般都可与氧气发生化合反应, 金属越活泼与氧化合就越容易, 反应就越剧烈。
生成氧化物的特点是绝大部分反应的结果多为热量,的热量愈大,则生成的氧化物愈稳定。
金属氧化物大多数是性氧化物。
③金属氧化物热还原反应指的是金属氧化物(如Fe2O3、CuO等)在加热或者更高的温度条件下,用一些还原剂(如:)将氧化物中的金属元素以单质形式还原出来的反应。
Ⅱ、物质转化规律:一、物质转化规律图:(一)化合反应:由两种或两种以上的物质生成另一种物质的化学反应。
A +B → C%①非金属 + O2 →非金属氧化物1、碳在氧气中充分燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO23、磷在氧气中燃烧:4P+5O2=点燃=2P2O54、氢气在氧气中燃烧:2H2+O2=点燃=2H2O5、碳在空气中不充分燃烧:2C+O2=点燃=2CO%②金属 + O2 →金属氧化物1、镁在空气中燃烧:2Mg+O2=点燃=2MgO2、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O43、铜在空气中加热:2Cu+O2=△=2CuO%③非金属氧化物+H2O →含氧酸1、二氧化碳与水反应:CO2+H2O==H2CO32、二氧化硫溶于水:SO2+H2O==H2SO33、三氧化硫溶于水:SO3+H2O==H2SO4%④金属氧化物+ H2O →可溶性碱1、氧化钠溶于水:Na2O+H2O==2NaOH2、生石灰和水化合:CaO+H2O==Ca(OH)2%㈠金属 + 非金属→无氧酸盐1、铁与氯气反应:2Fe+3Cl2=点燃=2FeCl 32、铁与硫反应:Fe+S=△=FeS%㈡金属氧化物+ 非金属氧化物→含氧酸盐1、生石灰和二氧化硅化合:CaO+SiO2== CaSiO3其它化合反应:1、一氧化碳在空气中燃烧:2CO+O2=点燃=2CO22、二氧化碳通过灼热的碳层:CO2+C=高温=2CO3、氢气在氯气中燃烧:H2+Cl2=点燃=2HCl(二)分解反应:由一种物质生成两种或两种以上其它物质的化学反应。
C → A + B%⑤酸分解酸→酸性氧化物+ H2O1、碳酸不稳定分解:H2CO3==H2O+CO2↑%⑥碱分解不溶性碱→碱性氧化物+ H2O1、氢氧化铜受热分解:Cu(OH)2=△=CuO+H2O氧化物分解:1、电解水:2H2O=通电=2H2↑+O2↑盐分解:1、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑2、氯酸钾受热分解(实验室制O2):2KClO3=(MnO2△)=2KCl+3O2↑3、加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2↑4、高温煅烧石灰石:CaCO3=高温=CaO+CO2↑5、硫酸铜晶体受热失去结晶水:CuSO4·5H2O=△=CuSO4+5H2O(三)置换反应:由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应。
第2节物质转化的规律2
一、夯实基础
1、根据金属单质与其化合物的转化图,完成以下试题。
⑴书写右测物质转化的化学方程式:Ca→ CaO→Ca(OH)2→ CaCO3
;;。
⑵请书写右侧物质转化的化学方程式:Cu→CuO→CuSO4→Cu(OH)2→CuO
;;
;。
⑶请写出由氢氧化钠转化成碳酸钠的3种方法的化学方程式。
(要求:原理不能重复)
;;。
⑷请写出右图中的物质转化的化学方程式。
①;
②;
③;
④;
⑤;
⑥;
⑦。
2、取少量铁粉放在白纸上,观察到铁粉呈_____色。
取少量淡黄色的硫粉与铁粉混合,用磁铁接近混合物,你看到什么现象:___________________ 。
将混合物放进试管内,用酒精灯加热,有什么现象:
__________________ 。
生成物外观如何?_____________。
磁铁能否吸引生成物?____________。
用化学方程式:______________________________。
3、我们已经知道钠能在氯气中燃烧生成氯化钠,。
其实很多金属都能在氯气中燃烧,请写出铁、铜分别在氯气中燃烧的化学方程式。
;;
4、在蒸发皿中放1小块生石灰,加水搅拌,实验现象是_____________________________。
反应化学方程式为:________________________,它属于_____反应类型。
其实可溶性碱对应的金属氧化物都能与水发生反应,请写出氧化钠、氧化钾分别与水反应的化学方程式:
;。
二、提升训练
5、许多物质都能与水发生反应,下列物质中,不能直接与水反应制取的是( )
A、H2SO4
B、NaOH
C、H2CO3
D、Fe(OH)3
6、下列式子不能通过一步反应实现的是:()
A、CuO→Cu(OH)2
B、BaCl2→Ba(NO3)2
C、Cu(OH)2→CuCl2
D、Fe→FeCl3
7、能用金属与稀盐酸直接反应制取的盐是()
A、CuCl2
B、AgCl
C、MgCl2
D、FeCl3
8、符合下列转化关系的物质是( )
甲 乙 丙 丁 甲 A 、Cu B 、CuO C 、Fe 2O 3 D 、Mg
9、下列框图中的物质均为初中科学常见物质,其中A 是大理石的主要成分,下图是它们之间的相互转化
关系。
请回答:
请推测ABCD 各是什么物质?(写化学式)A 、B 、C 、D 。
写出物质D→A 过程的化学方程式 ;其所属基本反应类型是 。
三、扩展延伸
10、如图是“×××”钙片商品标签图。
根据标签信息完成下列两题。
1)、主要成分碳酸钙的相对分子质量为 ;
每片中至少含钙元素的质量为 g.
2)、小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g ,称量烧杯中剩余物质量为47.8g (不含烧杯质量,假定钙片其它成分不与盐酸反应。
)求:
(1)生成二氧化碳的质量。
(2)稀盐酸中溶质的质量分数。
(3)通过计算判断钙片中碳酸钙的含量标注是否属实。
+盐酸 +硝酸银溶液+铁 +氧气 适量Na 2CO 3溶液 高温 A 无色气体B C D
加H 2O ×××
儿童咀嚼片
(60片装)
[主要成分]碳酸钙、维生素D [功 效]补钙 [规 格]2.5g/片 每片中含:
碳酸钙≥1.24g
维生素D100ID
[食用方法]嚼食.日1片。