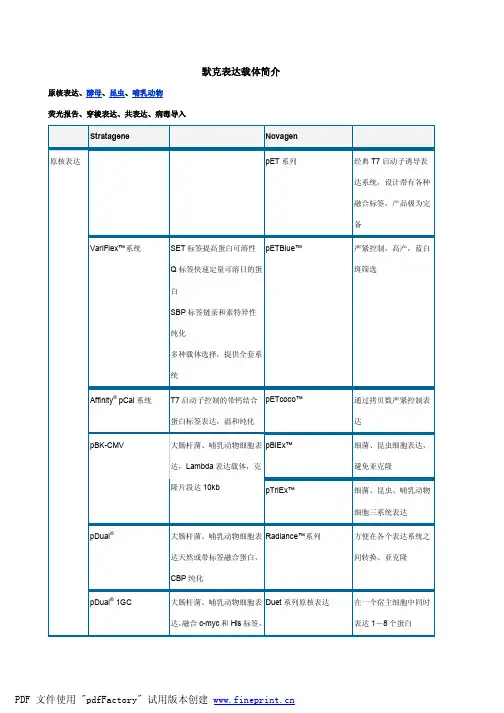
默克密理博Novagen重组蛋白表达技术平台
- 格式:pdf
- 大小:3.91 MB
- 文档页数:48

德国默克分子生物学技术介绍原核系统重组蛋白表达技术何煜 Allen He2009.0921-Sep-09Page 1• 重组蛋白: 重组蛋白:• • • 抽提、纯化、去标签、鉴定 蛋白重折叠(复性) 高通量表达-纯化-分析 膜蛋白抽提,亚细胞分部收集 去除高丰度蛋白等 抑制剂混和物、蛋白定量、电洗脱、 透析/浓缩 、自动诱导发酵培养基等• 天然蛋白• •• 蛋白研究配套产品蛋白抽提、 蛋白抽提、纯化与分析——蛋白研究工具产品手册 蛋白研究工具产品手册第二版• •Novagen® – pET · 蛋白研究专家21-Sep-09 Page2Strategies For Enhanced Solubility & Yield of Proteins Expressed in E.coli• Part 1: • Choosing a vector and cloning strategy • Part 2: • Selection of host and optimization of expression • Part 3: • Maximizing target protein recoveryNovagen® – pET · 蛋白研究专家21-Sep-09 Page3Bacterial Protein ExpressionVectorHostGrowth conditionsNovagen® – pET · 蛋白研究专家21-Sep-09 Page4Choices for Expression Plasmids• Level of control and expression • Antibiotic selection • Tag • Solubility • Protease recognition site • Copy numberNovagen® – pET · 蛋白研究专家21-Sep-09 Page5Novagen® – pET · 蛋白研究专家21-Sep-09 Page6关于载体的进展• 新的克隆方法: 新的克隆方法:更适合高通量操作• 新的启动子: 新的启动子:更高产, 更高产,多系统穿梭表达• 新的复制子: 新的复制子:多载体/多蛋白共表达 多载体 多蛋白共表达• 新的融合标签更好的纯化、可溶性、 更好的纯化、可溶性、检测• 新的蛋白酶切: 新的蛋白酶切:特异性更好, 特异性更好,更温和Novagen®21-Sep-09– pET · 蛋白研究专家Page7LIC cloning method1.Amplify target protein using any thermostable DNA polymerase and special primers2.Treat 50 min; PCR product, T4 DNA polymerase, and dATP3. 4. 5. Novagen® – pET · 蛋白研究专家21-Sep-09Anneal 5 min, then add EDTA Transform using NovaBlue GigaSingles™ Competent Cells PlatePage8Gateway® Nova DEST™ Vectors • • • • • •Universal cloning method based on bacteriophage lambda site-specific recombination. Rapid, efficient way to move DNA sequences into multiple systems for protein expression. Intermolecular DNA recombination is mediated by a mixture of lambda and E.coli-encoded recombination proteins (i.e. ClonaseTM II Enzyme Mix). Recombination occurs between specific attachment (att) sites on interacting DNA molecules. Recombination is conservative and requires no DNA synthesis. After recombination, att sites are hybrids of sequences donated by each parental vector.Novagen® – pET · 蛋白研究专家21-Sep-09Page9Gateway® Nova DEST™ Vectors•Two recombination reactions constitute basic Gateway® TechnologyattBGENEattBattPattPattLGENEattLattRattRccdB + CamccdB + Camusually attB-flanked PCR Product+pDONR Donor vectorBP ClonaseTM IIpENTR Entry clone+By-productattLGENEattLattRattRattBGENE LR ClonaseTM IIattBattPattPccdB + CamccdB + CampENTR Entry clone+pDEST Destination VectorpEXPR Expression clone+By-productNovagen® – pET · 蛋白研究专家21-Sep-09 Page10Novagen® – pET · 蛋白研究专家21-Sep-09 Page11Novagen® – pET · 蛋白研究专家21-Sep-09 Page12Novagen® – pET · 蛋白研究专家21-Sep-09 Page13Novagen® – pET · 蛋白研究专家21-Sep-09 Page14Solubility tags• Secretion signal– pelB leader (22 amino acids) – ompT leader (20 amino acids)• Fusion to enzyme which promotes disulfide bonds– oxido reductase (208 amino acids, DsbA gene product) – disulfide isomerase (236 amino acid, DsbC gene product) – thioredoxin (109 amino acids)• Fusion to highly soluble protein– glutathione S-transferase (220 amino acids) – NusA gene product (495®amino acids)21-Sep-09Novagen – pET · 蛋白研究专家Page15Novagen® – pET · 蛋白研究专家21-Sep-09 Page16University of Oklahoma School of Chemical Engineering and Materials Science Recombinant Protein Solubility PredictionSubmit Query ResetType (or cut and paste) your protein sequence below, click on the "Submit" button, and the solubility probability of your protein will be calculated. The statistical model predicts protein solubility assuming the protein is being overexpressed in Escherichia coli. If there are numbers, spaces, or other characters in your sequence, don't worry, they won't affect the calculation. For more information on the solubility model used here, see the references below. References: •R.G. Harrison. 2000. Expression of soluble heterologous proteins via fusion with NusA protein. inNovations. 11:4-7. PDF file •Davis, G.D., Elisee, C., Newham, D.M. and R.G. Harrison. 1999. New fusion protein systems designed to give soluble expression in Escherichia coli. Biotechnol. Bioeng. 65(4):382-8. PubMed Abstract •Wilkinson, D.L. and R.G. Harrison. 1991. Predicting the solubility of recombinant proteins Novagen® – pET · PubMed Abstract in Escherichia coli. Bio/Technology. 9: 443-448.蛋白研究专家21-Sep-09 Page17Improving solubility of IL-3Novagen® – pET · 蛋白研究专家21-Sep-09 Page18Single plasmid for co-expressionNovagen® – pET · 蛋白研究专家21-Sep-09 Page19Expression systems repliconsNovagen® – pET · 蛋白研究专家21-Sep-09 Page20。





【专题讨论】原核表达条件优化!之所以首先介绍Novagen公司的产品是因为用过它的pET系列载体,感觉很好用。
Novagen的母公司是德国默克(Merck)公司,它是国际著名的化学及制药公司总部位于德国的Darmstadt,已有300多年的历史。
已在全世界55个主要国家设立了分公司,其中在28个国家建有62个生产基地。
Novagen公司出品的pET系列载体是目前应用最为广泛的原核表达系统,已经成功地在大肠杆菌中表达了各种各样的异源蛋白。
pET系列载体是利用大肠杆菌T7噬菌体转录系统进行表达的载体,其表达原理见下图。
T7噬菌体具有一套专一性非常强的转录体系,利用这一体系中的元件为基础构建的表达系统称为T7表达系统。
T7噬菌体基因编码的T7RNA聚合酶选择性的激活T7噬菌体启动子的转录。
它是一种高活性的RNA 聚合酶,其合成mRNA的速度比大肠杆菌RNA聚合酶快5倍左右。
并可以转录某些不能被大肠杆菌RNA聚合酶有效转录的序列。
在细胞中存在T7 RNA聚合酶和T7噬菌体启动子的情形下,大肠杆菌宿主本身基因的转录竞争不过T7噬菌体转录体系,最终受T7噬菌体启动子控制的基因的转录能达到很高的水平。
T7噬菌体启动子的转录完全依赖于T7 RNA聚合酶,因此T7 RNA聚合酶的转录调控模式就决定了表达系统的调控方式。
噬菌体DE3是λ噬菌体的衍生株,一段含有lacⅠ,lacUV5启动子和T7 RNA聚合酶基因的 DNA片段倍插入其int基因中,用噬菌体DE3的溶源菌,如BL21(DE3)、 HMS174(DE3)等作为表达载体的宿主菌,调控方式为化学信号诱导型,类似于Lac表达系统。
从开始涉及表达的时候可以根据是否要用基因本身的起始密码子进行选择,Novagen公司仅提供三个载体:pET-21(+),pET-24(+)和pET-23(+)。
如果你打算利用载体的起始密码子,那么就有许多选择。
根据是否要可溶性表达,选择加有不同标记的载体。

生物技术进展2016年㊀第6卷㊀第3期㊀219~223CurrentBiotechnology㊀ISSN2095 ̄2341研究论文Articles㊀收稿日期:2016 ̄03 ̄10ꎻ接受日期:2016 ̄04 ̄04㊀作者简介:刘晓航ꎬ中级工程师ꎬ主要从事生物制品的技术研究ꎮTel:010 ̄68727127ꎮE ̄mail:liuxiaohang518@sohu.com重组人长效促卵泡激素FSH ̄CTP的纯化工艺研究及鉴定刘晓航ꎬ㊀高丽婷北京双鹭药业股份有限公司ꎬ北京100143摘㊀要:为了获得高纯度的重组人长效促卵泡激素FSH ̄CTPꎬ收集表达FSH ̄CTP的CHO细胞培养上清ꎬ经过染料亲和层析㊁DEAE阴离子交换层析以及疏水层析三步层析制备ꎬ所得样品进行分子量㊁等电点测定和WesternBlot鉴定ꎬ雌性大鼠卵巢增重法测定体内生物活性ꎮ结果显示:经3步纯化所得样品纯度可达98%以上ꎬ表观分子量约为47kDaꎬMALDI ̄TOF ̄MS测得结果为35.2kDaꎬ等电点4.0~2.8ꎬWesternBlot结果呈阳性ꎬ测活结果表明ꎬFSH ̄CTP的活性比重组人卵泡刺激素明显偏高ꎮ纯化所得样品纯度良好ꎬ为该药物的进一步研究打下了基础ꎮ关键词:不孕不育症ꎻFSH ̄CTPꎻ分离纯化ꎻ雌性大鼠卵巢增重法DOI:10.3969/j.issn.2095 ̄2341.2016.03.12ResearchandAppraisalonPurificationProcessofRecombinantHumanLong ̄actingFollicleStimulatingHormone㊀LIUXiao ̄hangꎬGAOLi ̄tingBeijingSLPharmaceuticalCo.Ltd.ꎬBeijing100143ꎬChinaAbstract:Toobtainhighpurityrecombinanthumanlong ̄actingfolliclestimulatinghormoneFSH ̄CTPꎬthestudycollectedtheCHOcellsculturesupernatantcontainedFSH ̄CTPꎬthenitwaspuriedbydyeaffinitychromatographyꎬDEAEanionexchangechromatographyandhydrophobicinteractionchromatography.Wedetectedthepuriedsamplesbymolecularweightꎬisoelectricpointꎬbiologicalactivityinvitro(WesternBlot)andbiologicalactivityinvivo(ovarianweightgaininfemaleratslaw).Theresultsshowedthat:ThepurityofFSH ̄CTPproteincouldreach98%afterthreesteptpurificationꎬtheapparentmolecularweightwasabout47kDaꎬMALDI ̄TOF ̄MSresultwas35.2kDa.Theresultsofisoelectricpointwas4.0~2.8.AndweprovidedtheFSH ̄CTPactivitywashigherthanrecombinanthumanfolliclestimulatinghormonesignificantlybyWesternBlotanalysis.ThepurificationandactivityofFSH ̄CTPwashigh.Theresultscouldlaythefoundationforfurtherstudyofthedrug.Keywords:infertilityꎻFSH ̄CTPꎻisolationandpurificationꎻovarianweightincreaseinfemalerat㊀㊀不孕不育症是影响人类健康幸福的重大疾病ꎮ据不完全统计ꎬ在我国育龄夫妇中ꎬ不孕不育率达10%ꎮ卵泡刺激素(folliclestimulatinghor ̄moneꎬFSH)是一种异源二聚体糖蛋白类促性腺激素[1]ꎬ是目前市场上常见的用于治疗不孕不育症的主要药物之一ꎮ但是由于其生物半衰期较短ꎬ患者需要在一个治疗周期内连续两周每天注射1~2针市售FSH制剂ꎬ患者依从性较差ꎮ因此开发长效FSH制剂成为本领域的研究热点ꎮFSH ̄CTPꎬ即CorifollitropinAlfaꎬ2010年由Merck公司开发上市[2]ꎮ通过基因重组技术ꎬ人绒毛膜促性腺激素(humanChorionicGonadotropinꎬhCG)β亚基的羧基末端肽(carboxylterminalpeptideꎬCTP)序列与FSHβ亚基cDNA3ᶄ端相融合ꎬ与FSHα亚基cDNA共同转染CHO细胞ꎬ二者共表达形成二聚体分泌至胞外ꎬ即为FSH ̄CTPꎮ成熟FSH ̄CTP的α㊁β亚基分别由92个和139个氨基酸组成ꎬ两条链通过非共价键结合形成异二聚体[3ꎬ4]ꎮ其中α亚基有2个N ̄连接糖基化位点:α ̄52和α ̄78ꎬβ亚基有2个N ̄连接. All Rights Reserved.糖基化位点:β ̄7㊁β ̄24ꎬ及4个均位于CTP部分的O ̄连接糖基化位点:β ̄115㊁β ̄121㊁β ̄126和β ̄132[5]ꎮ由于CTP序列的引入ꎬFSH ̄CTP的体内半衰期较重组人卵泡刺激素(recombinanthumanFSHꎬrhFSH)明显延长ꎬ体内生物活性也大大提高ꎮ注射一针推荐剂量的FSH ̄CTP可以代替连续7d每天注射rhFSHꎮ目前国内还没有长效FSH产品上市ꎬ国内研究也主要集中在FSH品种上面ꎬ对长效FSH的报道很少ꎬ因此长效FSH药物的开发是目前研究的重点和难点ꎮ刘志勇等[6]用染料Sepharose4B为亲和层析介质进行纯化得到FSH的活性收率达80%ꎮrhFSH中存在唾液酸ꎬ等电点为4.0~5.5ꎬ采用阴离子交换层析可实现rhFSH的纯化ꎮ长效FSH和rhFSH的结构相似ꎬ可以参考FSH的纯化方法ꎮ为了推进该产品的国产化ꎬ本实验室前期构建了表达FSH ̄CTP的CHO工程细胞ꎬ并初步研究了其发酵工艺ꎮ本研究通过3步层析法对细胞培养上清进行分离纯化ꎬ并对所测的样品进行初步鉴定ꎬ以期为长效FSH药物的开发提供参考ꎮ1㊀材料与方法1.1㊀实验材料1.1.1㊀仪器㊀层析柱(上海锦华层析设备厂)㊁紫外检测仪(北京宾达英创科技有限公司)㊁AKTAPurifier900(GEHealthcare)㊁酶标仪(MolecularDevices)㊁电泳仪(北京市六一仪器厂)等ꎮ1.1.2㊀主要试剂㊀BlueSepharoseTM6FastFlow㊁DEAESepharoseFastFlow购自美国GE公司ꎻButyl ̄650M购自日本TOSOH公司ꎻ低分子量蛋白Marker㊁预染低分子量蛋白Marker购自北京索莱宝科技公司ꎻ鼠抗人FSHα抗体㊁辣根过氧化物酶标记的鼠抗人FSHβ抗体㊁辣根过氧化物酶标记兔抗鼠IgG抗体购自美国USB公司ꎻrHCG注射液购自MerckSerono公司ꎻrhFSH国际标准品购自中国食品药品检定研究院ꎻrhFSH注射液由北京双鹭药业提供ꎻ其余试剂均为国产分析纯ꎮFSH ̄CTP细胞发酵液7L艾贝泰生物反应器发酵获得ꎬ由北京双鹭药业股份有限公司提供ꎮ1.1.3㊀实验动物㊀日龄19~23dꎬ体重35~50gꎬ同一来源的雌性SD大鼠ꎬ健康合格ꎬ由中国军事医学科学院提供ꎮ1.2㊀实验方法1.2.1㊀FSH ̄CTP的分离纯化㊀①染料亲和层析ꎮFSH ̄CTP发酵液下罐收获5Lꎬ经8000r/min离心10min后ꎬ再经0.22μm微孔滤膜过滤ꎮ将样品上样至已经用缓冲液20mmol/LPB(pH7.4)平衡好的BlueSepharoseTM6FastFlow染料亲和层析柱ꎬ用含一定浓度NaCl的20mmol/LPB(pH7.4)缓冲液洗脱目的蛋白ꎬ收集洗脱峰[7]ꎮ②DEAE阴离子交换层析ꎮ将BlueSepharoseTM6FastFlow染料亲和层析柱洗脱的样品进行脱盐ꎬ调节样品的电导和平衡缓冲液一致ꎬ上样至用缓冲液20mmol/LPB(pH7.4)平衡好的DEAE阴离子交换柱ꎬ用NaCl溶液洗脱ꎬ收集洗脱峰ꎮ③Butyl ̄650M疏水层析ꎮDEAE阴离子交换收集的样品中补加NaCl调节电导ꎬ上样至用缓冲液2.0mol/LNaCl ̄20mmol/LPB(pH7.4)平衡好的Butyl ̄650M疏水层析柱ꎬ以20mmol/LPB(pH7.4)缓冲液进行洗脱ꎬ收集洗脱峰ꎮ所得样品进行SDS ̄PAGE纯度分析ꎮ④蛋白回收率测定ꎮ采用Elisa双抗体夹心法ꎬ一抗为鼠抗人FSHα抗体ꎬ二抗为辣根过氧化物酶标记的鼠抗人FSHβ抗体ꎬ标准品采用FSH ̄CTP经凯氏定氮法含量标定的纯品ꎬ经一抗包被㊁封闭㊁加样㊁二抗孵育㊁显色和终止ꎬ在450nm处比色ꎬ根据标准曲线计算纯化过程中每步的蛋白含量ꎬ结合体积计算每步回收率ꎮ1.2.2㊀FSH ̄CTP的鉴定㊀①表观分子量及等电点测定ꎮ表观分子量测定和等电点测定按照«中国药典»第三部进行[8ꎬ9]ꎮ②MALDI ̄TOF ̄MS测定分子量ꎮ样品制备:将FSH ̄CTP样品用水透析过夜ꎬ并浓缩至约2mg/mLꎮ样品移交清华生物医学测试中心蛋白化学平台进行分子量测定ꎮ③WesternBlot鉴定ꎮ样品进行SDS ̄PAGE(胶浓度为12%)分析后ꎬ用半干法进行电转移至硝酸纤维素膜上ꎻ用3%小牛血清进行封闭ꎻ加入一抗鼠抗人FSHα抗体2μg/mLꎬ室温下孵育2hꎻ弃掉一抗ꎬ洗膜3次ꎻ加入稀释5000倍的辣根过氧化酶标记的兔抗鼠二抗ꎬ室温孵育2hꎻ弃掉二抗ꎬ洗膜3次ꎻ用邻苯二胺显色液显色ꎻ待出022生物技术进展CurrentBiotechnology. All Rights Reserved.现棕黄色时ꎬ加入2mol/LH2SO4终止反应ꎮ④体内生物活性检测ꎮ将rHCG注射液溶于pH7.21mg/mL的牛血清白蛋白生理盐水溶液中ꎬ配成含HCG26.6IU/mL的溶媒ꎬ备用ꎮ用溶媒将rhFSH标准品稀释为3.0IU/mL㊁1.5IU/mL和0.75IU/mL3个剂量组ꎬ分别记为SH㊁SM㊁SLꎻ将rhFSH对照及FSH ̄CTP3个样品按估计效价13000IU/mg稀释为3.0IU/mL㊁1.5IU/mL㊁0.75IU/mL3个剂量组ꎬ分别记为TH㊁TM㊁TLꎮ取大鼠120只ꎬ随机分为15组ꎬ每组8只ꎮ于每天同一时间ꎬ给每组大鼠颈部皮下注射ꎬ分别给予一种剂量的溶液0.5mLꎬ每日一次ꎬ连续3dꎮ于最后一次给药24h后处死大鼠ꎬ解剖ꎬ摘取双侧卵巢ꎬ剥离附着组织ꎬ卵巢称重ꎮ以卵巢重为反应值ꎬ按量反应平行线3.3法计算效价ꎬFL%应<45%ꎮ2㊀结果与分析2.1㊀纯度分析纯度分析结果如图1所示ꎮ经软件纯度扫描分析ꎬBlue柱洗脱液的纯度为64%ꎬ说明染料亲和层析能够特异吸附FSH ̄CTP蛋白ꎬ纯化效果明显ꎬ去除大部分的杂蛋白ꎬ回收率高ꎬ可作为样品捕获ꎻ唾液酸含量高低影响样品的等电点ꎬFSH ̄CTP等电点低于FSHꎬ也属于酸性蛋白ꎬ可选用阴离子交换层析分离ꎬDEAE柱流穿液的纯度为74%ꎬ可进一步去除部分杂蛋白ꎻButyl ̄650M柱洗脱液电泳显示无明显杂带ꎬ去除了蛋白的解离亚基ꎬ电泳纯度可认为是100%ꎮ图1㊀样品纯化的检测结果Fig.1㊀DetectionofFSH ̄CTPpurification.M:蛋白Markerꎻ1:细胞培养上清ꎻ2:Blue层析洗脱液ꎻ3:DEAE层析流穿液ꎻ4:Butyl ̄650M层析洗脱液2.2㊀回收率分析按1.2.1中的纯化方法得到FSH ̄CTP3批样品分别记为样品1㊁样品2和样品3ꎮ3批样品的回收率如表1ꎮ对比3批的实验结果ꎬ目的蛋白表达量稳定ꎬ目的蛋白的回收率为20%左右ꎬ验证此工艺可行ꎬ可为工艺的生产放大提供依据ꎮ表1㊀FSH ̄CTP样品的回收率Table1㊀ThepurificationresultsofFSH ̄CTP.FSH ̄CTP样品表达量(mg/L)染料亲和层析回收率CaptoAdhere层析回收率Butyl ̄650M疏水层析回收率总回收率样品1113.074%69%43%22.0%样品2126.072%70%41%20.7%样品3106.578%65%39%19.8%2.3㊀分子量测定表观分子量测定结果如图2所示ꎮ软件分子量扫面分析ꎬFSH ̄CTP样品1的分子量为47.2kDaꎬ样品2的分子量为46.9kDaꎬ样品3的分子量为47.1kDaꎬFSH ̄CTP完整蛋白的分子量与文献报道47kDa相当ꎮ2.4㊀MALDI ̄TOF ̄MS测定分子量FSH ̄CTP的分子量为35.2kDaꎬ其中α亚基为14kDaꎮ据文献报道ꎬFSH的α亚基分子量为14kDaꎬFSH ̄CTP的α亚基与FSH相同ꎬ因此该结果与文献报道相符ꎮ而文献报道FSH ̄CTP的分子量约为38kDa[10]ꎬ该结果比文献报道的分子量略微偏小ꎬ可能是由于糖基脱落或糖基化程度偏小所致[11]ꎮ2.5㊀等电点测定如图3所示ꎬFSH ̄CTP3批等电点为4.0~2.8ꎬ而文献报道rhFSH的等电点为5.0~4.0[12]ꎮ由于FSH ̄CTP比rhFSH多了4个糖基化位点ꎬ糖122刘晓航ꎬ等:重组人长效促卵泡激素FSH ̄CTP的纯化工艺研究及鉴定. All Rights Reserved.基化程度比rhFSH高ꎬ应比rhFSH偏酸ꎮ上述结果与理论相符ꎮ图2㊀FSH ̄CTP样品12%电泳结果Fig.2㊀DetectionofFSH ̄CTPby12%SDS ̄PAGE.M:蛋白Markerꎻ1:样品1ꎻ2:样1亚基ꎻ3:样品2ꎻ4:样品2亚基ꎻ5:样品3ꎻ6:样品3亚基图3㊀等电聚焦结果Fig.3㊀Theresultofisoelectricfocusing.M:蛋白Markerꎻ1:FSH ̄CTP20140212批ꎻ2:FSH ̄CTP20140401批ꎻ3:FSH ̄CTP20140516批2.6㊀WesternBlot鉴定如图4(彩图见图版三)所示ꎬWesternBlot结果显阳性ꎬ显色反应刚好出现在43.0kDa左右位置ꎬ说明FSH ̄CTP可以和抗FSHα抗体特异性结合ꎮ图4㊀免疫印迹结果Fig.4㊀TheresultofWesternBlot.M:蛋白Markerꎻ1:FSH ̄CTP样品1ꎻ2:FSH ̄CTP样品2ꎻ3:FSH ̄CTP样品3(彩图见图版三)2.7㊀体内生物活性分析所有数据SPSS软件ꎬ进行方差齐性检验ꎬ结果表明各组间方差齐性满足方差分析的前提条件ꎻ利用One ̄wayANOVA(单因素ANOVA)分别对高㊁中㊁低剂量组进行方差分析:高㊁中㊁低剂量组结果一致ꎬ标准品和对照品无显著差异ꎬ实验组与标准品和对照品差异显著ꎮ体内测活结果如表2所示:通过对卵巢重量进行对比发现ꎬ同等剂量下接受FSH ̄CTP注射的大鼠卵巢重量明显比rhFSH要高ꎮ按照量反应平行线3.3法计算效价ꎬ结果如下:rhFSH对照:13506IU/mgFL=20.3%ꎻFSH ̄CTP样品1:23149IU/mgFL=22.36%ꎻFSH ̄CTP样品2:35450IU/mgFL=32.80%ꎻFSH ̄CTP样品3:23255IU/mgFL=36.21%ꎮ根据活性测定结果显示ꎬrhFSH注射液的活性与市售Gonal ̄f相当ꎬFSH ̄CTP的活性约是rhFSH的2~4倍ꎬ与文献报道相同ꎮ表2㊀3批样品的活性测定Table2㊀TheactivityresultsofthreebatchofFSH ̄CTP.卵巢重(mg)rFSH标准品rhFSH对照品FSH ̄CTP样品1FSH ̄CTP样品2FSH ̄CTP样品3SH/TH84ʃ1090ʃ11130ʃ23∗∗130ʃ18∗∗99ʃ12∗SM/TM62ʃ1062ʃ6101ʃ15∗∗108ʃ18∗∗77ʃ16∗SL/TL56ʃ846ʃ867ʃ13∗∗77ʃ12∗∗64ʃ8∗㊀注:表中数据为平均值ʃ标准差ꎬ同行数据后的∗表示与标准品相比在P<0.05水平上差异显著ꎬ∗∗表示在P<0.01水平上差异显著ꎮ222生物技术进展CurrentBiotechnology. All Rights Reserved.3 讨论近年来ꎬ由于不孕症发病率不断提高ꎬFSH作为不孕症治疗的必需药物之一成为研究的热点ꎮ而由于FSH的半衰期较短ꎬ开发单次用药即可在人体内长期维持血药浓度在阈值窗内的长效FSH药物一直是本领域的研究热点ꎮ目前国内已有关于长效FSH药物的相关报道和专利ꎬ但大部分都停留在实验室研究阶段ꎬ还没有药物上市ꎮ本研究以目前唯一一个上市的长效FSH药物FSH ̄CTP为研究对象ꎬ对表达该蛋白的CHO细胞培养上清进行纯化ꎬ并对获得蛋白进行了初步鉴定ꎬ为其进一步研究奠定了基础ꎮFSH ̄CTP属于糖蛋白激素类药物ꎮ文献报道关于FSH的纯化大部分使用染料亲和层析法ꎮ本研究选择使用BlueSepharoseTM6FastFlow对目的蛋白进行纯化ꎬ分辨率高ꎬ效果明显ꎮ离子交换层析法也是分离糖蛋白激素的主要方法ꎬ大部分糖蛋白在中性pH条件下带负电ꎬ可以与阴离子交换剂很好的结合ꎬ利用糖基表面的电荷差异可以获得很高的分离度和回收率ꎮ本研究采用DEAE阴离子交换层析对FSH ̄CTP进行纯化ꎬ效果较好ꎮ疏水层析也广泛应用于糖蛋白的分离纯化ꎮ本研究采用Butyl ̄650M疏水层析法对目的蛋白进行纯化ꎬ所得样品纯度较高ꎮ通过BlueSepharoseTM6FastFlow染料亲和层析㊁DEAE阴离子交换层析和Butyl ̄650M疏水层析三步层析ꎬ样品的纯度可达98%以上ꎬ且回收率约为20%ꎮ目前获得长效FSH分子的方法主要是通过改变FSH分子本身ꎬ如通过增加FSH的分子量以减少肾小球滤过ꎬ或引入额外的糖基化位点来增加分子量[2]ꎮ总体来说ꎬ长效FSH分子的设计主要包括增加糖基化位点和与IgGFc片段相融合ꎮ苏州康宁杰瑞生物科技有限公司设计了类似上述FSH ̄Fc融合蛋白的FSH类似物ꎬFSH ̄Fc/Fc在大鼠体内的半衰期为30~40hꎬ约是rhFSH的3倍[13]ꎮ本实验室将hCGβ亚基CTP序列C末端的氨基酸与FSHβ亚基C末端相融合ꎬ通过对所得FSH ̄CTP进行初步鉴定ꎬ其分子量与文献报道相符ꎬ等电点与理论相符合ꎬWesternBlot分析结果为阳性ꎮ通过雌性大鼠卵巢增重法测定其体内生物活性ꎬ发现FSH ̄CTP的活性约是rhFSH的2~4倍ꎬ与文献报道相符ꎬ具有很好的临床应用前景ꎮ参㊀考㊀文㊀献[1]㊀曹敏ꎬ王俊玲ꎬ吴彦卓ꎬ等.重组人卵泡刺激素的研究进展[J].药物生物技术ꎬ2014ꎬ1:86-90.[2]㊀FaresFAꎬSuganumaNꎬNishimoriKꎬetal..Designofalong ̄actingfollitropinagonistbyfusingtheC ̄terminalsequenceofthechorionicgonadotropinbetasubunittothefollitropinbetasubunit[J].Proc.Natl.Acad.Sci.USAꎬ1992ꎬ89(10):4304-4308.[3]㊀FauserBꎬMannaertsBꎬDevroeyPꎬetal..Advancesinre ̄combinantDNAtechnology:cori ̄follitropinalfaꎬahybridmol ̄eculewithsustainedfollicle ̄stimulatingactivityandreducedin ̄jectionfrequency[J].HumanReprod.Updateꎬ2009ꎬ15(3):309-321.[4]㊀SeyhanAꎬAtaB.Theroleofcorifollitropinalfaincontrolledo ̄varianstimulationforIVFincombinationwithGnRHantagonist[J].Int.J.WomenHealthꎬ2011ꎬ3:243.[5]㊀RombautsLꎬTalmorA.Corifollitropinalfaforfemaleinfertility[J].ExpertOpin.Biol.Ther.ꎬ2012ꎬ12(1):107-112. [6]㊀刘志勇ꎬ王启要ꎬ黄雁ꎬ等.采用染料亲和层析的方法纯化卵泡刺激素[J].江西科学ꎬ2004ꎬ22(1):11-14. [7]㊀杨凡ꎬ黄虎ꎬ李屹晨ꎬ等.新型长效重组促卵泡素的纯化和性质及药代动力学研究[J].中国生物工程杂志ꎬ2014ꎬ34(2):45-51.[8]㊀国家药典委员会.中国药典第三部2010版[M].北京:中国医药科技出版社ꎬ2010.[9]㊀沈舒.重组人促卵泡激素检定用标准物质的研究[D].北京:中国药品生物制品检定所ꎬ硕士学位论文ꎬ2009. [10]㊀孔毅ꎬ吴梧桐ꎬ吴如金.蛋白质分子量测定方法比较研究[J].分析仪器ꎬ2003ꎬ(2):44-47.[11]㊀阎哲ꎬ黄骏雄.糖蛋白激素的不均一性及其色谱分离纯化研究的进展[J].化学进展ꎬ1999ꎬ19(2):163-172. [12]㊀陈宁.重组人促卵泡激素的质量研究[D].长春:吉林大学ꎬ硕士学位论文ꎬ2008.[13]㊀苏州康宁杰瑞生物科技有限公司.一种FSH融合蛋白及其制备方法和用途[P].中国201210476665.0ꎬ2014.322刘晓航ꎬ等:重组人长效促卵泡激素FSH ̄CTP的纯化工艺研究及鉴定. All Rights Reserved.。


产品使用说明书His·Tag融合蛋白纯化操作手册采用pET系统进行原核蛋白表达,蛋白的表达量达到20mg/100ml培养物并不是困难的事。
在大肠杆菌中表达的目的蛋白,其可溶性(可溶蛋白或包涵体)、细胞定位(细胞质、细胞周质、培养基上清),都会对后续的纯化策略造成影响。
我们建议研究者在蛋白表达后,首先进行目的蛋白的细胞定位(请参考pET系统操作手册);在进行大量纯化之前,小量纯化蛋白,摸索确定适合于具体蛋白的纯化条件,也是值得推荐的好方法。
外源蛋白在大肠杆菌中表达,可能以可溶形式存在,也可能以包涵体形式存在。
尤其在高水平表达的条件下,更容易形成包涵体。
包涵体的形成与外源蛋白本身性质、载体、宿主菌、以及表达水平都有关系,可以通过选择不同表达载体和E.coli宿主菌组合,摸索生长条件和适宜诱导条件,达到优化蛋白表达的目的。
His·Tag®融合蛋白,可以在天然条件或变性条件下用NTA His·Bind树脂或IDA His·Bind树脂进行纯化。
内容提要一、亲和纯化样品的前处理1. 菌液体积-起始目的蛋白量2. 细菌裂解获得可溶蛋白• BugBuster Master Mix蛋白抽提方法• 机械破碎(如超声等)二、亲和纯化步骤附录:补充背景知识• NTA和IDA化学基团• His·Bind基质选择指南• 在确定裂解方法前的考虑• 蛋白可溶性及细胞定位• 天然或变性条件下目的蛋白的纯化• 批次小量纯化或柱层析纯化方法• 目的蛋白的结合• 杂蛋白• 如何降低非特异性结合• 漂洗杂蛋白• 目的蛋白的洗脱• 纯化真核表达体系来源的His·Tag融合蛋白• His·Tag融合标签的去除• 推荐资料Ni-NTA 树脂纯化1. Ni-NTA树脂的兼容性2. 天然条件纯化• 柱层析• FPLC• 批次小量纯化3. 变性条件的纯化• 柱层析• FPLC纯化• 批次小量纯化4. 树脂再生5. 常见问题与改善建议一、亲和纯化样品的前处理1. 菌液体积-起始目的蛋白量纯化条件的优化需考虑多个因素,包括His·Tag融合蛋白表达水平和上样量。