高中化学双向细目表
- 格式:doc
- 大小:112.00 KB
- 文档页数:7

高一化学必修双向细目表1. 化学基础知识- 原子结构和元素周期表- 化学键和化合物的分类- 化学反应和化学方程式- 酸碱中和和中性化学反应- 物质的状态变化和相变- 化学量和化学计算- 元素周期表中的主要元素和其特性- 元素的周期性和趋势- 物质的分子结构和化学键的类型2. 化学实验技能- 实验室安全和实验室设备的使用- 常用实验方法和仪器的操作- 实验数据的记录和处理- 实验结果的分析和解释- 实验原理和实验设计3. 化学反应与能量变化- 化学反应的能量变化- 燃烧反应和氧化还原反应- 酸碱中和反应和热化学方程式- 粒子间的引力作用和化学反应的速率- 化学反应的平衡和平衡常数- 溶液中的溶解度和溶液的浓度4. 化学物质的构成与结构- 元素和化合物的构成- 原子和分子的结构- 组成物质的化学键- 元素周期表中元素的结构特性- 金属和非金属元素的性质- 化合物的分子结构和性质- 傅里叶光谱和分子结构分析5. 化学周期律与离子反应- 元素周期表和周期律规律- 同一周期和同一族的元素特性- 阴离子与阳离子的结构和特性- 离子反应的性质和反应方程式- 酸碱反应和生成离子的化学方程式- 离子溶液中的电离反应和电导率6. 环境与持续发展化学- 化学物质对环境的影响- 大气污染和水污染的原因和防治- 可持续发展和绿色化学的概念- 环境友好的化学产品和过程- 生物质资源的利用和能源转化- 化学垃圾处理和废物回收利用的方法7. 高分子物质与生物化学- 高分子物质的结构和性质- 聚合反应与高分子合成- 塑料和纤维的生产和应用- 生物大分子的结构和功能- 生物有机物的合成和代谢- 酶的催化作用和生物化学反应以上是高一化学必修双向细目表的主要内容。
这份文档包含了学习该科目所需的基础知识、实验技能以及各个单元的重点内容。
希望能对你的学习和备考有所帮助。


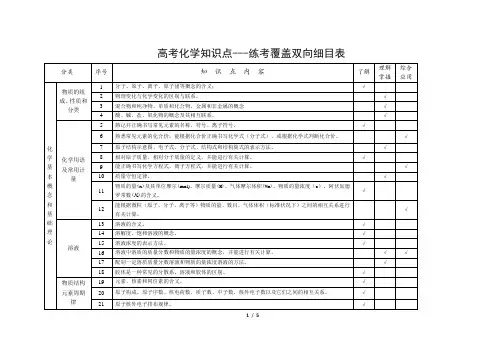
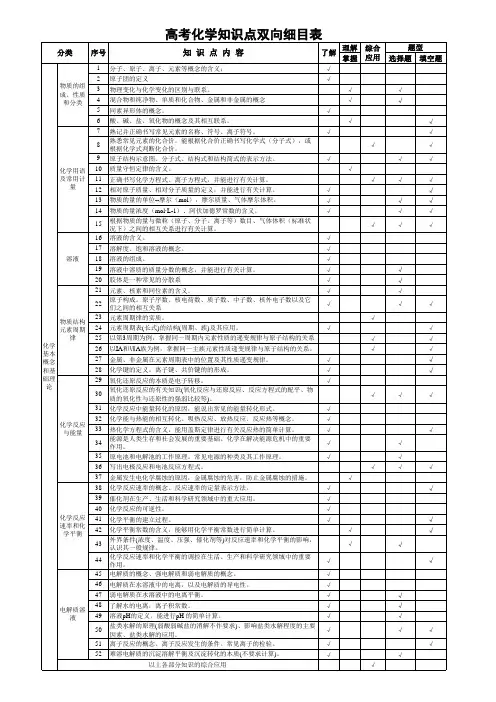
高中化学双向细目表高考化学双向细目表分类序号知识点内容1 物质的组成、性质和分类2 化学基本概念3 物质的分子、原子、离子、元素等概念的含义;初步了解原子团的定义4 物理变化与化学变化的区别与联系5 混合物、纯净物、单质和化合物、金属和非金属的概念6 同素异形体的概念7 酸、碱、盐、氧化物的概念及其相互联系8 熟记并正确书写常见元素的名称、符号、离子符号9 熟悉常见元素的化合价;能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价10 掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;理解质量守恒定律的含义;掌握热化学方程式的含义11 能正确书写化学方程式、离子方程式、电离方程式、电极反应式12 了解相对原子质量、相对分子质量的涵义13 掌握物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)的含义14 物质的量浓度(mol·L-1)、阿伏加德罗常数的含义15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系16 掌握化学反应的四种基本类型:化合、分解、置换、复分解17 理解氧化还原反应,了解氧化剂和还原剂等概念;掌握重要氧化剂、还原剂之间的常见反应18 能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式19 了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念20 了解溶液的涵义21 了解溶液的组成,理解溶质的质量分数的概念22 了解饱和溶液、不饱和溶液的概念;了解溶解度的概念;了解温度对溶解度的影响及溶解度曲线23 初步了解结晶、结晶水、结晶水合物、风化、潮解的概念24 了解胶体的概念及其重要性质和应用25 了解原子的组成及同位素的概念26 掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系注:综合应用部分不在此表中列出。

高中化学命题双向细目表【实用版】目录1.高中化学命题双向细目表的定义与作用2.高中化学命题双向细目表的内容3.如何编制高中化学命题双向细目表4.高中化学命题双向细目表的应用正文高中化学命题双向细目表是一种考查高中化学知识和能力的工具,它通过列举各项知识和能力,帮助教师和命题者明确考试内容和考试要求,从而更好地指导学生学习和备考。
本文将从高中化学命题双向细目表的定义与作用、内容、如何编制以及应用等方面进行详细阐述。
一、高中化学命题双向细目表的定义与作用高中化学命题双向细目表是一种详细列举高中化学知识点和能力的表格,它包含知识内容和能力要求两个方面,有助于命题者明确考试范围,合理设置题目,同时也有助于学生了解考试内容,进行有针对性的复习。
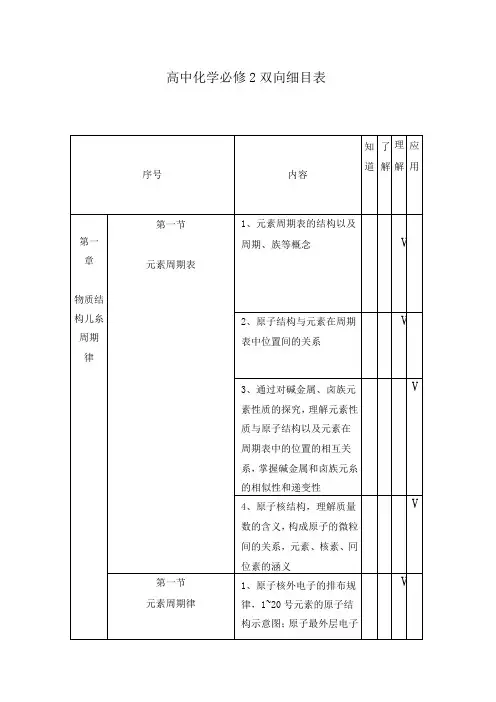
二、高中化学命题双向细目表的内容高中化学命题双向细目表主要包括以下内容:1.知识内容:涵盖高中化学的所有知识点,如有机化学、无机化学、化学反应原理、化学平衡、电解质溶液等。
2.能力要求:包括理解能力、应用能力、分析能力、综合能力等。
三、如何编制高中化学命题双向细目表在编制高中化学命题双向细目表时,应遵循以下原则:1.遵循教学大纲和考试大纲:确保所列知识点和能力要求与教学大纲和考试大纲一致。
2.合理安排题目类型和分值:根据知识点和能力要求的重要程度,合理安排各类题目的比例和分值。
3.注重试题的科学性和客观性:试题应科学、客观、公正,避免出现偏题、怪题。
四、高中化学命题双向细目表的应用高中化学命题双向细目表在教学和考试中有广泛应用,主要表现在:1.帮助教师和命题者明确考试内容和要求,合理设置题目。
2.帮助学生了解考试内容,进行有针对性的复习。
3.有助于提高考试的科学性和客观性。

重庆育才中学高2021 级高一〔上〕化学期末试题双向细目表考试范围和总分:高中化学必修1全册,总分120分。
题型、题数及分值:选择题〔两个大题共80分:均单项选择,3分题20个,4分题5个〕,非选择题〔四个大题共40分:均以填空题形式呈现,不单独出计算大题〕。
难度:题目分为易、中、难三个档次;要求选择题有1~2题拉差距,非选择题有2~3个小问题拉差距,全卷拉差距的分数控制在10分左右,且拉差距的题或问题尽量靠后,及格率控制在70%~80%之间。
Na2O2与H2O、CO2反响的电子转移易、中足量Na2O2与H2O、CO2反响固体质量增加的计算〔只考选择题〕易、中金属及其化合物Na2O2的强氧化性、漂白性,Na2O2参加到酸碱指示剂中的现象易、中Na2CO3和NaHCO3的物理性质、化学性质、互相转化易、中Na2CO3和NaHCO3的热稳定性实验易、中差量法进展Na2CO3和NaHCO3混合物纯度的计算易、中Na2CO3和NaHCO3的鉴别;易、中Na在空气中的变化过程及现象,Na2CO3晶体的风化易、中铝的化学性质〔不要求铝热反响〕易、中Al2O3和Al(OH)3理化性质、用途,两性氧化物、两性氢氧化物易、中KAl(SO4)2的俗名、电离方程式、用途易、中Al与酸或碱溶液生成H2的计算;原子守恒法进展溶液中生成Al(OH)3的计算易、中“铝三角〞及Al(OH)3的沉淀图像分析〔只要求在铝盐溶液中滴入NaOH溶液〕及简单计算〔计算只考选择题〕易、中铁的氧化物俗名、存在,理化性质易、中Fe(OH)2、Fe(OH)3的理化性质;Fe(OH)2向Fe(OH)3的转化;Fe(OH)2的制备易、中Fe3+与Fe2+的互相转化〔只要求现阶段常见的氧化剂和复原剂〕、检验,“铁三角〞易、中硅元素的存在,硅单质的性质、用途;二氧化硅单质的性质、用途;高纯硅制取〔只考选择题〕易非金属及其化合物硅酸、硅胶的制法、用途〔只考选择题〕易硅酸盐的氧化物写法;硅酸钠溶液的俗名、用途;水泥、玻璃、陶瓷的原料〔只考选择题〕易氯元素的存在;Cl2的理化性质;Cl2毒性的防范易、中氯水的成分和性质;氯水与液氯的区别;HClO的漂白性易、中漂白液、漂白粉的制法,有效成分,漂白原理易、中Cl-、SO42-的检验易、中Cl2的实验室制法〔方程式、制气、除杂、枯燥、尾气吸收装置〕易、中卤素的互相置换易、中硫元素的存在;硫磺的理化性质易、中SO2的理化性质;可逆反响;几类漂白剂漂白原理的比较;SO3的化学性质易、中NO2和NO的理化性质;互相转变;〔4NO2+O2+2H2O4HNO3,4NO+3O2+2H2O4HNO3不考计算〕SO2、NO2对大气的污染;酸雨易、中NH3的理化性质;固氮;工业制法易、中NH3的实验室制法〔原理、装置——包括制气、枯燥、搜集、验满〕;易、中喷泉实验原理及改进〔不考计算〕易、中浓H2SO4的三性易、中HNO3的强氧化性;氧化性酸和酸的氧化性〔不考Fe和稀HNO3的反响〕易、中守恒法进展有关金属和HNO3的反响计算〔可考4分选择题〕中。
(原创2023)化学高考双向细目表一、无机化学1. 元素和化合物- 1.1 元素周期表- 1.2 常见元素的性质和应用- 1.3 水和溶液中的离子反应- 1.4 化合物的命名和化学式2. 化学反应- 2.1 燃烧反应- 2.2 氧化还原反应- 2.3 酸碱中和反应- 2.4 沉淀反应- 2.5 气体生成和反应3. 化学原理- 3.1 序列化反应和电位差- 3.2 动态平衡和平衡常数- 3.3 反应速率和速率常数- 3.4 催化剂和化学反应速率二、有机化学1. 有机化合物- 1.1 碳的特性和共价键- 1.2 烃类化合物- 1.3 醇、酚、醚类化合物- 1.4 醛、酮、羧酸类化合物- 1.5 氨基酸和蛋白质2. 有机反应- 2.1 烃类的燃烧反应- 2.2 单官能团化合物的反应- 2.3 多官能团化合物的反应- 2.4 聚合反应和聚合物的合成- 2.5 脂肪酸和酯的反应3. 有机化学原理- 3.1 反应机理和反应路径- 3.2 功能团和化学性质- 3.3 离子和自由基反应- 3.4 共轭系统和共轭反应三、化学实验1. 基本实验操作- 1.1 实验室安全和实验室常识- 1.2 仪器使用和实验操作技巧- 1.3 实验记录和数据处理2. 实验现象和解释- 2.1 气体生成与气体收集- 2.2 溶液中的颜色变化- 2.3 岩石和矿石的检验- 2.4 酸碱中和和中和滴定- 2.5 电解质的电导性实验3. 实验设计和控制变量- 3.1 实验变量和实验因素- 3.2 实验设计和实验步骤- 3.3 实验结果的误差和精度- 3.4 实验报告的撰写和结论以上为高考化学学科的双向细目表,其中包含了无机化学、有机化学和化学实验三个部分的细分内容。
学生可以根据这份细目表来进行有针对性的学习和复习,以便在高考中取得好成绩。