二元液系相图
- 格式:doc
- 大小:198.50 KB
- 文档页数:7

实验D-5 溶液的二元液系T-X图实验目的1.采用回流冷凝法测定不同浓度的二元液系的沸点和气液两相组成,绘制其沸点∽组成(t∽X)图(包括液体折射率工作曲线的绘制),并描述其相图特征,找出其恒沸点温度与组成。
2.用阿贝折光仪测量液体和蒸汽的组成。
了解液体折光率的测量原理和方法。
实验原理一个完全互溶双液体系的沸点∽组成图,表明在气液两相平衡时,沸点与气液两相组成的关系;它对于了解这一体系的性质及精馏过程都有很大的实用价值.在恒压下完全互溶的双液体系T∽X有下列三种情况:1.所有组成溶液沸点介于二纯组分沸点之间,如苯与甲苯(图D5-1A)。
2.有最高恒沸点,如卤化氢和水(图D5-1B)。
3.有最低恒沸点,如苯和乙醇(图D5-1C)。
A B C图D5-1 二元液系相图在图D5-1A中,A'LB'代表液相线,A'VB'代表气相线,等温水平线与气相线和液相线的交点分别代表在该温度时相互成平衡的气相和液相的组成.在图D5-1c中,绘制沸点∽组成图的原理说明如下:当总组成为X的溶液加热时,体系的温度沿着虚线上升,当温度达到T时(即和液相线相交时)溶液开始沸腾,此时平衡的气相组成为yV ,液相组成为X.温度升至Ti,气相组成为yi,液相组成为xi,在此相区f=C - P + 2式中:f为自由度;P为相数;C为组分数。
在本实验中C=2,在二相区(气、液二相),P = 2,∴f=2,由于压力指定(实验在恒压下进行)所以在二相区内f=l,因此,若指定温度则气液相浓度就不可改变,此时气、液两相的相对量亦不可变(服从杠杆原理);反之,若指定了气液相的相对量从而气液相组成一定,则沸点也确定了。
本实验采用后者使用Ellis平衡蒸馏仪利用回流方法保持气液两相相对量一定,测定平衡时的沸点,并分别收集气相冷凝液和液相的样品,用化学方法或物理方法分析其组成,这样在T—X图上可找到此沸点T1时互成平衡的液相组成Xl和气相组成yl。


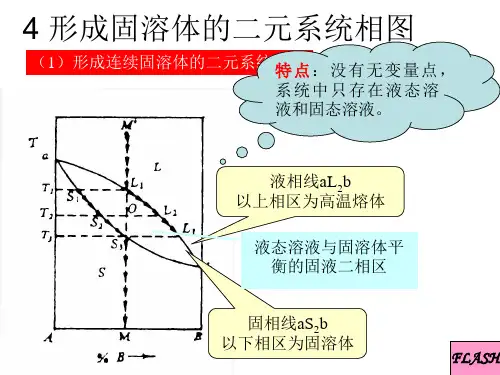

二元液系相图一、实验目的1、测定环己烷-乙醇系统的沸点组成图(T-X图)2、掌握阿贝折光仪的使用方法二、实验原理1、一个完全互溶的二元系统的沸点-组成图,表明在气液二相平衡时,沸点和两相组成间的关系.2、在常温下,两种液态物质以任意比例相互溶解所组成的体系称之为完全互溶双液系。
完全互溶双液系在恒定压力下的沸点—组成图可分为三类:3、(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
4、(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1 (b)所示。
5、(3)最大正偏差:混合物存在着最低沸点,如正丙醇—水体系,如图1(c)所示。
BB B(a)(b)(c)本实验绘制环己烷-乙醇二元液系的T-X图。
其方法为将不同组成的溶液于蒸馏仪中进行蒸馏看,沸腾平衡后记下温度,一次吸取少量的蒸馏液和蒸出液。
分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率组成标准曲线或其数据表确定相应组成,从而绘制环已烷-乙醇二元液系相图。
三、实验仪器与试剂1、沸点测定仪1个;取样管12支;阿贝折光计1台;环己烷(分析纯);无水乙醇(分析纯);直流稳压电源1台四、实验步骤1、纯液体折光率的测定。
分别测定乙醇和环己烷的折光率。
2、工作曲线的绘制。
这有实验书所给定的数据进行绘制。
3、测定沸点-组成数据(1)安装沸点测定仪。
将干燥的沸点测定仪按图2-1安装图2-1好,检查带有温度计的橡皮塞是否塞紧。
加热用的电阻丝要靠近底部中心,温度计的水银球不能接触电阻丝,而且每次更换溶液后,要保证测定条件尽量平行(包括水银温度计和电阻丝的相对位置)。
(2)用老师粗略的配制好的20%,40% ,60% ,80%组成的环己烷-乙醇溶液约50ml。
(3)测定沸点及平衡的气液相组成。
取下塞子,加入所要测定的溶液(40ml),其液面以在水银球中部为宜。
接好加热线路,打开冷凝水,再接通电源。
调节直流稳压电源电压调节旋钮,使加热电压为10-15v,缓慢加热。


实验五 二元液态混合物的气-液平衡相图【目的要求】1.实验测定并绘制环己烷-乙醇体系的沸点组成(T -x )图,确定其恒沸点及恒沸混合物的组成。
2.了解测量折光率的原理,掌握阿贝折光仪的使用方法。
【实验原理】两种液体能在任意浓度范围内完全相溶的体系称完全互溶的双液体系。
根据相律:f =K Φ+2式中:f 为体系的自由度;K 为体系中的组分数;Φ为体系中的相数;2是指压力和温度两个变量。
对于定压下的二组分液态混合物,相律可表示为:f =3-Φ。
在大气压力下,液体的蒸气压和外压相等时,平衡温度即为沸点。
对于完全互溶的双液体系,当气液两相平衡时Φ=2,f =1。
完全互溶的双液体系在定压下并没有固定的沸点,为一沸程,并且是和溶液的组成有关的,即T 是x 的函数。
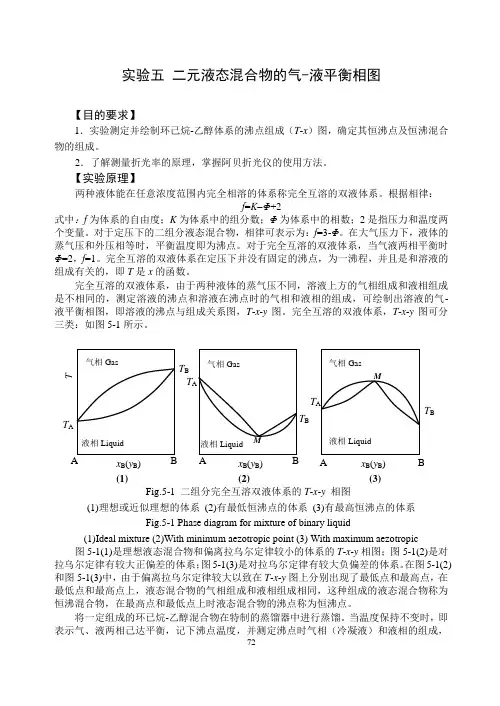
完全互溶的双液体系,由于两种液体的蒸气压不同,溶液上方的气相组成和液相组成是不相同的,测定溶液的沸点和溶液在沸点时的气相和液相的组成,可绘制出溶液的气-液平衡相图,即溶液的沸点与组成关系图,T -x -y 图。
完全互溶的双液体系,T -x -y 图可分三类:如图5-1所示。
图5-1(1)是理想液态混合物和偏离拉乌尔定律较小的体系的T -x -y 相图;图5-1(2)是对拉乌尔定律有较大正偏差的体系;图5-1(3)是对拉乌尔定律有较大负偏差的体系。
在图5-1(2)和图5-1(3)中,由于偏离拉乌尔定律较大以致在T -x -y 图上分别出现了最低点和最高点,在最低点和最高点上,液态混合物的气相组成和液相组成相同,这种组成的液态混合物称为恒沸混合物,在最高点和最低点上时液态混合物的沸点称为恒沸点。
将一定组成的环已烷-乙醇混合物在特制的蒸馏器中进行蒸馏。
当温度保持不变时,即表示气、液两相己达平衡,记下沸点温度,并测定沸点时气相(冷凝液)和液相的组成,Fig.5-1 二组分完全互溶双液体系的T -x -y 相图 (1)理想或近似理想的体系 (2)有最低恒沸点的体系 (3)有最高恒沸点的体系 Fig.5-1 Phase diagram for mixture of binary liquid(1)Ideal mixture (2)With minimum aezotropic point (3) With maximum aezotropic 液相Liquid 气相Gas T B x B (y B ) (3) M A B液相Liquid气相Gas T A T B x B (y B ) T (1) AB 液相Liquid 气相Gas T A T Bx B (y B ) (2) M A B T A图5-2 沸点仪示意图 1.温度计;2.接加热器;3.加液口;4.电热丝连接点;5.电热丝;6.分馏液;7.分馏液取样口 Fig.5-2 The sketch of ebulliometer 1.thermometer;2. connection pole;3. inlet orifice; 4. connection point of heater with wire;5.heater; 6. fractional liquid;7. sampling orifice 即可得到一组T -x -y 数据。



实验二二元液系气液平衡相图一、实验目得1、了解环己烷—乙醇系得沸点—组成图2、由图上得出其最低恒沸温度及最低恒沸组成(含乙醇%)3、学会使用数字阿贝折射仪4、学会使用WTS-05数字交流调压器二、原理一个完全互溶双液体系得沸点—组成图,表明在气液二相平衡时沸点与二相成分间得关系,它对了解这一体系对行为及分馏过程都有很大得实用价值。
在恒压下完全互溶双液系得沸点与组分关系有下列三种情况:1、溶液沸点介于二纯组分之间;2、溶液有最高恒沸点;3、溶液有最低恒沸点、图1表示有最低恒沸点,本次实验图形也像如此得样子,A′LB′代表液相线得交点表示在该温度时互成平衡得二相得成份。
绘制沸点—成份图得简单原理如下:当总成份为X得溶液开始蒸馏时,体系得温度沿虚线上升,开始沸腾时成份为Y得气相生成、若气相量很少,x、y二点即代表互成平衡时液气二相成份。
继续蒸馏,气相量逐渐增多,沸点沿虚线继续上升,气液二相成份分别在气相与液相线上沿箭头指示方向变化。
当二相成份达到某一对数值x′与y′,维持二相得量不变,则体系气液二相又在此成份达到平衡,而二相得物质数量按杠杆原理分配。
本实验利用回流得方法保持气液二相相对量一定,则体系温度恒定。
待二相平衡后,取出二相得样品,用阿贝折光仪测定其折射率。
得出该温度下气液二相平衡成份得坐标点,改变体系得总成份,再用上法找出一对坐标点,这样测得若干坐标点后,分别按气相点与液相点连成气相线与液相线,即得T—X平衡图。
三、步骤1、安装接通仪器,打开冷凝水;2、加入环己烷20ml,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器;3、A组加入乙醇0。
5ml,用上法测定温度,然后关闭调压器,取出气相,液相得样品,测其折射率,以后分别加入1。
0,2.0,4、0,8.0,12、0ml乙醇;4、B组加入20ml无水乙醇,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2-3分钟基本不变,记下温度,关闭调压器;5、加环己烷0。
大学化学实验II实验报告——物理化学实验学院:化工学院专业:班级:姓名实验日期实验时间学号指导教师同组人实验项目名称二元液系相图的绘制实验目的1.掌握阿贝折射仪的使用方法。
1、学习常压下完全互溶双液系气-液平衡相图的绘制。
实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图(c))所示。
二组分真实液态混合物气—液平衡相图(T-x图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
tAtAtAtB tBtBt/oCt/oCt/oCxBxBxBA B A AB B(a)(b)(c)x'x'本实验中两相的成分分析均采用折光率法测定:折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
物理化学实验报告实验名称:完全互溶双液系统气液平衡相图的绘制专业班级:生物工程112班学生姓名:钟坤学号:1108110391实验时间:2103年5月14日8:00~10:00指导老师:刘定富老师一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点- 组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图2.7(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压t A t A tAtB t B t Bt / o C t / o C t / o C x B x Bx B A B A A B B(a)(b)(c)x 'x '都大,混合物存在着最低沸点如图2.7(c))所示。
图2.7 二组分真实液态混合物气—液平衡相图(T-x图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
二元液系相图
一、实验目的
1.测定在常压下环己烷-乙醇的气液平衡相图。
2.掌握阿贝折射仪的使用方法。
二、实验原理
在恒压下,完全互溶双液体系的沸点与成分关系有下列三种情况:
(1)溶液的沸点介于二纯组分沸点之间;
(2)溶液有最高恒沸点,即对拉乌尔定律发生负偏差的溶液;(3)溶液有最低恒沸点,即对拉乌尔定律发生正偏差的溶液
图1 简单完全互溶双液系的T-x图
图2 具有最高恒沸点的T-x图
图3 具有最低恒沸点的T-x图
配制一系列不同组成的环己烷—乙醇溶液,然后测定其相应的折光率,由此可绘出组成—折射率的标准曲线。
测定混合液近似组成所对应的液相和气相折射率,通过标准曲线可以查出该温度下气液二相平衡时折射率所对应的环己烷组成,通过此方法再找出其他混合液近似组成的折射率所对应的环己烷组成,这样测得若干组数据后,以环己烷的组成x为横坐标,温度T为竖坐标作图,将气相点和液相点用光滑的曲线连成气相线和液相线,即得T-x图。
气液组成的折光率可用阿贝折射仪来测定。
三、仪器与试剂
阿贝折射仪,铁架台,沸点测量仪,沸点仪, 50mL量筒一个,
10mL刻度移液管各2支、试剂瓶若干、,长取液管,短取液管。
环己烷,无水乙醇,重蒸馏水,80%、60%、40%、20%环己烷—乙醇标准混合液。
四、实验步骤
先分别测定纯组分的折光率。
工作曲线的测定:测定折射率与组成的关系:使用阿贝折射仪测量纯环己烷,纯乙醇,80%、60%、40%、20%环己烷—-乙醇标准混合液相应的折射率。
以折射率对组成作图,即可绘制工作曲线。
溶液的配制。
粗略配制环己烷的体积百分数分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9等组成的环己烷—乙醇溶液约100ml。
放入编号为1-9的容器内待测。
测定沸点及平衡的气—液相组成。
取下塞子,将1号待测液加入蒸馏瓶,盖好瓶塞,使电热丝侵入液体中,温度传感器与液面接触,将沸点测量仪用冷凝管夹固定,接通自来水。
将恒流电源的连接线与沸点测量仪的电热丝相连,接通沸点测量仪电源,接通电热丝加热至沸腾,待数字温度计上读数恒定后,读下该温度值,即为样品的沸点,关闭电源停止加热。
将干燥的长取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液分析样,迅速用阿贝折射仪测其折光率。
用擦镜纸把阿贝折射仪的镜面擦干,用干燥的短取液管取液相混合物,用阿贝折射仪测其折光率,取下连接线,关闭自来水,取出温度传感器。
测完气、液相折光率后,将混合物从磨口倒回原试剂瓶中,不必弄干蒸馏瓶,继续取下一号混合液进行实验。
直到做完为止。
整理仪器。
五、数据记录与处理
室温:24.6℃大气压:100.70kPa
表1 环己烷-乙醇标准溶液的折光率
环己烷
00.10.20.30.40.50.60.70.80.91
摩尔分数
折光率 1.3625 1.3665 1.3700 1.3755 1.3860 1.3885 1.4015 1.4025 1.4125 1.4210 1.4225根据表1绘制工作曲线,即为图4。
图 4 环己烷摩尔分数与折光率的关系曲线
测定沸点及平衡的气—液相组成记录如下:
表2 不同组成的环己烷-
乙醇溶液的折光率
混合液编号
混合液近似组成 沸点
气相分析
液相分析 V b/%
折射率
V b /%
折射率
V b /%
1 0.0 77.9 1.3630
2 0.1 75.
3 1.371 0.17492 1.3637 0.0642
4 3 0.2 73.4 1.373
5 0.23878 1.3695 0.22459 4 0.3 69.5 1.3755 0.23878 1.3745 0.22459 5 0.4 65.1 1.3975 0.55095 1.3782 0.27709
6 0.5 64.
7 1.4005 0.59352 1.3853 0.37784 7 0.6 66.5 1.4014 0.6063 1.3925 0.48001
8 0.7 69.2 1.4024 0.6204
9 1.3995 0.57933 9 0.8 73.2 1.4114 0.6063 1.4195 0.86313 10 0.9 75.8 1.4121 0.61623
1.4226 0.90712
11 1.0 80.2 1.4260
绘制双液系相图,如图5。
图5 环己烷-乙醇双液系相图
由图所知:最低恒沸点为64.2℃,组成为0.4914。
六、注意事项
1.加热电阻丝一定要被待测液体浸没,否则通电加热时可能会
引起有机液体燃烧;所加电压不能太大,加热丝上有小气泡逸出即可;温度计的水银球不要直接碰到加热丝。
2. 一定要使体系达到气液平衡,即温度读数要稳定,然后再取样;先停止通电再取样。
3. 注意保护阿贝折射仪的棱镜,不能用硬物触及(如滴管),擦拭棱镜需用擦镜纸。
4.每次测定前,取样管和折射仪棱镜玻璃面必须用洗耳球吹干,否则将严重影响测定结果。
七、思考题
1、本实验不测纯环己烷、纯乙醇的沸点,而直接用下的数据,这样会带来什么误差?
答:不同压力下的沸点不相同,会给实验偶然误差。
2、待测溶液的浓度是否需要精确计量?为什么?
答:不需要,待测溶液经实验测的沸点、气相折光率、液相折光率后可从图一中找到待测溶液的浓度(含环己烷),故不需要精确计量。
3、如果要测纯环己烷、纯乙醇的沸点,蒸馏瓶必须洗净,而且烘干,而测混合液沸点和组成时,蒸馏瓶则不洗也不烘,为什么?
答:测试纯样时,如沸点仪不干净,所测得沸点就不是纯样的沸点。
测试混合样时,其沸点和气、液组成都是实验直接测定的,绘制图像时只需要这几个数据,并不需要测试样的准确组成,也跟式样的量无关。