检验原始记录(A4)
- 格式:doc
- 大小:609.50 KB
- 文档页数:35


产品名称取样日期样品数量样品规格样品生产批号检验日期
样品检测次数
1样100%2样100%空瓶m
瓶+样m2
第一次干燥(灼烧)m2
平均值x=
1. 用粉碎机将样品打碎,用四分法对角取样,约取25g ,置于清洁,干燥,带盖的广口瓶内,混匀代用。
水分/干燥失重检验原始记录表
2. 精确称取已干燥恒重的称量瓶,精确称取样品约3g-5g ,放入真空干燥箱内,使真空度达到0.009Mpa ,温度控制在80℃±2,干燥4h 取出称量瓶,加盖后放入干燥器内,防止冷却后至室温后取出称重,精确至0.0001g 。
100%
□代可可脂巧克力及代可可脂巧克力制品≤1.5 巧克力及巧克力制品≤1.5 凝胶糖果≤ 20.0 夹心糖果≤4.0 充气糖果≤9.0 硬质糖果≤4.0 奶糖糖果≤ 5.0 奶糖糖果≤7.0 太妃糖果≤9.0 花式糖果≤ 4.0 酥质糖果≤4.0X 1=X 2=项目名称干燥失重
检验方法:GB5009.3 检验原理:将已知的糖果样品置于真空干燥箱内,干燥至恒温,测定挥发物的质量
使用仪器:电子分析天平(万分之一),干燥器,真空干燥箱,称量瓶, 真空泵。
操作方法:。
![检验原始记录规范标准[详]](https://img.taocdn.com/s1/m/7f05b47ab4daa58da0114a79.png)
检验原始记录规1 围本规规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。
2 术语2.1 测定值测定时,从仪器仪表或量具上读取的数值。
2.2 给定值为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。
2.3 计算值由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。
2.4 灭菌用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。
2.5 消毒用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。
3 基本要求3.1 原始记录的容应包括与检验有关的一切资料、数据和现象,完整地记录全过程。
3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。
3.3 原始记录要格式化,每类样品应有固定的格式。
3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。
3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。
3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。
3.8 记录应卷面整齐、洁净。
同一页中不准使用两色或两色以上的墨水。
3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。
3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。
4 填写要求4.1 样品编号样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。
4.2 共页第页4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。
4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。
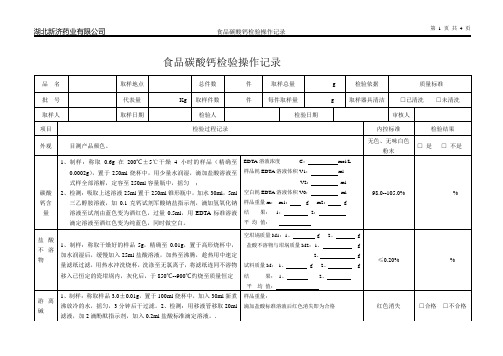
食品碳酸钙检验操作记录品名取样地点总件数件取样总量g 检验依据质量标准批号代表量Kg 取样件数件每件取样量g 取样器具清洁□已清洗□未清洗取样人取样日期检验人检验日期审核人项目检验过程记录内控标准检验结果外观目测产品颜色。
无色、无味白色粉末□是□不是碳酸钙含量1、制样:称取0.6g在200℃±5℃干燥4小时的样品(精确至0.0002g),置于250ml烧杯中,用少量水润湿,滴加盐酸溶液至式样全部溶解,定容至250ml容量瓶中,摇匀;2、检测:吸取上述溶液25ml置于250ml锥形瓶中,加水30ml,5ml三乙醇胺溶液,加0.1克钙试剂军酸钠盐指示剂,滴加氢氧化钠溶液至试剂由蓝色变为酒红色,过量0.5ml,用EDTA标准溶液滴定溶液至酒红色变为纯蓝色,同时做空白。
EDTA溶液浓度C:mol/L样品耗EDTA溶液体积V1:mlV2: ml空白耗EDTA溶液体积V0:ml样品重量m:m1: g m2: g结果:1:2:平均值:98.0--105.0% %盐酸不溶物1、制样:称取干燥好的样品5g,精确至0.01g,置于高形烧杯中,加水润湿后,缓慢加入25ml盐酸溶液,加热至沸腾,趁热用中速定量滤纸过滤,用热水冲洗烧杯,洗涤至无氯离子,将滤纸连同不溶物移入已恒定的瓷坩埚内,灰化后,于850℃--900℃灼烧至质量恒定空坩埚质量M1:1、g 2、g盐酸不溶物与坩埚质量M2:1、g2、g试料质量M:1、g 2、g结果:1、2、平均值:≤0.20% %游离碱1、制样:称取样品3.0±0.01g,置于100ml烧杯中,加入30ml新煮沸放冷的水,摇匀,3分钟后干过滤。
2、检测:用移液管移取20ml滤液,加2滴酚酞指示剂,加入0.2ml盐酸标准滴定溶液。
.样品重量:滴加盐酸标准溶液后红色消失即为合格红色消失□合格□不合格碱金属及镁1、滤制样:称取约1g试样,精确至0.0002g,置于250ml烧杯中,加水润湿后缓慢加入30ml盐酸溶液,煮沸并去除二氧化碳,冷却后加氨水溶液中和,加入60ml草酸铵溶液,于水浴上加热1小时,冷却后全部转移至100ml容量瓶中,加水至刻度,摇匀,干过滤,2、检测:用移液管移取50ml滤液,置于已于灼烧至恒定的坩埚内你,加入0.5ml硫酸,蒸发至干,于800℃±25℃下灼烧至质量恒定。

成品检验原始记录(首页)
检验者:复核者:日期:日期:
鉴别检查原始记录
检验者:复核者:日期:日期:
溶出度测定原始记录
日期:日期:
含量均匀度检查原始记录
日期:日期:
有关物质检查原始记录
检验者:复核者:日期:日期:
含量测定原始记录
日期:日期:
微生物限度检查记录
检品名称:批号:
生产单位:检品数量:
规格:包装:
检验日期:报告日期:
检验依据:
供试液制备:
□常规法供试品 g(ml) 0.9%无菌氯化钠-蛋白胨缓冲液 ml
①匀浆仪挡 min ②研钵法③保温振摇法
□非水溶性供试品供试品 g或ml 加乳化剂(g或ml)
□抑菌性供式品处理方法供试品 g或ml 0.9%无菌氯化钠溶液 ml 方法:
结论:按《中国药典2010年版二部》检验上述项目,结果:
检验者:复核者:
日期:日期:。
检验报告制表审批单
气质联用分析表
注:此表由用户填写,,随原始记录发放。
检测人: 校核人: 审查人:
第页
检测人: 校核人: 审查人:
第页
原子吸收分析测试原始记录
检测人: 校核人: 审查人:
第页
氨基酸分析测试原始记录
检测人: 校核人: 审查人:
第页
酸度/离子分析测试原始记录
检测人: 校核人: 审查人:
第页液相色谱分析测试原始记录
检测人: 校核人: 审查人:
第页
荧光分光分析测试原始记录
检测人: 校核人: 审查人:
第页
凯氏定氮分析测试原始记录
检测人: 校核人: 审查人:
第页
薄层分析测试原始记录
检测人: 校核人: 审查人:
第页
紫外/可见分光光度测试原始记录
检测人: 校核人: 审查人: 第页
油脂分析测试原始记录
检测人: 校核人: 审查人:
第页
重量分析测试( )原始记录
检测人: 校核人: 审查人:
第页
密度分析测试原始记录
检测人: 校核人: 审查人:
第页
( )检测原始记录
检测人: 校核人: 审查人:
第页盐分分析测试原始记录
检测人: 校核人: 审查人:
第页分析测试( )原始记录
第页分析测试( )原始记录
№:
第页( )感官检测原始记录
第页致病菌检验记录
检测人: 校核人: 审查人:
第页
检测人: 校核人: 审查人:
第页
第页
分析测试( )原始记录
检测人: 校核人: 审查人:
第页
( )感官检测原始记录汇总
第页
( )分析测试原始记录
第页
细菌总数检验原始记录
第页
第页
第页
微生物()检验原始记录
第页
分析测试原始记录补充表
酵母菌检验记录
霉菌检验记录
填表说明
1.“样品编号”、“样品名称”、“检测项目”、“方法依据”栏内按检测任务通知单填写。
2.在完成最后测定步骤时记录环境温度和相对湿度。
3.根据检测任务通知单填写“以(原、干)样计”项,以原样计时,将干样划掉,反之亦然。
以干样计时,检测任务通知单上应注明样品水分含量数据。
4.承检产品标准中偏差的表述有允许差、重复性和方法偏差等,表示方法有平行差值、绝对差值、相对偏差绝对值和不超过平均值的××%等。
填写原始记录表格时,在“方法偏差”栏中的()内,填入标准中规定的允许差表示方法填写,如“(绝对差值)或(相对偏差绝对值)等”;并将具体表述值填写详细如≤×.×%或不大于×.×%等等。
标准中未规定的,写上“(标准中未规定)”;在结果偏差栏中的()内,如标准中规定了偏差的表示方法,()内的表示方法应和方法偏差相同;标准中未规定的,()内填上检测人员计算的偏差表示方法。
推荐使用相对偏差绝对值或绝对差值。
农残偏差可参照《农药残留实用检测方法手册(1)》农业部药检所编。
样品浓度(mg/kg) 变异系数(%)
1~10 10~25
0.1-1 25~50
0.01~0.1 50~100
0.001~0.01 100~200
5.修约结果栏内有效数字位数依据产品技术标准中所列指标的位数,如指标为××%,修约结果即为××%;如为××.×%,修约结果即为××.×%。
修约规则见有关规定。
修约结果为业务员汇总编制检验报告的依据。
6.回归方程表达式应为y=a+bx,a为截距,b为斜率。
如取对数等应表明。
7.“计算公式及计算”项中所有符号应与原始记录表中所列符号相符。
可用原始记录表中的符号代替标准中相对应的符号。
8.用“—”划在不具备项栏中间。
9.其它需要说明应填入“备注”栏。
10.室主任和业务员负责原始记录填写说明的执行情况,并有权要求不符合规范要求的表格重填,同时将填错表格一同存档备案。
作为对检测人员工作态度
和水平的考核依据之一,同时也是晋级和奖励的依据之一。