知识查询:
PH值与溶液中c(H+)定量关系 pH = -lgc(H+)
c(H+)/mol·L-1 pH
1
0
0.1
1
0.01
2
0.001
3
总结:溶液中c(H+)稀释到原来十分之一,
PH值增加一个单位。
第2页
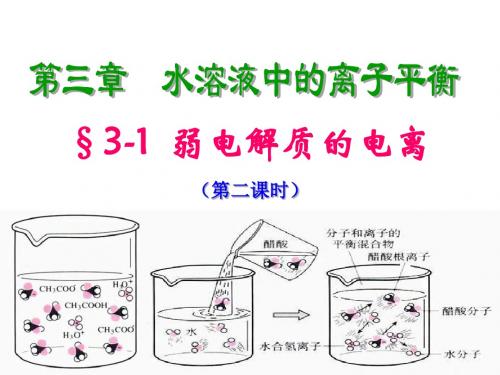
知识回顾: 电解质: 在水溶液中或熔化状态下能 够导电化合物。如盐酸、醋酸、氢氧 化钠、氯化钠等。
对试验现象解释: 等浓度盐酸中c(H+)比醋酸大。
第8页
试验探究2: 用pH试纸测定0.1mol/L 盐酸、醋酸pH。
结 论:
盐酸、醋酸电离程度不一样。 盐酸完全电离, 醋酸不完全电离, 电离程度较小。
第9页
一、强弱电解质
概念:
强电解质:在水中能够全部电离成离子 电解质。如强酸、强碱、大部分盐。
特 征
定:条件一定时,溶液中各分子、离子 浓度不变。溶液里现有离子又有分
子
? 变:条件改变时,电离平衡发生移动 第17页
3、外界条件对电离平衡影响 a. 浓度 b. 温度
第18页
试验探究3:
弱电解质浓度对电离平衡影响
CH3COOH
试验步骤:
CH3COO - + H+
1、测0. 1mol/L醋酸溶液pH
2、取一滴(约0.05ml) 0. 1mol/L醋 酸滴入50ml水中,测溶液PH
第19页
4、外界条件对电离平衡影响
a. 浓度 弱电解质浓度越大,电离程度越小 弱电解质浓度越小,电离程度越大
b. 温度 电离过程是吸热过程 温度升高,电离程度增大 温度降低,电离程度减小
第20页