物质的分类归纳总结
- 格式:doc
- 大小:25.55 KB
- 文档页数:2

中考化学复习知识点总结物质的分类物质的分类是化学中的一个重要内容,也是中考化学考试的重点之一、下面是关于物质的分类的知识点总结:1.物质的分类原则:(1)按物质的纯净程度分类:纯物质和混合物。
(2)按物质的组成分类:元素和化合物。
(3)按物质的状态分类:固体、液体和气体。
(4)按物质的性质分类:金属、非金属和半金属。
2.纯物质和混合物:(1)纯物质是由同一种物质组成的,有固定的化学组成,在一定条件下具有一定的物理性质和化学性质。
(2)混合物是由两种或两种以上的纯物质按一定比例物理上混合而成的,可以通过物理方法分离。
3.元素和化合物:(1)元素是由原子组成,是化学中最基本的物质单位,不能被化学方法分解成其他物质。
(2)化合物是由两种或两种以上元素以一定的化学组成比例通过化学反应联结而成的物质。
4.固体、液体和气体:(1)固体的分子间距离小,分子之间有规则排列,密度大,体积固定,不易被压缩。
(2)液体的分子间距离较大,可以流动,密度较小,体积不固定,不易被压缩。
(3)气体的分子间距离最大,自由运动,无固定体积和形状,可被压缩。
5.金属、非金属和半金属:(1)金属具有良好的导电性、导热性和延展性,大多数具有金属光泽,常为固态。
(2)非金属通常为气体、液体或固体,导电性、导热性较差,通常无金属光泽。
(3)半金属具有金属和非金属的一些性质,导电、导热性较差,弹性和脆性。
以上就是关于物质的分类的一些基本知识点。
中考化学复习时,可以通过复习这些知识点来加深对物质分类的理解,并结合实例进行巩固。
同时,还应重点掌握物质分类的应用,如根据物质的性质选择适当的分离纯化方法等。
希望对你的学习有所帮助!。

物质的分类与性质知识点总结一、物质的分类1.按照物质的组成部分分类物质可以分为纯物质和混合物。
纯物质是由同一种元素或者化合物组成的物质,它们具有固定的化学组成和一定的化学性质。
混合物是由两种或两种以上的物质混合而成的物质,它们的化学组成和性质可以变化。
2.按照物质的形态分类物质可以分为固体、液体和气体。
固体具有固定的形状和体积,分子间相对稳定,有一定的结构和规则排列方式。
液体具有固定的体积,但没有固定的形状,在容器中自由流动。
气体具有没有固定形状和体积的特点,可以自由扩散。
3.按照物质的电导性分类物质可以分为导电物质和非导电物质。
导电物质能够传导电流,如金属、溶解了电解质的水。
非导电物质不能传导电流,如纯水、木材等。
4.按照物质的溶解性分类物质可以分为可溶性物质和不溶性物质。
可溶性物质可以在溶剂中充分溶解,如食盐、糖等。
不溶性物质不能在溶剂中溶解,如石油、石蜡等。
二、物质的性质1.物理性质物质的物理性质是指物质所特有的、不改变其化学组成的性质。
例如,颜色、形状、密度、熔点、沸点、导电性等。
通过物质的物理性质可以进行物质的鉴定和分类。
2.化学性质物质的化学性质是指物质与其他物质发生化学变化时所表现出的性质。
例如,可燃性、氧化性、还原性等。
物质的化学性质决定了它在化学反应中的行为和变化。
3.燃烧性质物质的燃烧性质是指物质与氧气或其他氧化剂接触时能够发生燃烧反应的性质。
例如,可燃物质如木材、纸张等在适当的条件下能够与空气中的氧气发生燃烧反应。
4.酸碱性质物质的酸碱性质是指物质在水溶液中的酸碱程度。
酸性物质具有酸性,如柠檬汁、硫酸等;碱性物质具有碱性,如氢氧化钠、氨水等;中性物质的酸碱程度接近于中性,如纯水。
5.氧化还原性质物质的氧化还原性质是指物质与其他物质发生氧化还原反应时所表现出的性质。
氧化反应是指物质失去电子或增加氧化态,还原反应是指物质获得电子或减少氧化态。
三、物质分类与性质的应用1.环境保护了解不同物质的分类与性质,有助于我们正确处理和利用各种物质,避免产生有害物质对环境造成污染。

高中化学必修一知识点总结归纳第一节物质的分类1、掌握两种常见的分类方法:交叉分类法和树状分类法。
2、分散系及其分类:(1)分散系组成:分散剂和分散质,按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
(2)当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。
3、胶体:(1)常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。
(2)胶体的特性:能产生丁达尔效应。
区别胶体与其他分散系常用方法丁达尔效应。
胶体与其他分散系的本质区别是分散质粒子大小。
(3)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。
高中化学必修一知识点总结归纳(二)离子反应一、电解质和非电解质电解质:在水溶液里或熔融状态下能导电的化合物。
1、化合物非电解质:在水溶液中和熔融状态下都不能导电的化合物。
(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质。
)(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
(2)酸、碱、盐和水都是电解质(特殊:盐酸(混合物)电解质溶液)。
(3)能导电的物质不一定是电解质。
能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
电解质需在水溶液里或熔融状态下才能导电。
固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
2、溶液能够导电的原因:有能够自由移动的离子。
3、电离方程式:要注意配平,原子个数守恒,电荷数守恒。
如:Al2(SO4)3=2Al3++3SO42-二、离子反应:1、离子反应发生的条件:生成沉淀、生成气体、水。
2、离子方程式的书写:(写、拆、删、查)①写:写出正确的化学方程式。
(要注意配平。
)②拆:把易溶的强电解质(易容的盐、强酸、强碱)写成离子形式。
常见易溶的强电解质有:三大强酸(H2SO4、HCl、HNO3),四大强碱[NaOH、KOH、Ba (OH)2、Ca(OH)2(澄清石灰水拆,石灰乳不拆)],可溶性盐,这些物质拆成离子形式,其他物质一律保留化学式。

物质的分类知识点总结一、物质的基本概念物质是构成万物的基本要素,是宇宙中自然存在的一切实体的总称,是占据一定空间,有一定质量的任何事物的总称,是构成一切物体的基本成分。
物质是由微观粒子组成的,包括原子、分子等微粒。
物质是具有一定质量、占据一定空间、具有可观察性和可度量性的,是人们认识和利用的客观存在。
物质性质是物质的固有属性,成为物质被认识的依据。
物质的三态:固、液、气。
物质的基本概念包括物质的组成、性质和分类。
二、物质的组成1.原子原子是构成一切物质的基本微粒,是化学元素的最小单位,化学反应中不会分解的微粒。
原子是由质子、中子和电子组成。
2.分子分子是原子按照一定比例结合而成的,分子的组成是由原子组成的。
分子在化学反应中会发生改变,化学反应中发生的都是分子的变化。
分子的构成有原子殊,分子中原子的种类与比例确定了分子的性质。
3.离子离子是由失去或者获得电子而具有电荷的粒子,可以是单个原子,也可以是分子,称为单一离子,或者多个原子或分子部分组成的有电荷的团体,称为复合离子。
离子在水溶液中自由移动,具有导电性和电化学反应性。
三、物质的性质1.物质的物理性质物质的物理性质是指不改变物质本质情况下,其所具有的固有性质,可以通过物理方法进行观察和度量。
物质的物理性质包括:颜色、气味、密度、熔点、沸点、导电性、磁性等。
2.物质的化学性质物质的化学性质是指物质在与其他物质发生化学反应时所表现出的性质。
物质的化学性质是通过化学反应和实验才能得以确认。
物质的化学性质包括:与其他物质发生反应、氧化还原性、酸碱性、水解性等。
3.物质的结构性质物质的结构性质是指物质内部微观结构和组成的性质。
物质的结构性质决定了物质的各种物理和化学性质。
物质的结构性质包括:原子和分子的结构、离子的组合方式等。
四、物质的分类1.物质的分类方法物质的分类可以通过不同的角度和属性来进行分类,包括化学性质、物理性质、组成结构等方面的分类。
物质的分类方法包括:按组成结构分类、按化学性质分类、按物理性质分类等。

九年级上册化学知识点总结一、物质的分类1. 纯物质与混合物纯物质是由同种元素或者化合物组成的物质,分为元素和化合物两类。
混合物是由不同种物质按一定比例混合而成的物质。
2. 物质的三态物质存在的三种基本状态是固态、液态和气态。
固态分子之间靠近有序排列,液态分子之间稍松散,气态分子之间距离较远。
3. 物质的分类根据物质的电解性质,可将物质分为电解质和非电解质;根据物质的溶解性质,可将物质分为溶解性物质和不溶解性物质。
二、原子结构与元素周期表1. 原子结构原子结构由原子核和电子构成。
原子核由质子和中子组成,电子围绕原子核运动。
2. 元素周期表元素周期表是一种系统地排列化学元素的表格。
根据元素的原子序数从小到大排列,并按照电子结构的规律分组。
三、化学反应与化学方程式1. 化学反应的表示方法化学方程式是化学反应的表示方法,由反应物和生成物组成。
用化学式表示物质,用化学符号表示状态。
2. 化学反应的类型化学反应可以分为合成反应、分解反应、置换反应和氧化还原反应等。
四、离子与离子的组合1. 离子的形成当某种物质中的原子失去或获得电子时,就形成了对应的离子。
2. 离子的组合根据离子的电荷和大小,离子可以以不同比例结合形成离子化合物。
五、酸、碱和盐1. 酸酸是一类能够产生氢离子(H+)的物质,具有酸味、酸性导电和酸蚀性等特征。
2. 碱碱是一类能够产生氢氧根离子(OH-)的物质,具有苦味、碱性导电和腐蚀性等特征。
3. 盐盐是由酸和碱反应生成的离子化合物,具有解决在水中导电、晶体呈透明结晶等特征。
六、氧化还原反应1. 氧化还原反应的基本概念氧化还原反应是指在化学反应中,物质中的电子转移过程。
2. 氧化还原反应的判别规则氧化还原反应可以通过判别元素氧化态的变化来确定。
七、酸碱中和反应1. 酸碱中和反应的概念酸碱中和反应是指在适当的条件下,将酸与碱按化学计量比例混合时,产生中和盐和水的化学反应。
2. 酸碱指示剂酸碱指示剂可通过颜色变化指示酸碱溶液的酸碱性。

初中基础化学知识点总结一、物质的分类1. 纯粹物质和混合物纯粹物质是指组成它的所有微粒都是同种的,没有其他物质的任何杂质,如金属铁、氧气等。
混合物是由两种或两种以上的物质混合在一起而形成的物体,如砂糖水、空气等。
2. 元素和化合物元素是由同一种原子组成的物质,它是化学中不可再分的基本物质,如金、铜、氢气等。
化合物是由两种或两种以上的元素化合而成的物质,如水、二氧化碳等。
3. 物质的性质物质的性质主要包括物理性质和化学性质。
物理性质是物质自身固有的性质,如颜色、形状、硬度等;化学性质是物质与其他物质发生反应时所表现出来的性质,如燃烧、氧化等。
二、分子结构与周期表1. 原子结构原子是构成物质的基本微粒,由电子、质子和中子组成。
原子的核心是由质子和中子组成的,电子围绕原子核运动。
2. 分子结构分子是由两个以上的原子结合而成的,它是物质的最小单位,如水分子H2O,氧气分子O2等。
3. 元素的周期表元素周期表是按元素的原子序数(或电子排布的顺序)编制的表格。
元素周期表可以帮助我们了解元素的性质、特点、用途以及元素之间的关系。
三、化学反应1. 化学反应的基本概念化学反应是指物质之间产生新的物质的变化过程,通常包括物质的生成、反应物的消失等。
2. 化学反应的类型化学反应根据反应产物的不同可以分为合成反应、分解反应、置换反应和双替反应等几种类型。
3. 化学反应的平衡在化学反应中,有些反应不再继续进行,这时就达到了化学反应的平衡状态。
平衡态下,反应前后物质的浓度、压力等性质保持不变。
四、常见物质的性质和用途1. 金属的性质和用途金属主要包括铁、铜、铝、锌等。
金属具有导电性好、光亮、可塑性强等性质,广泛用于机械制造、电子电器、建筑材料等行业。
2. 非金属的性质和用途非金属主要包括氢气、氧气、氮气、硫磺等。
非金属通常具有不良导电性、易燃、易溶等性质,广泛用于化工、农业等行业。
3. 酸、碱、盐的性质和用途酸具有酸味、腐蚀性强、酸性指标低等性质,通常用于食品加工、制药等领域;碱具有碱味、腐蚀性弱、碱性指标高等性质,常用于清洁、肥料等领域;盐具有晶莹剔透、相对稳定等性质,广泛用于食品加工、化工生产等领域。

初三化学知识点总结归纳(完整版)初三化学知识点总结归纳(完整版)1. 物质的分类:- 纯净物:由同一种元素或化合物组成,具有确定的化学组成和固定的性质。
- 混合物:由不同种类的物质按一定比例混合而成,可以分离为其组成部分。
2. 物质的性质:- 物理性质:可通过观察和测量来确定,不改变物质的化学组成,如颜色、硬度、密度等。
- 化学性质:物质在不同条件下与其他物质发生反应时表现出来的性质,如燃烧、腐蚀等。
3. 常见的物质:- 元素:由同一种原子组成的物质,如氧、氢、铁等。
- 化合物:由不同元素的原子以一定的化学方式结合而成的物质,如水、二氧化碳、盐酸等。
- 混合物:由不同种类的物质按一定比例混合而成的物质,如空气、海水等。
4. 物质的分离方法:- 过滤:利用不同物质的颗粒大小,通过滤网或滤纸使固体物质与液体物质分离。
- 蒸发:利用物质的沸点差异,使液体物质蒸发成气体,留下固体物质。
- 蒸馏:利用物质的沸点差异,将混合物加热使某种物质沸腾后冷凝成液体,分离出纯净物质。
- 浓缩:通过蒸发去除溶剂中的水分,使溶液中物质浓度增高。
- 离心:利用物质的密度差异,使固体物质与液体物质分离。
5. 常见化学反应类型:- 合成反应:两个或多个物质反应生成一个新物质。
- 分解反应:一个物质分解成两个或多个不同物质。
- 双替反应:两个物质互相交换部分或全部原子组成。
- 氧化还原反应:涉及到电子的转移过程,氧化剂与还原剂相互作用。
- 酸碱反应:酸与碱反应生成盐和水。
6. 酸碱盐的性质:- 酸:味酸、蓝红试纸变红、与碱反应生成盐和水。
- 碱:味苦、滑润、红蓝试纸变蓝、与酸反应生成盐和水。
- 盐:晶体状、无色或白色、熔点高、在水中能导电。
7. 阳离子与阴离子:- 阳离子:带正电荷的离子,如金属离子。
- 阴离子:带负电荷的离子,如非金属离子。
8. 化学方程式:- 由反应物和生成物组成的化学式,表示了化学反应的物质的种类和数量关系。

五年级科学知识点归纳总结科学是对自然现象和规律的认识和探索,通过学习科学知识,我们可以更好地了解世界、解释现象,培养科学思维和方法论。
下面是对五年级科学知识的归纳总结。
一、物质与能量1. 物质的分类:固体、液体和气体。
物质的性质受到温度、压强、光照等因素的影响。
2. 物质的变化:物质可以发生物理变化和化学变化,物质的变化常伴随能量的变化。
3. 能量与传播:能量有多种形式,包括热能、光能、声能等。
能量可以通过传导、辐射和对流等方式传播。
二、生物与环境1. 动物:动物是生物的一类,具有生长、繁殖、运动、感知、呼吸等生命特征。
动物根据其食性和环境习性可以分为食草动物、食肉动物和杂食动物。
2. 植物:植物是生物的一类,具有光合作用、生长、繁殖等特征。
植物可以根据其生活习性分为陆生植物和水生植物。
3. 生物的生存条件:生物对于生存有一定的环境要求,包括适宜的温度、水分、光照和气体成分等。
三、天文与地理1. 星球与星系:地球是我们生活的星球,太阳是地球的主要能源。
地球围绕太阳公转,同时自转,产生了昼夜交替和四季变化。
2. 天气与气候:天气是指短时间内的大气状况,气候是指多年来的平均天气状况。
气象现象包括风、云、降水等。
3. 天体观测:利用望远镜可以观测到星星、行星等天体,了解宇宙的奥秘。
四、科学实践1. 观察与实验:通过观察和实验可以揭示自然规律,学习科学方法和思维。
观察要准确、仔细,实验要严谨、规范。
2. 数据与图表:通过收集和整理实验数据,可以用表格、图表等形式直观地展示和分析数据,得出结论。
3. 科学探究:科学探究是一种主动探索和解决问题的过程,培养科学思维和动手能力。
通过对五年级科学知识的归纳总结,我们可以更好地掌握物质与能量、生物与环境、天文与地理等方面的知识,提升对科学世界的认知和理解。
同时,科学实践的培养可以让我们学会观察和实验,培养科学思维和方法论,为未来的科学探索和学习打下坚实的基础。
让我们共同努力,发展科学知识,探索科学奥秘,为建设美好的科学世界贡献力量。

初中化学知识点的归纳与总结化学是一门研究物质组成、性质、结构以及相互转化的科学。
在初中阶段学习化学,我们接触到了许多重要的知识点。
本文将对初中化学知识点进行归纳与总结,以帮助大家复习和梳理这些重要概念。
一、物质的分类物质是构成世界的基本单位,根据其组成和性质的不同,可以将物质分为纯物质和混合物。
纯物质又可以分为化合物和元素,而混合物则包括溶液、悬浮液和胶体。
化合物是由两个或多个不同元素化合而成的物质。
例如,水(H2O)是由氢元素和氧元素化合而成的。
而元素是由同种原子组成的物质,比如氧气(O2)和金属铜(Cu)。
二、原子与分子原子是构成物质的最小单位,具有各自的质量和化学性质。
元素是由相同类型的原子组成的,而分子则是由两个或多个原子连接而成的。
化学方程式是表示化学反应的方式。
在化学方程式中,用化学符号表示元素和化合物,以及它们之间的反应方式和物质的摩尔比。
三、离子和离子化合物离子是带有正电荷或负电荷的原子或原子团,通过电子的转移而产生亦或受到分子间力的作用而稳定存在。
阳离子带有正电荷,阴离子带有负电荷。
离子化合物是由阳离子和阴离子以电子吸引力结合而成的化合物。
例如,氯化钠(NaCl)是由钠离子(Na+)和氯离子(Cl-)组成的。
四、化学反应与化学方程式化学反应是物质发生变化产生新物质的过程。
化学方程式是化学反应的符号表示。
化学反应可以分为合成反应、分解反应、置换反应和化合反应。
例如,2H2 + O2 → 2H2O表示了氢气和氧气反应生成水的合成反应。
五、酸碱中和反应酸是指能产生H+离子的化合物,碱是指能产生OH-离子的化合物。
酸和碱发生反应会产生盐和水,这种反应称为酸碱中和反应。
六、氧化还原反应氧化还原反应是指物质的氧化态和还原态发生变化的反应。
在氧化还原反应中,氧化剂接受电子,而还原剂失去电子。
这种反应常见于金属的腐蚀和化学电池的工作过程。
七、有机化合物有机化合物是由碳元素与氢元素和其他元素组成的化合物。

知识总结:1、物质的分类物质,指的是物理世界中所有存在的事物,是构成自然界的基本要素。
根据组成和性质的不同,物质可以分为多种类型,下面就分别进行介绍。
一、元素元素是指由同一种原子组成,具有独特的化学性质,无法用化学方法分解成更简单的物质的物质。
目前已知的元素有118个,它们分别以拉丁字母或其缩写命名。
元素在化学反应中可与其他元素结合形成化合物。
二、化合物化合物是由两种或两种以上不同元素通过化学反应结合而成的物质。
化合物具有独特的物理化学性质,它的化学式可以用化学符号表示。
例如,水(H2O)由氢元素和氧元素组成,具有比空气或氢气更大的密度和较高的沸点。
三、混合物混合物是由两种或两种以上不同物质通过物理方法混合在一起形成的物质。
混合物的物理和化学性质不固定,具体取决于组成混合物的各种物质,其由于组成比例和制备工艺不同而表现出不同的性质。
例如,饮料是一种混合物,由水,糖,柠檬汁等多种物质混合而成。
四、纯净物纯净物是指由同一种化学物质组成,具有确定的物理化学性质的物质。
这种物质是无法通过化学反应进一步分解的。
可以把化合物看做法纯净物,但事实上,即使是高纯度的化学物质,都存在着微量杂质。
例如,纯净的蒸馏水由H2O分子组成,不含其他物质。
五、离子化合物离子化合物是由正负电荷吸引而结合的化合物。
正离子是指失去一个或多个电子而带有正电荷的离子,常见的有Na+、K+、Mg2+等;负离子是指获得一个或多个电子而带有负电荷的离子,常见的有Cl-、SO42-、OH-等。
离子化合物在溶液中形成离子,表现出电解质特性,例如盐酸(HCl)溶于水可形成氢离子和氯离子。
总之,物质的分类根据物质的组成和性质不同而不同,分别为元素、化合物、混合物、纯净物和离子化合物。
了解这些物质的分类可以更好地理解自然界中的物质构成。
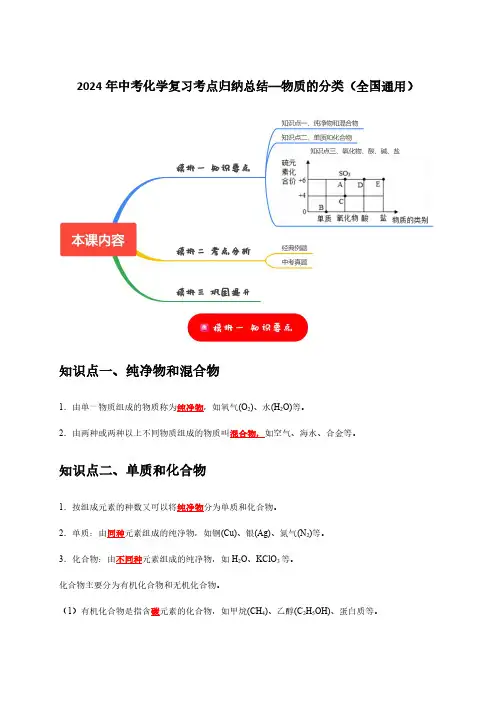
2024年中考化学复习考点归纳总结—物质的分类(全国通用)知识点一、纯净物和混合物1.由单一物质组成的物质称为纯净物,如氧气(O2)、水(H2O)等。
2.由两种或两种以上不同物质组成的物质叫混合物,如空气、海水、合金等。
知识点二、单质和化合物1.按组成元素的种数又可以将纯净物分为单质和化合物。
2.单质:由同种元素组成的纯净物,如铜(Cu)、银(Ag)、氮气(N2)等。
3.化合物:由不同种元素组成的纯净物,如H2O、KClO3等。
化合物主要分为有机化合物和无机化合物。
(1)有机化合物是指含碳元素的化合物,如甲烷(CH4)、乙醇(C2H5OH)、蛋白质等。
(2)无机化合物是指不含碳元素的化合物。
但有些含碳化合物也属于无机物,包括CO、CO2、H2CO3、Na2CO3(碳酸盐)和NaHCO3(碳酸氢盐)等。
【易错辨析】(1)区分混合物和纯净物时不看元素种类,看物质种类。
相同的元素可组成不同的物质,如H2O 和H2O2等。
(2)冰水混合物是纯净物而不是混合物。
知识点三、氧化物、酸、碱、盐1.氧化物:由两种元素组成,其中一种元素是氧元素的化合物,如CO2、H2O等。
2.酸:在水溶液中解离出的阳离子全部为H+的化合物,如HCl、H2SO4等。
3.碱:在水溶液中解离出的阴离子全部为OH-的化合物,如NaOH、Ca(OH)2、NH3·H2O等。
4.盐:由金属阳离子(或NH4+)与酸根阴离子构成的化合物,如NaCl、NaHCO3、K2MnO4等。
【易错辨析】(1)含有氧元素的化合物不一定是氧化物,如H2SO4是酸而不是氧化物。
(2)酸性物质不一定是酸,碱性物质不一定是碱。
考点一.从组成上识别氧化物1.(2023•永州)分类是学习和研究化学的常用方法。
下列物质属于氧化物的是()A.O3B.KMnO4C.CaO D.H2SO4【解答】解:A.O3是由氧元素组成的单质,不属于氧化物,故选项错误;B.KMnO4是由钾元素、锰元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;C.CaO是由钙元素和氧元素组成的化合物,属于氧化物,故选项正确;D.H2SO4是由氢元素、硫元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;故选:C。
初一化学知识点归纳一、物质的分类1.物质的分类标准:纯物质和混合物2.纯物质的分类:元素和化合物3.混合物的分类:均匀混合物和非均匀混合物二、元素与化合物1.元素的特点:由同种原子组成,不能通过化学反应分解成其他物质2.化合物的特点:由两种或两种以上不同元素按照一定比例结合而成,具有新的化学性质三、化学符号和化学方程式1.化学符号的意义:用于表示元素和化合物2.化学方程式的构成:反应物和生成物的化学符号,反应物在左侧,生成物在右侧,通过箭头表示反应过程四、化学反应1.化学反应的条件:温度、压力、光照等2.化学反应的类型:合成反应、分解反应、置换反应、还原反应、氧化反应等五、常见化学实验1.酸碱中和实验:通过加入酸碱指示剂来判断溶液的酸碱性2.金属活性实验:将金属与酸反应,观察气体的产生和溶液的变化,判断金属的活性3.酸碱中和实验:通过加入酸碱指示剂来判断溶液的酸碱性六、常见物质的性质和用途1.金属的性质和用途:导电性强、延展性好,用于制造器具、建筑材料等2.非金属的性质和用途:导电性差,用于制造绝缘材料、电子元器件等3.常见酸碱的性质和用途:酸具有酸味、腐蚀性强,用于实验室分析和工业生产;碱具有苦味、腐蚀性强,用于清洁剂、制药等行业七、常见化学现象的解释1.物体的燃烧现象:燃烧是物质与氧气发生化学反应,产生热和光2.溶解现象:溶解是固体、液体或气体溶质与溶剂之间的相互作用,形成溶液3.金属腐蚀现象:金属与氧气、水等发生反应,产生氧化物,使金属表面发生变化八、环境保护与化学1.大气污染与化学反应:燃烧反应产生的废气会造成大气污染,如二氧化硫、二氧化氮等2.水污染与化学反应:工业废水中的有害物质会与水中的化合物发生反应,导致水污染3.垃圾处理与化学反应:垃圾焚烧过程中会产生二氧化碳、水蒸气等废气九、化学的应用领域1.化学在医学中的应用:药物的研发和制造、疾病的诊断等2.化学在农业中的应用:农药的研发和使用、肥料的制造等3.化学在工业中的应用:合成材料的制造、化工产品的生产等总结:初一化学主要涉及物质的分类、元素与化合物、化学符号和化学方程式、化学反应、常见化学实验、常见物质的性质和用途、常见化学现象的解释、环境保护与化学以及化学的应用领域等知识点。
高一化学知识点总结大全(非常全面)1500字化学是一门研究物质组成、结构、性质、变化以及与能量的相互关系的科学。
下面是高一化学的知识点总结:1. 物质的分类:- 纯物质和混合物:纯物质由同种组成物质组成,混合物由不同组成物质组成。
- 元素和化合物:元素是由同种原子组成的物质,化合物是由不同元素的原子组成的物质。
- 四态物质:固体、液体、气体、等离子体。
2. 原子结构:- 原子核:由质子和中子组成,带有正电荷。
- 电子:带有负电荷,围绕原子核的轨道运动。
- 元素的原子序数:等于原子核中质子的个数。
3. 原子键:- 金属键:金属元素中的电子云形成共享。
- 离子键:金属和非金属元素之间的电子转移形成。
- 共价键:非金属元素中的电子云形成共享。
4. 化学式和化学方程式:- 元素符号:用来表示元素的符号,如H代表氢。
- 化学式:用来表示化合物的符号,如H2O代表水。
- 化学反应方程式:用来表示化学反应的符号,如2H2 + O2 → 2H2O表示氢气与氧气生成水。
5. 物质的质量关系:- 相对原子质量:相对于碳-12同位素的原子质量。
- 电子的相对质量:1/2000。
- 相对分子质量:分子中各原子质量之和。
- 相对分子质量计算:元素相对原子质量之和。
- 化学计量:化学方程式中各物质的质量比。
6. 化学反应:- 反应速度:反应物浓度、温度、表面积和触媒等影响反应速度。
- 反应热:反应过程中吸热或放热。
- 化学平衡:正向反应和逆向反应的速率相等。
- 平衡常数:用来表示反应在平衡时物质浓度的比例。
7. 酸碱反应:- 酸:产生H+离子的物质,具有酸性。
- 碱:产生OH-离子的物质,具有碱性。
- 酸碱指示剂:用来判断溶液是酸性还是碱性的物质。
- pH值:表示溶液的酸碱程度,pH<7为酸性,pH>7为碱性,pH=7为中性。
8. 氧化还原反应:- 氧化:物质失去电子。
- 还原:物质获得电子。
- 氧化剂:能使其他物质氧化的物质。
物质的分类与性质知识点总结一、引言物质是构成宇宙万物的基本要素,根据其性质和组成可进行不同的分类。
本文将总结物质的分类和性质知识点,以帮助读者更好地了解物质世界。
二、物质的分类1. 物质的物理性质分类a. 根据物质的形态可分为固体、液体和气体。
固体具有一定的形状和体积,分子之间相互紧密排列;液体无固定形状,具有一定的体积,分子之间相互较为接近;气体具有自由的分子运动,无固定形状和体积。
b. 根据物质的可溶性可分为溶解和不溶解物质。
溶解物质指能够在某种溶剂中形成均匀混合物的物质,如盐溶于水;不溶解物质指不能在某种溶剂中形成均匀混合物的物质,如油不溶于水。
2. 物质的化学性质分类a. 酸、碱和中性物质。
酸性物质具有酸性质,如酸味、能溶解金属等;碱性物质具有碱性质,如苦味、能与酸发生中和反应等;中性物质既不呈酸性也不呈碱性,如水。
b. 氧化物和还原物。
氧化物指与氧元素结合形成的化合物,如二氧化碳;还原物指具有还原性质,能和氧化物反应释放出氧气的物质,如氢气。
c. 沉淀物和溶液。
沉淀物指在溶液中形成的不溶性物质,如白石灰溶液中产生的白色沉淀;溶液指由溶剂和溶质组成的均匀混合物,如盐溶于水形成的溶液。
三、物质的性质1. 密度和相对密度物质的密度指单位体积的物质所具有的质量。
相对密度指物质的密度和水的密度之比。
密度和相对密度可帮助我们判断物质的轻重和浓淡程度。
2. 状态变化物质在不同的温度和压力下,会发生固态、液态和气态之间的转变。
例如,固体在加热时会熔化成液体,液体在加热时会汽化成气体。
3. 导电性和导热性金属是良好的导电和导热材料,可以传导电流和热量。
非金属则多数不具备导电和导热性。
4. 反应性物质的反应性由其化学性质决定。
例如,易燃物质具有较高的可燃性,能与氧气发生燃烧反应;不活泼金属具有较低的反应性,不易与其他物质发生反应。
五、结论物质的分类与性质是化学科学的基础知识,具有重要的实际应用价值。
了解物质的分类与性质,有助于我们更好地理解和应用化学知识,促进科学技术的发展和进步。
初中化学必背知识总结归纳一、基础概念:1.物质的分类:元素、化合物、混合物2.物质的性质:物理性质、化学性质3.物质的状态:固体、液体、气体4.物质的分解与合成:分解反应、合成反应5.元素的纯度:纯净物、杂质、纯度计算6.物质的质量守恒定律:质量守恒的实验依据、质量守恒的意义二、元素和化合物:1.元素符号的命名:元素符号、元素名称、元素周期表2.元素的性质和应用:非金属元素、金属元素、半金属元素3.化合物的命名:离子化合物、分子化合物、酸、碱、氧化物的命名4.化合物的性质与应用:离子化合物、分子化合物、酸、碱、氧化物的性质、常见化合物的应用三、离子反应及离子方程式:1.离子和离子反应:离子的概念、同种离子的相互作用、异种离子的相互作用2.水的电离和酸碱性:电离的概念、酸碱性的判断、pH值的定义、酸碱中和反应3.离子反应和离子方程式:离子反应的特点、离子方程式的书写、电离方程式的应用四、化学反应的速率与平衡:1.化学反应的速率:反应速率和反应速率的影响因素、反应速率的计算2.化学平衡:平衡的特点、平衡常数的意义和计算、化学平衡的影响因素3.动态平衡:正向反应与逆向反应、平衡常数与反应速率的关系、平衡移动的影响因素五、氧化还原反应:1.氧化还原反应基本概念:氧化、还原、氧化数、氧化还原反应的判断2.氧化还原反应的种类:合成反应、分解反应、取代反应、氧化反应和还原反应3.氧化还原反应的应用:金属腐蚀、电池、化学电镀、自然界的氧化还原反应六、酸碱中的溶液:1.酸碱中的盐类:酸的性质、碱的性质、盐的性质、酒石酸的性质2.酸碱中的指示剂:指示剂的种类、酸碱中的指示剂选择3.酸碱中的酸碱度:酸碱度的定义、浓度和pH值的关系、酸碱中和反应的应用七、离子的检验:1.离子的检验方法:阳离子的检验、阴离子的检验2.离子的检验实验:离子的实验室检验实验、离子的测试管检验实验八、化学实验:1.化学实验的基本步骤:观察、提问、假设、实验、总结2.化学实验的基本仪器:试管、分液漏斗、量筒、烧杯等3.化学实验中的安全知识:安全操作、防范化学危险4.化学实验的实验记录与实验报告:实验记录内容、实验报告的写作格式总结:初中化学知识的学习重点在于基础概念的掌握,其中包括物质的分类与性质、元素和化合物的命名与性质、离子反应及离子方程式、化学反应的速率与平衡、氧化还原反应、酸碱中的溶液以及离子的检验方法等。
高一的化学知识点归纳总结一、物质的性质和分类1. 物质的分类(1) 按物质的状态分为固体、液体、气体。
(2) 按物质的组成方式分为元素和化合物。
2. 物质的性质(1) 物质的物理性质包括颜色、形状、硬度、密度、熔点、沸点等。
(2) 物质的化学性质包括燃烧、氧化、还原等。
二、元素和化合物1. 元素(1) 元素是由同种原子组成的物质,其化学符号由拉丁文或英文缩写组成。
(2) 元素根据其化合价可以分为金属元素和非金属元素。
2. 化合物(1) 化合物是由两种或两种以上的元素按一定的比例结合而成的物质。
(2) 化合物的化学式表示了元素之间的种类和数量比例。
三、分子和离子1. 分子(1) 分子是由两个或两个以上的原子通过共价键结合而成的物质。
(2) 分子的化学式是由原子符号组成,表示了分子中各种原子的数量比例。
2. 离子(1) 离子是由失去或获得电子而带正负电荷的原子或原子团。
(2) 离子根据带电荷的不同可以分为阳离子和阴离子。
四、化学方程式和化学反应1. 化学方程式(1) 化学方程式是表示化学反应的关系式,由反应物、生成物和反应条件组成。
(2) 化学方程式中的反应物和生成物可以根据能量变化分为放热反应和吸热反应。
2. 化学反应(1) 化学反应是指原子核、电子云或化学键发生变化,导致物质的性质和组成发生改变的过程。
(2) 化学反应根据反应物和生成物的物质状态可以分为气体反应、固体反应和溶液反应。
五、化学键和离子键1. 化学键(1) 化学键是原子通过空间的电子云相互吸引而形成的共价键或离子键。
(2) 共价键形成的分子通常是非金属元素通过共用电子而形成的。
2. 离子键(1) 离子键是离子之间通过静电力相互吸引而形成的一种化学键。
(2) 离子键形成的化合物通常是金属元素与非金属元素之间的结合。
六、化学式和化合价1. 化学式(1) 化合物的化学式是由元素符号和原子数量指数组成的表示结构的符号。
(2) 化学式可以根据元素的种类和数量比例表示化合物的结构和组成。
八上册化学知识点总结第一章:物质的分类一、物质的分类1. 纯净物质:由同一种物质构成,不含其他物质。
如金属元素、非金属元素、化合物等。
2. 混合物:由两种或两种以上的物质混合而成。
如空气、海水、土壤等。
3. 物质的分类方法:(1)按性质分类:按化学性质可以分为元素和化合物;按物理性质可以分为固体、液体和气体。
(2)按构成分类:可以分为单质和化合物的混合物。
4. 物质的变化:物质经历着化学反应或物理变化而改变它的性质。
5. 实验室常用的纯净物质分离方法:(1)过滤:用于分离固液混合物。
(2)挥发:用于分离溶质与溶剂。
(3)结晶:用于分离固体混合物中的单质。
(4)沉淀法:利用沉淀物的特性分离物质。
(5)蒸馏:利用液体的气化性质分离物质。
二、元素和化合物1. 元素:由同一种原子组成的纯净物质。
2. 化合物:由两种或两种以上的不同元素通过化学反应结合而成。
3. 元素和化合物性质的不同:(1)元素是由同一种原子组成的,化合物是由不同元素组成的。
(2)元素可以通过化学反应生成化合物,化合物通过化学反应可以分解成元素。
(3)元素可以在化学反应中发生单质反应,而化合物无法发生单质反应。
三、物理变化和化学变化1. 物理变化:物质的组成成分没有改变,仅仅是其外在性质发生了改变。
2. 化学变化:物质的组成成分发生了改变,新的物质形成。
3. 物理变化和化学变化的区别:(1)在物理变化中,物质的化学性质不发生改变,化学变化中,物质的化学性质发生了改变。
(2)物理变化可以通过物理手段恢复原状,化学变化不能通过物理手段恢复原状。
(3)在化学反应中,反应物与生成物的质量不变。
第二章:原子结构一、原子的结构1. 原子的基本组成部分:电子、质子、中子。
2. 亚原子粒子:电子、质子、中子。
3. 原子核:由质子和中子构成,占据整个原子的绝大部分质量。
4. 原子的电子层次分布规律:K层最多2个、L层最多8个、M层最多18个。
5. 质子与电子的数目相等,原子是电中性。
物质的分类
混合物:由两种或者两种以上物质组成
(空气、自来水、溶液、)你还知道哪些:
单质:只含有一种元素
物质的分类(氧气O2、氢气H2、金刚石C、铁Fe)你还知道哪些:
纯净物:只含有一种物质
(能写出化学式的物质)氧化物:
(一氧化碳CO、水H2O、氧化铁Fe2O3、氧化镁MgO)
你还知道哪些
酸:
五种常见的酸:盐酸硫酸硝酸碳酸醋酸
化合物:含有两种或者两种以上的元素()()()()()
碱:
常见的可溶性碱
氢氧化钠()氢氧化钾()氢氧化钙()
盐:
氯化钠()硫酸钠()碳酸钠()
硫酸钾()碳酸钾()硝酸钾()
氯化铵()硝酸铵()硫酸铵()
纯净物的第二种分类方法
固体非金属:硅()碳()硼()硫()磷()名称带有“石”字旁
由原子直接构成的物质稀有气体:氦()氖()氩()氪()氙()氡()
金属:铁()铜()银()锌()钾()钙()钠()镁()铝()
注:由原子直接构成的物质由单个的元素符号直接表示该种物质,化学式中没有下标数字,只含有一种元素所以一定为单质纯净物由分子构成的物质:水()和大多数常温下为气态的物质,如氢气()氧气()氮气()二氧化碳()
碱:氢氧化钠()氢氧化钾()氢氧化钙()
盐:铵盐氯化铵()硝酸铵()硫酸铵()
钠盐钾盐
由离子构成的物质氯化钠()氯化钾()氯化钙()氯化镁()盐酸盐
硫酸钠()硫酸钾()硫酸盐
碳酸钠()碳酸钾()碳酸氢钠()碳酸盐
硝酸钠()硝酸钾()硝酸盐
活泼金属氧化物:氧化镁()氧化铁()氧化铝()氧化钾()氧化钠()。