物质的分类及其转化
- 格式:ppt
- 大小:2.43 MB
- 文档页数:5


物质分类及转化
物质可以根据其化学性质和物理性质进行分类。
根据化学性质,物质可以分为元素和化合物。
元素是由同种原子组成的纯物质,例如氧气和金属铁。
化合物是由两个或更多不同种类的原子组成的纯物质,例如水和二氧化碳。
根据物理性质,物质可以分为固体、液体和气体。
固体是具有固定形状和体积的物质,例如冰和金属。
液体是具有固定体积但没有固定形状的物质,例如水和酒精。
气体是没有固定形状和体积的物质,可以自由流动,例如空气和氧气。
物质可以通过物质转化发生化学反应。
化学反应是一种将一种或多种物质转化为另一种或多种物质的过程。
这些反应可以是不可逆转的,也可以是可逆转的。
物质转化可以分为化学变化和物理变化。
化学变化是指物质发生化学反应,并产生新的物质,例如燃烧和腐烂。
物理变化是指物质改变其物理状态,但其化学组成不发生改变,例如物质的相变(如熔化和汽化)和溶解。
总的来说,物质可以通过化学反应进行分类和转化,从一个化学物质转变成另一个。
同时,根据物质的性质和形态,我们也可以对物质进行分类。


高中化学必修一专题一:物质的分类及转化(经典实用)
物质的分类及转化是高中化学必修一的重要内容,该专题主要介绍了物质的分类方法和物质的转化规律。
以下是该专题的经典实用内容:
一、物质的分类方法:
1.按性质分类:可以根据物质的物理性质、化学性质、生物性
质等进行分类,如固体、液体、气体;酸、碱、盐等。
2.按组成分类:可以根据物质的基本组成单位进行分类,如元素、化合物、混合物等。
3.按来源分类:可以根据物质的来源进行分类,如天然物质和
人工合成物质等。
二、物质的转化规律:
1.物理变化:指物质在不改变其化学成分的情况下,发生形状、颜色、状态等方面的改变。
如溶解、汽化、凝固等。
2.化学变化:指物质在发生化学反应过程中,形成新的物质,
即产生化学变化。
如燃烧、酸碱中和、金属与酸反应等。
三、化学方程式:
1.化学方程式用化学符号和化学式表示化学反应的物质的种类
和数量关系。
反应物在化学方程式的左边,生成物在右边,用箭头分隔。
2.化学方程式还可以表示反应的摩尔比例关系和反应的能量变化。
四、化学反应的计算:
1.摩尔与质量的转化:可以利用化学方程式中物质的摩尔比例关系,通过已知物质的摩尔数或质量,计算其他物质的摩尔数或质量。
2.气体体积与摩尔数的关系:在一定的温度和压强下,气体的体积与物质的摩尔数成正比关系。
可以利用这一关系,计算反应物或生成物的摩尔数或体积。
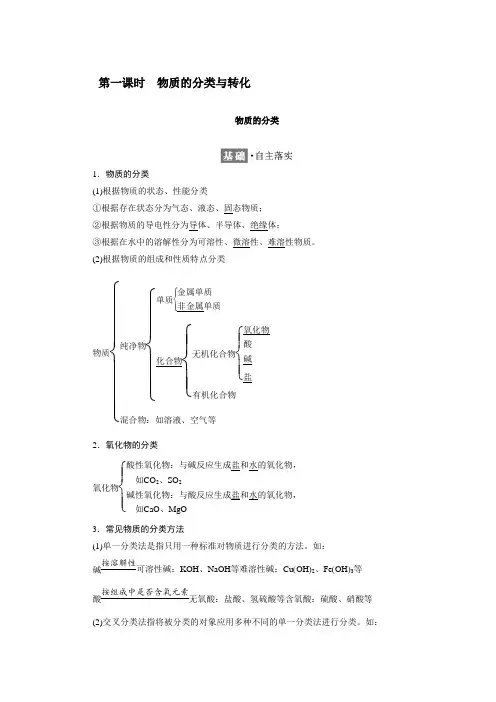
第一课时 物质的分类与转化物质的分类1.物质的分类(1)根据物质的状态、性能分类①根据存在状态分为气态、液态、固态物质; ②根据物质的导电性分为导体、半导体、绝缘体; ③根据在水中的溶解性分为可溶性、微溶性、难溶性物质。
(2)根据物质的组成和性质特点分类物质⎩⎪⎪⎪⎨⎪⎪⎪⎧纯净物⎩⎪⎪⎨⎪⎪⎧ 单质⎩⎪⎨⎪⎧ 金属单质非金属单质化合物⎩⎪⎨⎪⎧无机化合物⎩⎪⎨⎪⎧ 氧化物酸碱盐有机化合物混合物:如溶液、空气等2.氧化物的分类氧化物⎩⎪⎨⎪⎧酸性氧化物:与碱反应生成盐和水的氧化物,如CO 2、SO2碱性氧化物:与酸反应生成盐和水的氧化物,如CaO 、MgO3.常见物质的分类方法(1)单一分类法是指只用一种标准对物质进行分类的方法。
如: 碱按溶解性可溶性碱:KOH 、NaOH 等难溶性碱:Cu (OH )2、Fe (OH )3等 酸按组成中是否含氧元素无氧酸:盐酸、氢硫酸等含氧酸:硫酸、硝酸等(2)交叉分类法指将被分类的对象应用多种不同的单一分类法进行分类。
如:(3)树状分类法是根据被分对象的整体与分出的类型间关系的阵列式形状(像树)来定义的。
如:1.酸性氧化物都是非金属氧化物吗?非金属氧化物都是酸性氧化物吗?提示:不是;不是。
2.碱性氧化物都是金属氧化物吗?金属氧化物都是碱性氧化物吗?提示:是;不是。
(1)氧化物按组成元素可分为金属氧化物和非金属氧化物。
从性质上可分为酸性氧化物(如CO2、SO2等)、碱性氧化物(如CaO、MgO等)、两性氧化物(如Al2O3)、不成盐氧化物(如CO、NO等)。
金属氧化物不一定都是碱性氧化物,如Al2O3是两性氧化物,而Mn2O7属于酸性氧化物。
(2)酸性氧化物可能是非金属氧化物(如CO2),也可能是金属氧化物(如Mn2O7)。
非金属氧化物不一定就是酸性氧化物(如CO、NO等)。
(3)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Na2O2、Mn2O7等)。


物质的分类及转换一、物质的分类物质是构成宇宙的基本单位,根据其性质和组成不同,可以将物质分为三类:元素、化合物和混合物。
1. 元素元素是由相同类型的原子组成的纯物质。
目前已知的元素有118种,包括氢、氧、铁等。
元素具有固定的化学性质,无法通过常规的物理或化学方法分解成其他物质。
2. 化合物化合物是由不同类型的原子通过化学键结合而成的物质。
化合物具有独特的化学性质,可以通过化学反应分解成更简单的物质。
例如,水是由氢和氧元素组成的化合物,可以通过电解或加热分解为氢气和氧气。
3. 混合物混合物是由两种或更多种不同物质混合而成的物质。
混合物的组成和性质可以不均匀,可以通过物理方法如过滤、蒸馏等分离成各个组成部分。
例如,空气是由氮气、氧气、水蒸气等气体组成的混合物,可以通过液化或净化过程分离出其中的组分。
二、物质的转换物质在自然界中不断发生着各种转换过程,包括物质的相变、化学反应等。
1. 相变相变是物质由一种相态转变为另一种相态的过程。
常见的相变有固态到液态的熔化、液态到气态的蒸发、气态到液态的凝结以及液态到固态的凝固等。
相变过程中,物质的化学组成不发生改变,只是其分子或原子的排列方式发生改变。
2. 化学反应化学反应是指物质之间发生化学变化的过程。
在化学反应中,原有物质的化学键被打破,新的化学键形成,导致物质的性质发生明显的变化。
化学反应可以分为合成反应、分解反应、置换反应、氧化还原反应等多种类型。
例如,燃烧是一种常见的氧化反应,燃料与氧气反应产生二氧化碳和水。
3. 核反应核反应是指原子核发生变化的过程,通常涉及到原子核的裂变或聚变。
核反应具有巨大的能量释放,是核能利用的基础。
例如,核裂变反应是指重核裂变成轻核的过程,核聚变反应是指轻核聚变成重核的过程。
4. 生物转化生物转化是指生物体内发生的各种化学反应和代谢过程。
生物转化是生命活动的基础,包括有机物的合成、分解、氧化还原等过程。
例如,光合作用是一种生物转化过程,植物利用光能将二氧化碳和水合成为有机物,释放出氧气。

物质的分类及转化
物质转化是化学中极为重要的概念,其概念涉及物质的分类和相互转化。
该领域关乎大量的科学研究及社会管理,对于高校和高等教育具有深远的影响。
物质的分类
按照物质的组成及内部结构,物质可以分为三类:化合物、元素和混合物。
化合物是由原子组成,其内部结构受到化学键的控制,特性会因组成元素的不同而有所不同,比如水和乙醇就是两种不同的化合物;元素就是单独的组分,它们的内部结构不受外界的改变,它们的特性由其本身决定,比如氢、氧和铁都是元素;混合物就是由两种或更多的组分混合在一起的物质,它的内部结构受外界的改变,它的特性由其本身决定,但它由于混合,而呈现出特有的特性,比如混合气体、混合液体和混合固体都是由多种物质混合而成的混合物。
物质的转化
物质不仅可以分类,在高校和高等教育中,也要求学生掌握物质的转化知识。
物质的转化包括四种基本形式:化学转化、物理转化、核转化和生物转化。
化学转化是指两种物质之间在反应条件下相互转化,其中包括几类转化:分解反应、复分解反应、合成反应、氧化还原反应等;物理转化是指物质在物理作用下,改变形态和性质,但不改变其化学组成,常见的物理转化有渗透、冻结、沸腾和熔融等;核转化是指破坏原子核的稳定性而发生的核反应,常见的核转化有核衰变和核裂变等;生物转化是指物质在生物的影响下,发生的生化反应,典型的例子是光合作用,在其中物质能够实现从光合电子传递和产生氧化还原反应。
物质转化为高校和高等教育产生了重要影响,当学生能够掌握并利用物质的分类和转化时,能够更好地理解生活中的化学现象,从而获得更多的学科知识。

高一化学物质的分类及转化知识点。
一、物质的分类物质是构成一切物体的基本单位,根据其组成和性质的不同,可以将物质分为纯物质和混合物。
1. 纯物质纯物质是由同种类型的分子或原子组成的物质,具有确定的化学组成和独特的性质。
根据纯物质的组成和性质,可以分为元素和化合物。
元素是由同种类型的原子组成的纯物质,无法通过化学方法分解成其他物质。
元素可以进一步分为金属元素、非金属元素和半金属元素等。
化合物是由两种或两种以上不同元素的原子通过化学键结合而成的纯物质。
化合物具有独特的化学性质,可以通过化学方法分解成其他物质。
2. 混合物混合物是由两种或两种以上不同纯物质按一定比例混合而成的物质。
混合物可以通过物理方法分离成组成它的纯物质。
根据混合物的形态和组成,可以分为气体混合物、液体混合物和固体混合物等。
二、物质的转化物质的转化是指物质在化学反应中发生原子、分子或离子的重组,形成新的物质的过程。
物质的转化可以分为化学变化和物理变化两种类型。
1. 化学变化化学变化是指物质在化学反应中发生原子、分子或离子的重组,形成新的物质的过程。
化学变化伴随着化学键的形成、断裂和能量的释放或吸收。
化学变化是永久性的,不可逆转的。
化学变化的特征包括:(1) 颜色的变化:反应前后物质的颜色发生明显变化。
(2) 气体的产生:反应中产生气体,如气泡、气味等。
(3) 沉淀的生成:反应中形成不溶于反应溶液的固体沉淀。
(4) 温度的变化:反应过程中放热或吸热,导致温度的升高或降低。
(5) 光的发射或吸收:反应中产生光的现象,如发光、发热等。
2. 物理变化物理变化是指物质在物理条件下发生形态或性质的改变,但其化学组成不发生变化的过程。
物理变化可以是可逆的,通过改变物理条件可以恢复原有的物质。
常见的物理变化包括:(1) 相变:物质由一个相态转变成另一个相态,如固体溶解成液体、固体升华成气体等。
(2) 研磨、切割等:物质的形态或大小发生改变,但其化学组成没有发生变化。

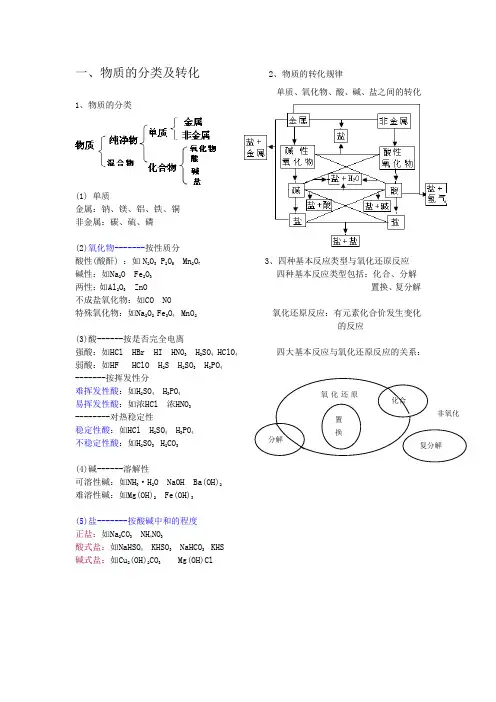
一、物质的分类及转化 2、物质的转化规律单质、氧化物、酸、碱、盐之间的转化1、物质的分类(1) 单质金属:钠、镁、铝、铁、铜 非金属:碳、硫、磷(2)氧化物-------按性质分酸性(酸酐) :如N 2O 3 P 2O 5 Mn 2O 7 3、四种基本反应类型与氧化还原反应 碱性:如Na 2O Fe 2O 3 四种基本反应类型包括:化合、分解 两性:如Al 2O 3 ZnO 置换、复分解 不成盐氧化物:如CO NO特殊氧化物:如Na 2O 2 Fe 3O 4 MnO 2 氧化还原反应:有元素化合价发生变化的反应(3)酸------按是否完全电离强酸:如HCl HBr HI HNO 3 H 2SO 4 HClO 4 四大基本反应与氧化还原反应的关系: 弱酸:如HF HClO H 2S H 2SO 3 H 3PO 4-------按挥发性分难挥发性酸:如H 2SO 4 H 3PO 4 易挥发性酸:如浓HCl 浓HNO 3--------对热稳定性 稳定性酸:如HCl H 2SO 4 H 3PO 4 不稳定性酸:如H 2SO 3 H 2CO 3(4)碱------溶解性可溶性碱:如NH 3·H 2O NaOH Ba(OH)2 难溶性碱:如Mg(OH)2 Fe(OH)3(5)盐-------按酸碱中和的程度 正盐:如Na 2CO 3 NH 4NO 3酸式盐:如NaHSO 4 KHSO 3 NaHCO 3 KHS 碱式盐:如Cu 2(OH)2CO 3 Mg(OH)Cl练习:1.下列含有相同元素的化合物组是A.O 2 O 3B.CO CO 2C.KCl AlCl 3D.NaHCO 3、NaHSO 4 2.下列属于纯净物的是A.盐酸B.空气C.Fe 3O 4D.大理石3.由以下给定化合价的五种元素H +1、S +6、O -2、K +1、Na +1,最多可以组成( )种化合物 A .9 B .10 C .11 D .12 4.下列物质属于酸性氧化物的是A.Na 2OB.COC.CaOD.SO 2 5.下列说法正确的是A.酸性氧化物都是非金属氧化物B.非金属氧化物都是酸性氧化物C.金属氧化物都是碱性氧化物D.碱性氧化物都是金属氧化物6.将下列各组物质按酸、碱、盐分类顺序排列,正确的是 A.硫酸,纯碱,石灰石 B.醋酸,烧碱,硫酸铜 C.磷酸,熟石灰,苛性钾 D.醋酸,小苏打,熟石灰 7、下列物质的分类正确的是( )8、若将以下化合物按硫元素的化合价分为三组,请把化学式填在相应短线上。
高一化学物质的分类及转化化学是一门研究物质的科学,它主要关注物质的分类和转化。
在高中化学课程中,学生需要学习物质的分类及其转化的基本概念和原理。
以下是一个关于高一化学物质分类及转化的详细讲解。
第一部分:物质的分类1. 物质的基本分类1.1. 纯物质和混合物1.1.1. 纯物质:由同一种类型的物质组成,具有固定的化学组成和特定的性质。
可以分为元素和化合物。
1.1.2. 混合物:由两种或更多种不同的物质混合而成,可以分为均匀混合物和非均匀混合物。
1.2. 元素和化合物1.2.1. 元素:由同一种类型的原子组成,无法通过化学方法分解成其他物质。
1.2.2. 化合物:由两种或更多种不同元素的原子以确定的化学比例结合而成,可以通过化学方法分解成其他物质。
2. 物质的进一步分类2.1. 元素的分类2.1.1. 金属元素:具有良好的导电性、导热性和延展性,大部分为固体。
2.1.2. 非金属元素:导电性和导热性较差,大部分为气体或固体。
2.1.3. 过渡元素:位于周期表中B族元素的区域,具有特殊的化学性质。
2.2. 化合物的分类2.2.1. 无机化合物:主要由金属和非金属元素组成。
2.2.2. 有机化合物:主要由碳和氢元素组成,通常还包含其他非金属元素。
第二部分:物质的转化1. 物质的化学变化1.1. 化学反应的基本概念1.1.1. 反应物和生成物:反应物是参与反应的物质,生成物是反应后生成的物质。
1.1.2. 反应的化学方程式:用化学符号和化学式表示化学反应过程。
1.2. 化学反应的类型1.2.1. 合成反应:两个或更多物质结合成一个新物质。
1.2.2. 分解反应:一个物质分解成两个或更多的物质。
1.2.3. 置换反应:一个元素或离子取代另一个元素或离子。
1.2.4. 双替换反应:两个化合物中的离子交换位置。
2. 物质的物理变化2.1. 物质的相态变化2.1.1. 固态到液态:熔化2.1.2. 液态到气态:汽化2.1.3. 固态到气态:升华2.1.4. 气态到液态:凝结2.1.5. 液态到固态:凝固2.2. 物质的溶解和溶液2.2.1. 溶解:溶质分子或离子与溶剂分子之间相互作用,形成溶液。
物质的分类及转化一、物质的分类1.物质的分类方法(分类标准或依据)依物质的属性,物质一般可以有如下分类方法:(1)根据存在状态分为:气态、液态和固态物质; (2)根据导电性分为:导体、半导体和绝缘体;(3)根据物质的溶解性分为:易溶、可溶、微溶和难溶; (4)根据物质的组成分为:混合物和纯净物。
【注】物质的分类标准不同,分类结果也不同。
2.物质的分类纯净物物质混合物【思考】“在水中能电离产生H +的物质都是酸,产生OH —的物质都是碱”,这种说法对吗?化合物 非金属单质有机化合物 酸碱酸 酸根中是否有氧元素无氧酸含氧酸 一个酸分子中最多 电离的H +数 一元酸 二元酸多元酸沸点高低易挥发性酸 难挥发性酸 酸在水中溶解性不同 可溶性酸难溶性酸碱碱在水中溶解性不同可溶性碱 难溶性碱碱在水中最多能电离出OH —数一元碱 二元碱 多元碱 非均匀混合物【辨析】酸性氧化物都是非金属氧化物,碱性氧化物都是金属氧化物。
【易错提醒】金属氢化物中H 显-1价【例1】下列物质属于纯净物的是( )A.洁净的空气B.食盐水C.浮有冰块的水D.纯净的盐酸E.含氮35%的硝酸铵化肥F.生石灰【例2】今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。
将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。
三组物质分别为:(1)O 2、F 2、S 、N 2;(2)Fe 、Na 、Al 、Si ;(3)NO 2、CO 2、CaO 、SO 2。
【例3】关于氧化物的下列说法中正确的是 ( )A.金属氧化物一定是碱性氧化物B.碱性氧化物一定是金属氧化物C.非金属氧化物一定是酸性氧化物D.酸性氧化物一定是非金属氧化物 【例4】经分析,某种物质只含有一种元素,则此物质( )A.一定是一种单质B.一定是纯净物C.一定是混合物D.可能是纯净物,也可能是混合物盐 酸根中是否有氧元素 无氧酸盐含氧酸盐 盐在水中溶解性不同 可溶性盐微溶性盐 难溶性盐 组成盐的阴、阳离子不同 正盐 酸式盐 碱式盐氧化物组成元素化学性质 金属氧化物 非金属氧化物 酸性氧化物碱性氧化物两性氧化物不成盐氧化物氢化物 金属氢化物非金属氢化物【变式】下列物质不可能由一种元素组成的是()A.单质B.氧化物C.化合物D.混合物【例5】有下列几种物质:⑴空气、⑵液态氧、⑶硝酸钾溶液、⑷硫酸铜晶体(CuSO4·5H2O)、⑸二氧化碳、⑹氧化铜、⑺锌、⑻金刚石、⑼氢氧化铜、⑽纯碱、⑾甲烷、⑿硝酸、⒀盐酸、⒁液态硫酸钾。
第一讲物质的分类及转化考点一、根据物质的组成和性质分类:1.同素异形体由同一种元素形成的几种性质不同的单质,叫作这种元素的同素异形体。
例如:金刚石、石墨和C60是碳元素的同素异形体;氧气和臭氧(O3)是氧元素的同素异形体。
2.物质分类的标准对物质进行分类,首先要确定分类的标准,然后按标准进行分类。
如对下列化合物进行分类:①NaCl;②HCl;③CaCl2;④CuO;⑤H2O;⑥Fe2O3。
(1)依据通常状况下物质的存在状态为标准,可分为固体:①③④⑥;液体:⑤;气体:②。
(2)依据物质的元素组成为标准,可分为氯化物:①②③;氧化物:④⑤⑥。
(3)依据物质的组成和性质为标准,可分为酸:②;盐:①③;氧化物:④⑤⑥。
3.树状分类法根据物质的组成对物质进行分类的一种方法。
4.交叉分类法从不同的角度对物质进行分类。
例如:5.概念辨析(1)单质一定是同一种元素组成的物质,由同一种元素组成的物质不一定是单质。
(2)化合物一定是不同种元素组成的纯净物,但纯净物不一定是化合物。
(3)纯净物是一种成分(分子)组成的物质,有化学式,有固定的熔、沸点。
(4)混合物是多种成分(分子)组成的物质,无化学式,无固定的熔、沸点。
2.氧化物的类别辨析(1)氧化物的分类①依据性质,氧化物可分为酸性氧化物和碱性氧化物。
②依据组成,氧化物可分为金属氧化物和非金属氧化物。
(2)酸性氧化物是与碱反应生成盐和水的氧化物,大多数非金属氧化物属于酸性氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7。
②非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物是与酸反应生成盐和水的氧化物,大多数金属氧化物属于碱性氧化物。
①碱性氧化物一定是金属氧化物。
②金属氧化物不一定是碱性氧化物,如Mn2O7。
典例:1.物质的分类如下图所示:由图判断下列说法中不正确的是()A.甲图所示的分类方法属于树状分类法B.乙图所示的分类方法属于交叉分类法C.碱性氧化物一定是金属氧化物D.非金属氧化物一定是酸性氧化物解析:选D。
第一节物质的分类及转化(一)物质的分类一、树状分类法:对同类事物进行再分类的方法1、根据物质的组成与性质对物质进行树状分类:2、根据物质的组成与性质对无机化合物进行树状分类按能参与电离的H+个数3、常见的物质概念(1)酸的定义:在水溶液中电离产生的阳离子全部是H+的化合物例如:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、氢碘酸(HI)、氢溴酸(HBr)、高氯酸(HCIO4)——六大强酸碳酸(H2CO3)、醋酸(CH3COOH)、磷酸(H3PO4)、氢硫酸(H2S)、氢氟酸(HF)、硅酸(H2SiO3)、次氯酸(HClO)、亚硫酸(H2SO3)、亚硝酸(HNO2)、草酸(H2C2O4)(2)碱的定义:在水溶液中电离产生的阴离子全部是OH-的化合物例如:氢氧化钠(NaOH)、氢氧化钾(KOH)、氢氧化钡(Ba(OH)2)、氢氧化钙(Ca(OH)2)——四大强碱氢氧化铁Fe(OH)3、氢氧化亚铁Fe(OH)2、氢氧化铜Cu(OH)2、氢氧化镁Mg(OH)2、氢氧化铝Al(OH)3、氨水NH3·H2O(3)盐的定义:在水溶液中电离产生金属阳离子(或NH4+)和酸根离子的化合物①正盐:在水溶液中电离只产生一种阳离子和一种阴离子的盐,例如:BaSO4、KNO3、NaCl、Na2SiO3、NaAlO2②酸式盐:在水溶液中电离还能产生H+的盐,例如:NaHCO3、KHSO3、NaHSO4③碱式盐:在水溶液中电离还能产生OH-的盐,例如:Cu2(OH)2CO3④复盐:在水溶液中电离产生两种或两种以上金属阳离子(或NH4+)的盐,例如:KAl(SO4)2 ·12H2O⑤络盐:含有络离子的盐,例如:Fe(SCN)3、K3Fe(CN)6、Ag(NH3)2OH(4)氧化物:只含两种元素,且其中一种是氧元素①不成盐氧化物:既不能与酸反应,也不能与碱反应生成相应价态的盐和水的氧化物,所谓相应价态即指化合价不变例如:CO、NO、NO2②碱性氧化物:与酸反应只生成盐和水的氧化物,例如:Na2O、CaO③酸性氧化物:与碱反应只生成盐和水的氧化物,例如:CO2、P2O5、Mn2O7④两性氧化物:与酸、碱都能反应,且都只生成盐和水的氧化物,例如:Al2O3注:碱性氧化物、酸性氧化物、两性氧化物都属于成盐氧化物⑤过氧化物:含有O22-的氧化物,例如:Na2O2、H2O2注:1、碱性氧化物:能跟酸反应且只生成盐和水的氧化物。