环烷烃的化学反应
- 格式:pptx
- 大小:402.70 KB
- 文档页数:7

烷烃烯烃环烷烃芳香烃的鉴别1.引言1.1 概述烷烃、烯烃、环烷烃和芳香烃是有机化合物中常见的四类化合物。
它们在化学性质、物理性质和化学反应等方面有着很大的差异,因此,对它们进行准确的鉴别至关重要。
烷烃是一类由碳和氢组成的直链或支链链状化合物。
它们具有饱和的碳-碳单键,因此相对稳定。
在室温下,大多数烷烃是无色、无味、无毒的液体或气体,不溶于水,但溶于有机溶剂。
烷烃的物理性质主要取决于它们的分子量和分子结构。
烯烃是一类含有一个或多个碳-碳双键的化合物。
由于双键的存在,烯烃具有一定的不饱和性,对于化学反应来说更加活泼。
烯烃的物理性质与烷烃类似,但由于不饱和性的存在,烯烃容易发生加成反应。
环烷烃是一类由碳组成的环状化合物。
环烷烃分子内的碳原子通过碳-碳单键相连接,这种结构使得环烷烃更加稳定。
环烷烃的物理性质通常与烷烃相似,但由于环结构的存在,环烷烃在一些化学反应中表现出特殊性质。
芳香烃是一类含有苯环结构的化合物。
苯环由六个碳原子构成,每个碳原子通过一个碳-碳单键和一个碳-氢单键相互连接。
芳香烃通常具有特殊的香气,因此得名。
芳香烃的物理性质与烷烃有所不同,化学反应也更具特异性。
本篇文章旨在介绍烷烃、烯烃、环烷烃和芳香烃的主要特征和鉴别方法,以帮助读者准确判断和区分这些有机化合物。
通过了解它们的物理性质和化学反应,我们可以更好地理解它们在实验室和工业中的应用,为相关领域的研究和应用提供指导。
1.2文章结构文章结构部分的内容可以描述文章的整体框架和各个部分的内容安排,以及每个部分的主题和目标。
文章结构部分的内容示例:1.2 文章结构本文共分为三个主要部分,具体结构如下:第一部分为引言部分,旨在介绍本文的背景和主题,并说明文章的目的和意义。
第一小节对烷烃、烯烃、环烷烃和芳香烃进行简要概述,以帮助读者对这些化合物有一个整体的了解。
第二小节是文章的主要部分,介绍了烷烃、烯烃、环烷烃和芳香烃的鉴别方法。
第三小节是结论部分,对文章的主要内容进行总结和归纳,并就烷烃、烯烃、环烷烃和芳香烃的鉴别提出一些结论和建议。


溴化氢的开环反应通常是在与环烷烃发生加成反应时生成的,这个过程可以生成稳定的溴代烷基正离子和溴负离子。
具体来说,溴化氢(HBr)与环烷烃首先发生加成反应,生成稳定的溴代烷基正离子和溴负离子。
这个加成反应是通过分子间的相互作用,将溴负离子与环烷烃的碳原子结合,生成新的有机化合物。
随后,由于溴化氢是强酸,它能够将下一步生成的溴负离子进行质子化,使得分子更容易解离。
这个过程称为解离,生成的分子更容易分解成单独的组分。
接下来,环烷基正离子经过质子转移和碳迁移反应,发生重排,生成更稳定的烷基正离子。
这个重排过程是化学反应中的一种重要机制,它使得分子内部的电子分布更加平衡,从而让分子更加稳定。
最终,烷基正离子与溴负离子结合,生成稳定的烷基溴化物。
这个过程完成了溴化氢的开环反应,生成了新的有机化合物——烷基溴化物。

环烷烃,作为烃类的一种特殊形态,具有其独特的结构和性质。
从结构角度来看,环烷烃可以视为一个或多个碳原子构成的闭合链,其中每个碳原子都与其它碳原子通过单键或双键连接。
这些碳环结构是环烷烃的主要特点之一。
在环烷烃中,最常见的碳环是五元环和六元环,因为这两个环的碳原子数是最稳定的。
此外,环烷烃的稳定性也与其取代基有关。
例如,当环上有一个或多个甲基时,其稳定性会增加。
同时,如果环上的氢原子被其他基团取代,其稳定性会降低。
除了碳环结构外,环烷烃还具有一些特殊的性质。
例如,由于其结构紧凑,环烷烃的沸点相对较低。
此外,由于其饱和性,环烷烃的化学性质相对稳定,不易发生氧化或聚合等反应。
环烷烃的合成方法通常是通过某些特定反应来完成的。
例如,通过烷基化反应可以将烷基引入到环中,或者通过某些特定反应来构建碳环结构。
这些合成方法的选择取决于所需的环烷烃的结构和性质。
总的来说,环烷烃是一种具有独特结构和性质的烃类。
其独特的碳环结构使得环烷烃在化学和物理性质上表现出与开链烃不同的特点。
同时,由于其稳定的化学性质和较低的沸点等特点,使得环烷烃在许多领域都有广泛的应用。
通过不断深入研究环烷烃的结构和性质,我们不仅可以更好地理解其物理和化学行为,也可以为合成具有特定性能的环烷烃提供更有效的方法。



有机化学反应方程式1. 烷烃的氧化反应2. 甲烷的氯代反应(游离基的链反应)3. 烷烃的卤代反应(卤代反应活性:叔氢>仲氢>伯氢F2 > Cl2 > Br2 > I2)4. 环烷烃的自由基取代反应5. 环烷烃的加成反应1)催化加氢(催化加氢易到难:环丙烷>环丁烷>环戊烷。
≥6环烷烃更难。
)2)加卤素CH2C CH2+Br2CH2—CH2—CH2H2Br Br3)加卤化氢环丙烷的烷基取代物与HX 开环加成, 环的开裂总是在含最多H 和最少H 的碳原子间进行, 氢加到含氢多的碳原子上。
6. 烯烃的亲电加成反应 1)加卤素卤素的活泼性次序:F 2>Cl 2>Br 2>>I 2 (不反应);烯烃与氟加成太剧烈,往往使反应物完全分解,与碘则难发生加成反应。
溴水褪色,可用于鉴别不饱和键:鉴别烷烃和烯、炔。
该加成反应一定是分步进行的 2)加卤化氢烯烃与卤化氢同样发生分步的、亲电性加成反应HX 对烯烃加成的相对活性:HI > HBr > HCl (与极化度有关)+Br 2BrBr+ HBrCH 3CH 2CH 2Br+ HICH 3CH 2CH 2CH 2IC +X 2C C C X X C +C C C XHHX实验证明主要产物是(Ⅰ)不对称烯烃与卤化氢等极性试剂加成时,氢原子总是加到含氢较多的双键碳原子上。
这就是马尔可夫尼可夫最初提出的规则,简称马氏规则。
3)加硫酸将产物水解,是工业制备醇的一个方法(间接法)4)加水通常烯烃不易与水直接反应,但在硫酸等强酸存在下,烯烃可与水加成生成醇。
7. 烯烃的催化加氢主要得顺式加成产物。
用途主要有将汽油中的烯烃转化为烷烃;不饱和油脂的加氢;用于烯烃的化学分析8.烯烃的自由基加成反应主要产物是反马氏规则的这种现象又称为过氧化物效应,只局限于烯烃与溴化氢的反应。
这时烯烃与溴化氢发生是自由基加成反应。

烷烃与环烷烃的结构与性质烷烃(Alkanes)是由碳(C)和氢(H)元素组成的最简单的有机化合物,由于不含双键或三键,因此其化学性质相对较为稳定。
而环烷烃(Cycloalkanes)则是烷烃中的一个特殊类别,其碳原子通过共享化学键形成环状结构。
本文将深入探讨烷烃和环烷烃的结构和性质。
一、烷烃的结构与性质烷烃的结构特点主要包括碳骨架的直线链状构型以及其化学键的特性。
烷烃中的碳原子都采用sp3杂化,形成四个σ键。
由于烷烃中只存在碳碳单键和碳氢键,因此分子间无极性键,电子云分布均匀,呈现出较小的极性。
这也是烷烃较为稳定且不易发生反应的原因。
烷烃的物理性质主要包括密度、沸点和熔点。
烷烃的密度较小,随着碳链长度的增加而增加。
由于烷烃之间的相互吸引作用较弱,分子间力为范德瓦尔斯力,因此密度较低。
沸点和熔点也随着碳链长度的增加而增加,但增幅逐渐减小。
烷烃的化学性质主要表现在其不活泼的化学反应中。
由于sp3杂化碳原子上的电子密度较小,碳原子与其他原子的相互作用较弱,因此烷烃不容易与其他物质发生反应。
但在适当条件下,烷烃可以通过氧化、还原、卤原子取代等反应来进行功能化。
此外,烷烃在氧气存在下会发生燃烧反应,生成二氧化碳和水。
二、环烷烃的结构与性质环烷烃是由碳原子通过共享化学键形成环状结构的一类化合物。
与烷烃相比,环烷烃具有更为复杂的分子结构和性质。
环烷烃的环状结构使得分子内部存在较大的张力,这种张力可以通过环的扭曲、马登环或突破环破坏而释放。
环烷烃的物理性质与烷烃相似,但由于分子内部的张力存在,环烷烃的沸点和熔点一般较烷烃高。
与烷烃相比,环烷烃的流动性较差,不易蒸发。
环烷烃的化学性质也相对复杂。
由于环状结构中的张力,环烷烃分子更容易发生裂环反应以释放内部的张力。
此外,环烷烃的稳定性也受到环的大小和分子的对称性等因素的影响。
较小的环烷烃由于较高的张力,更容易发生化学反应。
环烷烃中的环可以存在多个不同的构型,如环的位置、取代基的选择等,这些因素都会对环烷烃的性质产生影响。


一、环烷烃的命名环烷烃的命名与烷烃相似,只是在同数碳原子的链环烷烃的名称前加“环”字。
环丙烷环丁烷环己烷成环碳原子的编号,应使环上取代基的位次最小。
甲基环戊烷1-甲基-3-乙基己烷当环上有复杂取代基时,可将环作为取代基命名。
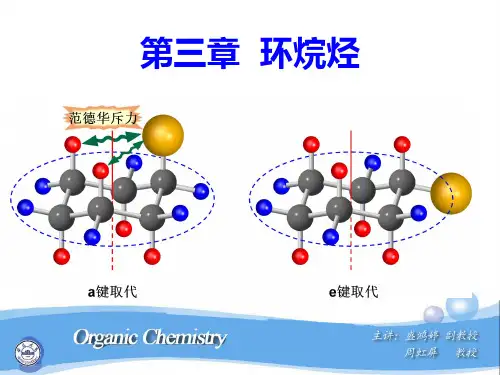
CH2CH2CH2CH3CH2CH2CH2CH21-环丁基丁烷1,4-二环戊基丁烷二、环烷的结构与稳定性环烷烃的稳定性与其环的几何形状和角张力有关,分子键角越接近正四面体角(109°28′),分子越稳定,反之,偏差越大角张力越大,环越不稳定。
………一、稳定性:烷烃具有高度的化学稳定性,常用作溶剂的药物基质。
烷烃在适宜的反应条件下,也能进行一些反应,主要有卤代反应。
二、卤代反应:有机化合物分子中的氢原子(或其他原子)或基团被另一原子或基团取代的化学反应称为取代反应。
烷烃分子中的氢原子被卤素原子取代的反应称为卤代反应。
1、甲烷的卤代反应条件:紫外光照射或加热至250~400℃产物:一氯甲烷、二氯甲烷、三氯甲烷(氯仿)和四氯甲烷(四氯化碳)的混合物一般较难限定取代在一元取代的产物(CH3Cl)的阶段CH4+Cl22、烷烃卤代反应的取向含有不同类型氢原子的烷烃,发生自由基氯取代反应,生成多种氯代烷异构体的混合物。
CH3CH2CH33CH2CH2Cl+CH3CHCH3Cl1-氯丙烷(43%)2-氯丙烷(57%)CH3CH3CH3CH3CHCH3+Cl23CHCH2-Cl + CH3CCH3Cl2-甲基-1-氯丙烷(37%)2-甲基-2氯丙烷(63%)由于氯的活泼性较大,选择性较差,在氯代反应中,各种产物间的相对比例相差不大;溴的活泼性较小,选择性较强,总是以一种产物占优势。
CH3CH2CH3CH3CH2CH2Br+CH3CHCH3Br1-溴丙烷(3%)2-氯丙烷(97%)CH3CH3CH3CH3CHCH3+Br3CHCH2-Br + CH3CCH3Br卤代反应活性:叔氢>仲氢>伯氢F 2>Cl 2>Br 2>I 2不同类型的C-H 键离解能不同,离解能越小,生成的自由基稳定性越大。
烷基基团通过环化反应形成环烷烃概述说明以及解释1. 引言1.1 概述本文将讨论烷基基团通过环化反应形成环烷烃的过程和机制。
烷基基团是有机化合物中常见的官能团之一,具有多种物理和化学性质。
在特定条件下,烷基基团可以经历环化反应,生成稳定的环状结构,从而形成环烷烃。
这一过程对于有机合成和药物化学领域具有重要意义。
1.2 文章结构文章分为五个部分进行阐述:引言、正文、环化反应形成环烷烃的机制及条件、烷基基团与环化反应的实际应用案例分析以及结论。
1.3 目的本文旨在通过探讨烷基基团通过环化反应形成环烷烃的机理和条件,并且分析其在实际应用中的案例,从而增进读者对该领域知识和实践的理解。
同时,希望通过本文的阐述和资料整理,为相关领域专业人士提供参考和借鉴。
2. 正文环化反应是一类有机化学反应,通过此反应可以将带有烷基基团的化合物转变为环烷烃。
在这个过程中,烷基基团的碳原子会重新排列连接形成一个环状结构。
本文将详细讨论环化反应的机制及条件以及与烷基基团相关的实际应用案例。
为了更好地理解环化反应的机制,首先需要了解其概述。
环化反应是通过在分子内部发生骨架重组来形成新的环结构。
在此过程中,通常伴随着其他官能团竞争性加入或消除。
具体而言,环化反应的机理解析涉及碳原子上的亲电或亲核试图攻击其他碳原子上的π电子或非键电子对。
这种攻击一般发生在多功能分子或不饱和键周围,并引发骨架重排和新键生成。
典型的环化反应包括羟基自由基缩合、氧杂五元环合成、单质离子加成等。
为实现有效的环化反应,并成功形成目标环烷烃产物,存在一系列必要条件。
首先,底物中需要存在可供攻击的亲核或亲电试剂,这可以通过在反应体系中引入特定的试剂来实现。
其次,适当的反应条件也是必不可少的。
例如,在羟基自由基缩合中,温度和酸碱条件都会对反应产率产生影响。
除了理论上的讨论外,烷基基团与环化反应也被广泛应用于有机化学的实际领域。
下面将分析几个具体的应用案例。
一个典型的应用案例是环烷烃合成。
小环环烷烃的加成反应1) 加氢随着环的增大,环的稳定性增加,开环的反应条件增强2)加溴与溴的加成反应,在室温下即可进行:溴与环丁烷的加成反应需在加热的条件下进行3 )加溴化氢开环的方向:环丙烷的衍生物开环反应发生在连接氢原子最多与连接氢原子最少的两个成环碳原子之间,卤原子加到取代基较多的一端。
三、单环芳烃的化学性质1) 卤化注意:(1)卤化通常用Cl2、Br2;(2)催化剂可用Fe粉或FeX3;2)硝化注意:若反应条件强烈,可得多元取代物硝化反应主要用途:(1)制备硝基芳烃。
(2)鉴别苯和芳烃(现象:溶于酸中,产物一般为黄色油状液体)。
3)磺化•苯与浓硫酸的反应速度很慢.•苯与发烟硫酸则在室温下即生成苯磺酸注意:(1)反应通常可逆,利用这一性质,可将-SO3H从苯环上去掉(2)若反应条件强烈,可得二元取代产物应用: (1)鉴别芳烃、苯(现象:溶于H2SO4,不分层)(2) 有机合成中“占位”,如:(3)分离提纯。
4) Friedel–Crafts反应(傅列德尔-克拉夫茨反应①傅-克烷基化反应在AlCl3等催化下,苯与卤代烷反应,生成烷基苯,---------傅-克烷基化反应:催化剂:无水AlCl3、BF3、FeCl3、ZnCl2、H2SO4烷基化试剂:RX、ROH、烯烃、环氧乙烷等注意:②傅-克酰基化反应在AlCl3等作用下,苯与酰卤反应,在苯环上引入酰基-------傅-克酰基化反应:催化剂:无水AlCl3、BF3、FeCl3、ZnCl2、H2SO4等;其中无水AlCl3用量较烷基化反应多。
酰基化试剂:酰卤、酸酐、酸等。
特点:(1)当苯环上连有吸电子基时,不易发生酰基化反应;(2)不容易得到多取代产物;(3)反应不重排。
6)亲电取代反应的机理。