无机化学配位化合物
- 格式:ppt
- 大小:3.18 MB
- 文档页数:93

无机化学中的配位化合物无机配位化合物是指由中心金属离子或原子与周围配体形成的稳定化合物,其中配体可以是有机分子、无机物以及某些复杂的大分子。
这些化合物在化学、材料和生物领域具有广泛的应用。
本文将对无机化学中的配位化合物进行详细介绍。
一、配位键的形成在配位化合物中,中心金属离子通过与配体的配位键结合在一起。
配位键可以是共价键,也可以是离子键。
在共价配位键中,金属离子与配体共享电子对,形成共有的化学键。
而离子配位键中,金属离子通过吸引配体上的电子形成离子键。
二、常见的配体在配位化合物中,各种不同的配体可以与中心金属离子形成配位键。
常见的配体包括一价的阴离子(如Cl-、Br-、I-)、二价的阴离子(如O2-、OH-)以及有机分子(如NH3、CO、CN-等)。
这些配体的不同基团和电性决定了它们与金属离子之间的相互作用方式和配位键的强度。
三、配位化合物的结构配位化合物的结构可以是简单的一对一结构,也可以是复杂的多中心配位结构。
在一对一结构中,一个中心金属离子配位于一个配体上。
而在多中心配位结构中,一个或多个中心金属离子与多个配体形成配合物。
四、配位化合物的性质配位化合物的性质受到配体和中心金属离子的影响。
配合物的颜色、溶解度、稳定性以及一些化学反应都与配体和金属离子的性质密切相关。
例如,某些过渡金属离子与氮、氧等电负性较高的配体形成的配合物具有较强的酸性;而某些具有大的络合度的配合物则具有较好的溶解性和稳定性。
五、应用无机配位化合物在化学、材料和生物领域具有广泛的应用。
在催化剂中,配合物的金属离子可以提供活性位点,从而促进化学反应的进行。
在生物医学中,金属配合物可以用作药物,通过与特定的生物分子相互作用来治疗疾病。
此外,配位化合物也广泛应用于材料科学领域,用于制备光电材料、磁性材料、液晶材料等。
六、进展与展望近年来,随着科学技术的不断发展,无机化学中的配位化合物在结构设计、属性调控以及应用领域方面取得了许多重要的进展。


无机化学中的配位化合物的合成在无机化学中,许多重要的化学反应中都存在配位化合物的合成。
配位化合物是指带有一个或多个配体的金属离子与一些不含金属离子的分子化合物相互结合形成的复合物。
配位化合物在生物、工业和材料科学中都有着重要的应用。
因此,了解一些基本的配位化合物合成方法是非常必要的。
一. 酸碱法合成酸碱法合成是最常用的合成方法之一。
在此方法中,金属离子首先与碱性配体反应,形成产物的“母液”。
然后,向其中加入酸性配体,使其与金属离子螯合形成所需的配位化合物。
例如,将某些金属离子和氢氧化物反应,可以得到一些碱式金属盐。
接下来,加入某些酸性配体,如某些羧酸盐或胺类,可以得到配位化合物。
例如,可以通过酸碱法合成一些重要的金属络合物,如FeCl3所形成的Fe(C6H5COO)3。
这种化合物是一种强氧化剂,在某些有机反应中得到了广泛的应用。
二. 光合成光合成是另外一个常用的方法,适用于各种水溶性离子或氢氧化物的配位化合物。
在此方法中,将金属离子和配体放入光敏溶液中照射,以光催化的方式促进反应发生。
这种方法需要使用专业的设备,因此,成本比较高,但可以得到高纯度的产物。
例如,对于RhCl3和6,6’-二(β-萘乙酰氨基)-2,2’-双吡啶盐,可以通过光合成得到一个配位化合物。
可以利用这种配位化合物的吸咐特性进行分离和提取某些特定的分子。
三. 热解法热解法也是一个配位化合物的合成方法。
在这种方法中,将金属离子与其它配体混合,加热使得溶剂蒸发,留下固体混合物。
然后,将这个混合物加入到高温的熔盐中进行热解,以形成所需的配位化合物。
例如,可以将铜与苯并芴并吡啶合并形成金属配合物Cu(bpy)(Pbenz), 其中bpy为2,2'-联吡啶,Pbenz为苯并芴并吡啶。
四. 溶剂热法溶剂热法是一种较新的方法。
在这种方法中,将金属离子和配体混入一个溶剂中,在高温高压下反应。
由于高温和高压的影响,反应的速率显著提高。
此外,溶剂热法多能够得到高度晶化的产物,这对于实验室合成和应用都是非常重要的。




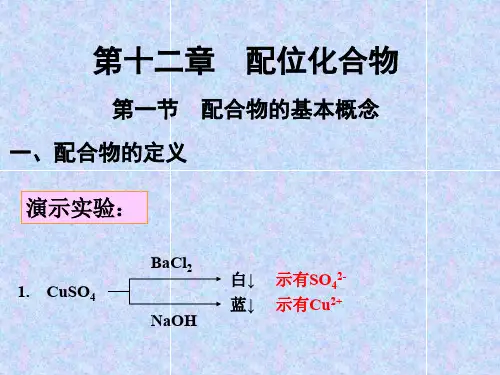
无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。


无机化学中的配位化合物反应无机化学是研究无机物质的组成、结构、性质和变化规律的学科,而配位化合物反应则是无机化学中的重要研究方向之一。
配位化合物反应涉及到配位键的形成和断裂,以及配位离子和配位体之间的相互作用。
本文将介绍配位化合物反应的一些基本概念、反应类型以及实际应用。
一、配位化合物反应的基本概念1. 配位键的形成与断裂在配位化合物中,金属离子与配位体之间的相互作用通过共价键或离子键来完成。
当配位体中的一个或多个配位原子与金属离子中的未配位的d电子形成或断裂共价键时,配位键的形成或断裂就会发生。
2. 配位离子与配位体的相互作用配位离子和配位体之间的相互作用主要包括配位键的形成和断裂过程中的电子转移、配体的配位置换、配位体的配位模式转化等。
二、配位化合物反应的类型1. 配位键形成与断裂反应金属离子可以与不同的配位体形成配位键,其中最常见的形成配位键的方式有配位置换反应和配体添加反应。
配位离子与配位体之间的配位键断裂可以通过配位离子的还原或氧化来实现。
2. 配位物的配位置换反应配位离子与更适合形成配位键的配位体发生置换反应,可以获得更稳定的配位化合物。
配位置换反应根据配位体的不同,可以分为配位离子置换反应和配位体置换反应两种情况。
3. 配位物的配位模式转化在一些配位化合物反应中,配位体可以改变其配位方式,从而形成不同的配位化合物。
这种配位模式的转化可以通过配位体的内部转位或配位体的外部替换来实现。
三、配位化合物反应的应用1. 催化反应一些配位化合物在催化反应中起到重要的作用,例如过渡金属配位化合物催化的氧化还原反应、羰基化反应等。
这些配位催化剂可以提高反应速率、改善反应选择性,并且可以在较温和的条件下进行。
2. 荧光材料配位化合物中的金属离子可以通过与特定的配位体形成配位键来产生特定的荧光性质。
这些荧光配位化合物在生物荧光探针、荧光传感器、发光材料等方面具有广泛的应用。
3. 金属有机化学配位化合物反应也在金属有机化学中发挥着重要的作用。

无机化学中的配位化合物无机化学是化学的一个重要分支,主要研究非有机化合物或元素的结构、性质及其间的相互作用。
而其中一个重要且常被人们忽略的分支,就是配位化学。
配位化学研究的是金属离子与一定数量的配体结合成的配位化合物,而这些化合物则在许多领域有着重要应用。
在本篇文章中,我们将进一步探讨无机化学中的配位化合物。
一、配位体的分子结构及分类在配位化学中,有机分子或无机离子集体被称为配位体。
它们的分子结构是由原子或原子团组成的。
根据杂化状态的不同,它们可以分为配位体I(线型)和配位体II(平面)。
此外,它们也可以由下列形式的单原子离子(如NO+、NH4+、SO4^-2等)、小分子(如CO、SO2、NH3、H2O等)或多原子离子(如[Fe(CN)6]^-4、[Co(NH3)6]3+、[CuCl4]^-2等)组成。
二、配位化合物的性质由于其特殊的结构,配位化合物表现出了一些独特的性质。
其中最重要的特征就是其对化学反应的影响。
例如,在生化学领域中,许多酶(大分子催化剂)都是由一定数量的金属离子(如Fe、Cu、Mg等)与配体结合而成,这些金属离子可以在催化反应中参与,并极大地影响反应动力学。
除了对生化学反应的影响外,配位化合物还有一些其他的性质。
例如,它们显示出的光学性质一直是该领域研究的一个热点。
有些金属离子和其所组成的配位体能发射出特定的荧光,因此在化学的分析和监测中得到了广泛应用。
此外,很多配位化合物也有着重要的电子学性质,如电导、磁性等等。
三、配位化合物在实际生活中的应用由于其独特性质,配位化合物已经广泛应用在现实生活中,例如:1.医学在医学领域中,针对疾病的药物中许多都是由一定数量的金属离子与配体结合而成。
这些化合物通常和受体相互作用,从而达到治疗目的。
同时,它们还有助于分析分子结构,并赋予了医学领域一些其他的创新。
2.钢铁产业铁氧体是一种常见的铁矿石,其结构由铁离子和氧离子相互作用形成晶体而成。
由于其结构相对稳定,这种矿石是制造钢铁的重要原料之一。