氮氧化物溶于水的计算
- 格式:doc
- 大小:73.00 KB
- 文档页数:9


关于氮的氧化物相关计算总结摘要:NO 2、NO 、O 2混合气体,通入水中充分反应后求剩余气体的体积,或根据反应前后气体的体积变化求原混合气体的组成,是高考中气体的计算的重点、难点、热点。
计算时应抓住反应规律,依据具体反应,利用关系式法、差量法、电子守恒法等方法进行求解。
关键词:氮的氧化物 NO 2 NO 关系式法 差量法 电子守恒法NO 2、NO 、O 2混合气体,通入水中充分反应后求剩余气体的体积,或根据反应前后气体的体积变化求原混合气体的组成,是高考中气体的计算的重点、难点、热点。
计算时应抓住反应规律,依据具体反应,利用关系式法、差量法、电子守恒法等方法进行求解。
1。
关系式法计算时经常用到的四个重要化学方程式:3NO 2+H 2O==2HNO 3+NO ① 2NO+O 2==2NO 2 ②将化学方程式①、②叠加得:4NO 2+O 2+2H 2O==4HNO 3 ③ 4NO+3O 2+2H 2O==4HNO 3 ④利用化学方程式③解答NO 2、O 2混合气体溶于水的计算有三种类型: (1)当V NO2∶V O2=4∶1,完全反应,无气体剩余;(2)当V NO2∶V O2<4∶1,O 2过量,剩余O 2; (3)当V NO2∶V O2>4∶1,NO 2过量,剩余NO.利用化学方程式④解答NO 、O 2混合气体溶于水的计算也有三种类型:(1) 当V NO ∶V O2<4∶3时,O 2过量,剩余O 2; (2) 当V NO ∶V O2=4∶3时,完全反应,无气体剩余; (3)当V NO ∶V O2>4∶3时,NO 过量,剩余NO.2。
差量法NO 2溶于水转变成硝酸时体积会减小,利用期反应前后体积的变化量可进行计算。
例1 将盛有N 2和NO 2混合气体25mL 的量筒倒立于水槽里,过一段时间后,气体体积缩小到15mL ,后不再变化(同温同压下),原混合气体中N 2和NO 2的体积比是 [ ] A .4∶1 B .2∶3 C .1∶4 D .2∶1解析 :混合气体中的N 2既不溶于水,也不与水反应,只有NO 2溶于水 3NO 2+H 2O==2HNO 3+NO △V 3 1 3—1=2 x 25—15=10答案为B 。

氮的氧化物溶于水的计算氮的氧化物指的是氮与氧元素形成的化合物,包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3)。
这些化合物在大气中存在,并且会溶解于水中,通过以下计算可以了解氮的氧化物在水中的溶解性和相关的化学反应。
首先,我们来讨论一氧化氮(NO)。
一氧化氮是一种无色气体,其溶解度随温度和帕斯卡定律成正相关。
根据Henry定律,气体在液体中的溶解度与气体分压成正比。
换句话说,溶解度可以通过气体的分压来确定。
NO在水中的溶解度可以通过以下公式计算:溶解度(mol/L) = K * P其中,K是Henry定律的Henry常数,P是NO的分压。
当NO的分压为1 atm时,其在25°C下的溶解度约为0.0013 mol/L。
随着温度的升高,溶解度会增加,因为温度升高会使气体分压增加。
接下来,我们转向二氧化氮(NO2)。
二氧化氮是一种红棕色气体,其在水中会发生一系列复杂的反应。
首先,二氧化氮会与水反应生成硝酸(HNO3)和亚硝酸(HNO2):2NO2+H2O->HNO3+HNO2其中,硝酸是一种强酸,亚硝酸是一种较弱的酸。
此外,二氧化氮还可以通过以下反应转化为一氧化氮:2NO2<->2NO+O2最后,我们来讨论三氧化二氮(N2O3)。
N2O3+H2O->2HNO2与二氧化氮类似,硝酸是一种强酸,亚硝酸是一种较弱的酸。
总结起来,氮的氧化物在水中会发生一系列的化学反应,包括一氧化氮的溶解、二氧化氮和三氧化二氮的与水反应。
这些反应导致水溶液中存在硝酸和亚硝酸,这些化合物在环境中有重要的生物地球化学循环作用。
然而,需要注意的是以上只是理论计算,实际情况可能受到多种因素的影响,包括温度、压力、其他溶质的存在等。
因此,在实际实验中需要综合考虑这些因素来确定氮的氧化物在水中的溶解度和化学反应行为。

一、NO 2和O 2的混合气体通入水中的计算由3NO 2+H 2O===2HNO 3+NO 和2NO +O 2===2NO 2可得总反应式4NO 2+O 2+2H 2O===4HNO 3,由此可知:V (NO 2)∶V (O 2)⎩⎪⎨⎪⎧=4∶1,恰好完全反应,无气体剩余<4∶1,O 2过量,剩余气体为O 2>4∶1,NO 2过量,剩余气体为NO1.在标准状况下,将O 2和NO 2按1∶4的体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( ) A.114mol·L -1 B.45mol·L -1 C.128 mol·L -1 D.142mol·L -1 [答案] C[解析] 设烧瓶的体积为V L ,由4NO 2+O 2+2H 2O===4HNO 3以及O 2和NO 2的体积比为1∶4,知NO 2的体积为45V L ,所以最终液体充满整个烧瓶,溶液的体积为V L ,NO 2的物质的量为45V L 22.4 L·mol -1=128V mol ,所以硝酸的物质的量浓度为128V mol V L =128 mol·L -1。
2.一定条件下,将充满二氧化氮和氧气的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的18,则原混合气体中二氧化氮和氧气的体积之比可能是( )A.8∶1B.7∶3C.7∶2D.4∶1 [答案] B[解析] 反应为4NO 2+O 2+2H 2O===4HNO 3,设原气体体积为8 L ,则剩余气体为1 L ;若剩余1 L 气体为氧气,V (NO 2)=⎝⎛⎭⎫45×7L ,V (O 2)=⎝⎛⎭⎫15×7+1L ,二者体积比为7∶3。
若剩余1 L 气体为一氧化氮,上述反应后应剩余3 L 二氧化氮,可得V (NO 2)=⎝⎛⎭⎫3+45×5L ,V (O 2)=⎝⎛⎭⎫15×5L ,二者体积比为7∶1。
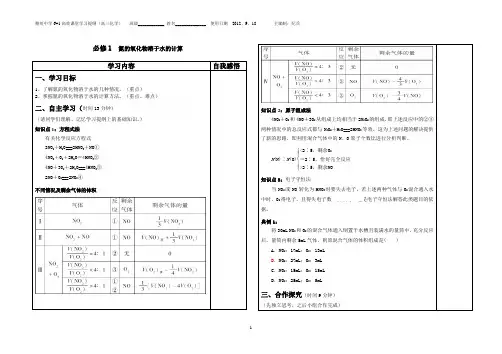


氮氧化物与O2混合后溶于水的计算规律与方法一、计算原理:1、反应原理3 NO2+H2O→ 2HNO3+NO①4 NO2+O2+ 2 H2O→ 4HNO3②4 NO+ 3O2+ 2 H2O→ 4HNO3③2、计算原理①气体减少的体积为液面上升的体积,也即HNO3溶液的体积。
②气体减少的体积可以用差量法计算(根据相应的反应方程式)。
③注意过量问题的分析。
二、计算类型:(1)NO2或(NO、NO2混合气体)跟水反应:只有一种情况,二氧化氮完全与水反应,按反应①进行计算。
(2)NO2、O2同时跟水反应:V(NO2):V(O2)=4:1 时,完全反应,按反应②进行计算;V(NO2):V(O2)﹤ 4:1 时,O2过量,剩余气体为O2,按反应②进行计算;V(NO2):V(O2)﹥ 4:1 时,NO2过量,剩余气体为NO,分别利用反应②、①进行两次计算。
(3)NO、O2同时跟水反应:V(NO):V(O2)= 4:3 时,完全反应,按反应③进行计算;V(NO):V(O2)﹤ 4:3 时,O2过量,剩余气体为O2,按反应③进行计算;V(NO):V(O2)﹥ 4:3 时,NO过量,剩余气体为NO,NO不能与水反应,按反应③进行计算。
(4)NO、NO2、O2同时跟水反应:先按反应①进行计算,将按①计算后得到的一氧化氮量与原气体中含有的一氧化氮量相加,转化为第三种类型的题,按反应③进行计算。
Tips:①在进行计算时,灵活应用极值法、假设法、或得失电子守恒法进行求解。
②注意有关循环氧化、由多步反应合并所得总反应。
注意各种类型的气体混合与之相对应的反应方程式。
三、典型例题与练习:1.在标准状况下,将 NO 2 、NO 、O 2 混合后充满容器,倒置在水中,完全溶解,无气体剩余,若产物不扩散,则所得溶液物质的量浓度的数值范围是() A .0<c <1 B . 1 <c < 1 C . 1 <c < 1 D . 1 <c < 1 22.4 39.2 22.4 39.2 28 28 22.42.将盛有 N 2 和 NO 2 混合气体的试管倒立与水中,经足够时间后,试管内气体的体积缩小为原体积的 3/5,则原混合气体中 N 2 和 NO 2 的体积比是( )A .1:1B .2:3C .1:3D .3:13.将标准状况下 NO 2 和O 2 按体积比 4:1 混合后充入一干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为()1 -1 4 1 -1 4 1 -1 4 -1A . mol ⋅ LB . ⨯ mol ⋅ LC . ⨯ mol ⋅ LD . 5 mol ⋅ L 22.4 7 22.4 5 22.4 4.将一充满 NO 的试管倒扣于水槽中,然后向试管中通入一定量的O 2 ,试管中恰好充满水时,通入的O 2与原 NO 的体积比和所得溶液的物质的量浓度分别为(假设生成的溶质不向外扩散,且为标准状况)( )A .3:4;1/22.4B .4:3;1/22.4C .1:4;1/11.2D .4:1;1/11.25.把 40mL NO 和 NO 2 的混合气体与 20mL O 2 同时通入倒立在水槽里盛满水的量筒中,充分反应后,量筒里还剩下 5mL 气体。


no2和水反应方程式NO2是一种常见的氮氧化物,也是一种有害气体,其与水反应可以产生一系列的产物。
本文将从人类视角出发,以自然流畅的方式描述NO2与水的反应方程式及其过程。
NO2与水反应的化学方程式如下:2NO2 + H2O → HNO3 + HNO2NO2与水反应的过程可以分为几个步骤来描述。
首先,NO2和水分子相互接近,形成氧化亚氮酸(HNO2)和硝酸(HNO3)的中间体。
在这个过程中,水分子的一个氢原子被氧化亚氮酸的一个氧原子取代,形成一个氧原子与氢原子结合的氢氧根离子(OH-)。
接着,氧化亚氮酸进一步分解,生成一氧化氮(NO)和水。
整个反应过程可以总结如下:NO2与水反应生成硝酸(HNO3)、氧化亚氮酸(HNO2)、氢氧根离子(OH-)以及一氧化氮(NO)。
NO2与水反应是一个重要的化学过程,对环境和人类健康都有重要影响。
NO2是一种有害的大气污染物,主要来源于汽车尾气和工业排放。
它会导致空气污染,对人类健康产生负面影响,如呼吸道炎症、哮喘和心血管疾病等。
因此,了解和研究NO2与水的反应对于减少大气污染,改善空气质量至关重要。
该反应方程式也有一定的应用价值。
在工业生产中,硝酸和氧化亚氮酸是重要的化学原料,可以用于制造肥料、爆炸物和药物等。
此外,一氧化氮也是一种重要的信号分子,在神经系统和心血管系统中发挥重要作用。
在写作中,我们应该尽量避免使用网络地址和数学公式,以确保文章的独一性和可读性。
同时,文章的结构也需要合理安排,使用适当的标题来增强阅读流畅性。
此外,我们还要避免过多的自我介绍,确保文章的准确无误,并使用丰富多样的词汇来表达。
通过以人类视角进行写作,我们可以使文章更加生动和有趣。
我们可以描述NO2与水反应的具体过程,并讨论其对环境和人类健康的影响。
同时,我们还可以探讨该反应的应用价值,并引发读者对相关问题的思考。
NO2与水的反应是一个重要的化学过程,对环境和人类健康具有重要影响。
通过以人类视角进行描述,我们可以使文章更加生动和有趣,并引发读者对相关问题的思考。


氮的循环一、氮在自然界中循环1、氮的固定使空气中游离态的氮转化为含氮化合物的过程叫氮的固定,简称固氮。
正是通过氮的固定,开始了氮在自然界中的循环,氮的固定有自然固氮和人工固氮两种方式。
2、自然固氮(1)生物固氮:大豆、蚕豆等豆科植物的根部含有根瘤菌,能把空气中的N2转变为硝酸盐,被植物吸收。
故豆类植物不需要施用氮肥,这种固氮方式占整个自然固氮的90%。
(2)高能固氮:通过闪电等高能量途径把N2固定的方式为高能固氮。
涉及到的反应主要有:N2+O22NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO可知,N2最终变成HNO3,即正常的雨水略呈酸性。
HNO3与土壤中的矿物作用,得到硝酸盐,被植物吸收,这就是“雷雨发庄稼”的科学道理。
3、人工固氮人们在工业生产中把N2转化为氮的化合物的方法为人工固氮,又叫工业固氮。
常见的方法有:(1)N2与H2合成NH3:,该反应为工业制HNO3的基础反应。
(2)仿生固氮:用某些金属有机化合物做催化剂,实现常温、常压固氮,这些金属有机物类似于根瘤菌,故又叫仿生固氮,这是目前科学界较为关注的研究性课题。
4、氮在自然界中的循环人们在生产活动中也涉及到了氮的循环,其中主要是利用N2与H2合成工业中重要的生产原料——NH3,即人工固氮。
涉及到两种很重要的物质:NH3、HNO3。
二、氮循环中的重要物质及其变化1、氮气,常况下是一种无色无味的气体,难溶于水,通常无毒。
氮气占空气体积总量的78.12%,是空气的主要成份。
氮气的化学性质很不活泼,只在特殊条件下,才能以下反应。
①与氧气反应:通常状况下氮气和氧气不反应,但在放电条件下,却可以直接化合生成NO。
反应的化学方程式为:★N2+O2闪电2NO②与氢气反应:在高温、高压、催化剂作用下,氮气和氢气可以反应制得氨气。
反应的化学方程式为:★N2 + 3H22NH3 此反应是工业合成氨的反应③与金属镁反应:金属镁可以在氮气中燃烧,生成氮化镁。
氮的氧化物溶于水的计算方法对有关氮的氧化物溶于水的计算,同学们在学习中往往感到困难。
其原因是这一溶解过程是通过循环往复的变化才达到平衡的。
但仔细分析可知:这些过程所涉及的化学反应不外乎就是下面两个:3NO2+H2O=2HNO3+NO…..①2NO+O2=2NO2………………②所以,解答这类习题的关键就在对这两个方程的处理上。
解答时可以采用消中间量法,将其中与前后反应相关的中间量消去,得到一总的反应式即可简便地解题。
为此,本文就谈谈利用总反应式解答这类习题的方法。
一、总反应式的推导按照混和气体的种类可以分两大类。
一类是互不反应的两种气体混和溶于水,如N2和NO2、NO和NO2等,由于它们之间并不发生反应,因此,解这类习题时是比较简单的,不需对方程式进行合并,故本文不打算再赘述。
另一类是相互要发生反应,如NO 和O2;NO2和O2;NO、NO2和O2的混和气等,其情况就比较复杂,下面着重讨论如下:1.NO和O2混和溶于水此时可将前述①式×2,②式×3,将NO2从反应体系中消掉,即得总反应式:3NO2+H2O=2HNO3+NO ×2+) 2NO+O2=2NO2 ×3——————————————4NO+3O2+2H2O=4HNO3……③2.NO2和O2混和溶于水此时,NO2与水反应生成的NO是反应的中间产物,照第1种办法处理,将①式x2与②式合并即得总反应式:4NO2+O2+2H2O=4HNO3……④3.NO、NO2和O2混和溶于水这时的情况就更复杂,一般可将①、②两式相加即得总反应式:NO+NO2+O2+H2O=2HNO3…⑤运用上述五个反应式,即可方便地进行有关氮的氧化物的计算习题的解答。
二、总反应式的应用1.判断反应体系中气体间量的关系(1)由③式可知:①当VNO∶VO2=4∶3 时,两种气体恰好完全反应,此时体系中没有气体剩余。
②当VNO∶VO2<4∶3 时,O2过量,剩余为气体O2。
氮的氧化物(NO x)和O2、H2O混合反应的计算方法1.关系式法(1)NO和O2的混合气体通入水中由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。
(2)NO2和O2的混合气体通入水中由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。
(3)NO、NO2和O2三种混合气体通入水中先按3NO2+H2O===2HNO3+NO计算出生成NO的体积,再加上原来混合气体中NO体积,再按(1)计算。
2.电子守恒法NO x转化为硝酸时失去电子,如果是NO x与O2的混合气体,则反应中O2得到的电子数与NO x 失去的电子数相等。
4NO2+O2和4NO+3O2从组成上均相当于2N2O5,都与N2O5+H2O===2HNO3等效;当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
1.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12 mL 无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)() A.2∶3 B.3∶2 C.1∶4 D.4∶1答案A解析二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以,剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:3NO 2+H 2O===2HNO 3+NO 气体体积减少3 1 2V 20 mL -12 mL =8 mL所以V =3×8 mL 2=12 mL ,即二氧化氮的体积为12 mL ,则原混合气体中一氧化氮的体积为20 mL -12 mL =8 mL ,则原混合气体中NO 和NO 2体积比为8 mL ∶12 mL =2∶3。
2.将盛有12 mL NO 2和O 2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL 无色气体,则原混合气体中O 2的体积和剩余的2 mL 气体分别是( )A .1.2 mL ,NOB .2.4 mL ,O 2C .3.5 mL ,O 2D .4 mL ,NO 答案 A解析 解题依据的化学方程式:4NO 2+O 2+2H 2O===4HNO 3;3NO 2+H 2O===2HNO 3+NO 。
氮氧化物溶于水的计算氮氧化物溶于水的计算常涉及到以下几个方面:(1)混合气体的组成,(2)反应后剩余气体的种类和量,(3)反应后溶液的浓度。
计算的依据是化学反应方程式,根据化学方程式分析各反应物的量、判断剩余气体的种类。
应用守恒法进行计算。
1.有关的化学方程式(1)单一气体:3NO2+H2O===2HNO3+NO①(2)混合气体:①NO2与O2混合:4NO2+O2+2H2O===4HNO3②②NO与O2混合:4NO+3O2+2H2O===4HNO3③(3)2NO+O2===2NO2④2.不同情况的反应及剩余气体的体积V NO2=4∶1V O2V NO2<4∶1V O2V NO2>4∶1V O2V NO=4∶3V O2V NO>4∶3V O2V NO<4∶3V O2[特别提醒] 因NO2与水发生反应,因此无论是NO2、NO2和O2的混合气体还是NO和O2的混合气体通入水中,最终剩余气体都不能是NO2。
[例] 用排水法收集12 mL NO于试管中,然后向倒立于水槽中的该试管内间歇地通入O2共12 mL,下面的说法中,正确的是( )A .剩余NOB .剩余NO 2C .试管中气体为红棕色D .试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体 [解析] 向NO 中间歇通入O 2发生的反应为 2NO +O 2===2NO 2 ① 3NO 2+H 2O===2HNO 3+NO ②由①×3+②×2得:4NO +3O 2+2H 2O===4HNO 3 等体积的NO 和O 2反应最终剩余O 2。
[答案] D NO ――→O 2 NO 2――→H 2ONO (无色)(红棕色)(无色)1.在NO 2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的质量比为( ) A .3∶1 B .1∶3 C .1∶2D .2∶3解析:3N +4O 2+H 2O===2H N +5O 3+N +2O,3 mol NO 2中,有2 mol 氮的价态升高,1 mol 氮的价态降低,所以发生还原反应的NO 2与发生氧化反应的NO 2的质量比为1∶2。
答案:C2.标准状况下,将NO 2和O 2按体积比4∶3混合后充入干燥烧瓶中,然后将烧瓶倒立于水中使其充分反应,则烧瓶内溶液中溶质的物质的量浓度为( )A.122.4 mol·L -1B.139.2 mol·L -1C.128mol·L -1 D.45mol·L -1解析:此类题目可用赋值法来解。
设烧瓶体积为1 L ,因V (NO 2)∶V (O 2)=4∶3,故在1 L 混合气体中V (NO 2)=47 L ,V (O 2)=37 L 。
设生成HNO 3的物质的量为x ,根据反应4NO 2+O 2+2H 2O===4HNO 3,则有(4×22.4 L)∶47 L =4 mol∶x ,解得x =139.2 mol 。
烧瓶中残留O 2的体积:37 L -17 L =27 L ,故溶液充满烧瓶体积的57。
所以c (HNO 3)=(47×122.4) mol÷57 L =128mol·L -1。
答案:C3.[双选题]在一大试管中装入10 mL NO 倒立于水槽中,然后向其中缓慢通入6 mL O 2(气体体积均在相同条件下测定),下面有关实验最终状态的描述,正确的是( )A .试管内气体呈红棕色B .试管内气体呈无色,是2 mL NOC .试管内气体呈无色,是2 mL O 2D .试管内液面上升解析:根据4NO +3O 2+2H 2O===4HNO 3可知,V (NO)∶V (O 2)>4∶3时,NO 有剩余。
由题意,V (NO)∶V (O 2)=5∶3可知,NO 剩余2 mL ,则试管内液面上升。
答案:BD4.盛有NO 和NO 2混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。
则原混合气体中NO 和NO 2的体积比是( )A .3∶1B .1∶3C .2∶1D .1∶2解析:设V NO ===x L V NO 2===y L 3NO 2+H 2O===2HNO 3+NO ΔV 3 L 1 L 2 Ly L y 3L 23y L则:由反应后气体体积减小为原来的一半可得: 23y =12(x +y ),解得x y =13。
答案:B5.用大试管收集一试管NO 2气体,倒扣在盛水的水槽里,试管内产生的现象为____________________;再往试管里通入适量氧气,试管内又产生的现象为________________________。
产生上述现象的原因是______________________________________________________________________________________________________ ________________________________________________________________________。
解析:NO 2与水发生反应3NO 2+H 2O===2HNO 3+NO ,所以水会上升到试管容积的23处;反应生成的NO 又与O 2反应生成红棕色的NO 2气体,而NO 2又与水反应,水面又上升。
答案:试管内红棕色气体逐渐消失,水面上升至试管容积的23处 试管内又出现红棕色,接着红棕色消失,液面又上升 由于NO 2易溶于水,发生反应3NO 2+H 2O===2HNO 3+NO ,故颜色消失,液面上升至容积的23处。
当再充入O 2时,发生反应2NO +O 2===2NO 2,故又出现了红棕色,NO 2继续溶于水并与水反应,气体颜色又消失,液面又上升(1)空气中主要含有N 2和O 2,其体积比大约是4∶1。
(2)可通过自然固氮和人工固氮将自然界游离态氮转化为化合态。
(3)氮元素有多种氧化物,并且都有毒。
其中NO 和NO 2是两种重要的氧化物。
NO 易与O 2反应,化学方程式为2NO +O 2=2NO 2,NO 2与H 2O 反应,化学方程式为3NO 2+H 2O===2HNO 3+NO 。
(4)“雷雨发庄稼”原理:N 2――→O 2闪电NO ――→O 2NO 2――→H 2OHNO 3――→土壤硝酸盐 一、选择题(本题包括5小题,每题4分,共20分) 1.下列关于氮气的说法中,错误的是( ) A .通常情况下,氮气性质比较稳定 B .可在氧气中燃烧,生成一氧化氮 C .通常情况下,氮气在水中的溶解度很小 D .跟氢气在一定条件下发生反应时,氮气是氧化剂 解析:N 2不能在O 2中燃烧,与O 2在闪电时反应生成NO 。
答案:B2.我国城市中的大气污染物主要是( ) A .CO 2、Cl 2、N 2、酸雨 B .SO 2、NO 2、CO 、烟尘 C .NH 3、CO 2、CO 、雾 D .HCl 、SO 2、N 2、粉尘答案:B3.把少量NO 2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )A .氧气B .二氧化氮C .二氧化氮和氧气D .二氧化氮和一氧化氮 解析:少量NO 2气体通入过量小苏打溶液中,逸出的气体为NO 、CO 2,二者物质的量比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO 2与过氧化钠反应生成的O 2与NO 反应生成NO 2,O 2有剩余,同时逸出的少量水蒸气与过氧化钠反应生成O 2,所以最后收集到的气体是NO 2和O 2。
答案:C4.[双选题]在氮的氧化物中,氮元素和氧元素的质量比为7∶16,则此氧化物的化学式可能为( )A .NO 2B .NOC .N 2O 3D .N 2O 4解析:氧化物中两原子个数之比为:N (N)∶N (O)=714∶1616=1∶2。
答案:AD5.无色的混合气体甲,可能含NO 、CO 2、NO 2、N 2中的几种,将一定量的甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )A .NO 2、N 2B .NO 、CO 2C .NO 2、CO 2D .NO 、CO 2、N 2解析:混合气体无色,气体中不含NO 2,气体通过Na 2O 2后显红棕色,说明原混合气体中含有NO ,且有与Na 2O 2反应生成O 2的气体CO 2,通入水中,溶液呈酸性,且几乎无气体剩余,说明原气体中不含N 2。
答案:B二、非选择题(本题包括3个小题,共30分)6.(8分)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下: 2NO 2+2NO +4NaOH===4NaNO 2+2H 2O ①,2NO 2+2NaOH===NaNO 2+NaNO 3+H 2O ②,在反应①中,氧化剂是________,还原剂是________。
在反应②中,氧化剂和还原剂的物质的量之比为________。
(2)汽车尾气中含有CO 和NO ,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为______________________________________________________________________________________________。
解析:(1)在反应①中NO 2中的氮元素化合价降低做氧化剂,NO 中氮元素化合价升高做还原剂;在反应②中氧化剂和还原剂都是NO 2,它们的物质的量之比为1∶1。
(2)根据质量守恒定律结合题目信息可知,一氧化氮与一氧化碳反应后生成的对大气无污染的物质应为氮气和二氧化碳。
答案:(1)NO 2 NO 1∶1 (2)2NO +2CO=====催化剂N 2+2CO 27.(9分)二氧化氮是造成光化学烟雾的罪魁祸首。
目前有一种治理方法是,在400℃左右、有催化剂存在的情况下,用氨把二氧化氮还原为氮气和水。
请写出该反应的化学方程式:________________________________,该反应中,氧化剂是________,氧化产物是________,生成1.4 mol 还原产物时,转移电子的物质的量为________。
解析:根据氧化还原反应的规律分析,用NH 3将NO 2还原成无毒气体,该气体只能是N 2。
NO 2中+4价的N 被NH 3中-3价的N 还原为0价,剩下的氢、氧元素结合成水,因而氧化剂是NO 2,氧化产物、还原产物均为N 2;生成7 mol N 2时,其中3 mol 为还原产物,转移电子24 mol ,则生成1.4 mol 还原产物时,转移电子11.2 mol 。