金属及其化合物知识点框架图
- 格式:doc
- 大小:235.00 KB
- 文档页数:6
第三章金属及其化合物一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
四、金属及其化合物之间的相互转化1、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
⑩NaAlO 2+HCl+H 2O=Al(OH)3↓+NaCl要求:1、掌握铝三角关系,能书写相关化学方程式 2、能识别和绘制铝三角相关的图象并能求解。
3、掌握相关铝及其化合物的计算。
2、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
要求:1、掌握铁三角关系,能书写相关化学 方程式2、掌握相关铁及其化合物的计算。
3、钠及其化合物之间的相互转化,写出相应的化学反应方程式。
附:1、焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
2、碳酸钠、碳酸氢钠:Na 2CO 3又叫纯碱,俗称苏打。
无水碳酸钠是白色粉末。
NaHCO 3俗称小苏打,也叫酸式碳酸钠。
它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。
NaHCO 3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
将碳酸钠溶液或结晶碳酸钠吸收CO 2可制得碳酸氢钠。
3、氧化铝、氢氧化铝 (1)Al 2O 3俗名矾土,是一种难熔又不溶于水的白色粉末。
它的熔点、沸点都高于2000度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。
氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10、合金:钠 钾 黄色 紫色第四章非金属及其化合物一、本章知识结构框架硅及其化合物1、二氧化硅和二氧化碳比较二氧化硅二氧化碳类别酸性氧化物_酸性氧化物晶体结构原子晶体分子晶体熔沸点高低与水反应方程式不反应CO2+H2O H2CO3与酸反应方程式SiO2 + 4HF==SiF4↑+2H2O 不反应与烧碱反应方程式SiO2+2NaOH == Na2SiO3+H2O 少:2NaOH+CO2==Na2CO3+H2O 过:NaOH+CO2==NaHCO3与CaO反应方程式SiO2+CaO 高温CaSiO3CaO+CO2==CaCO3存在状态水晶、玛瑙、石英、硅石、沙子人和动物排放2、硅以及硅的化合物的用途物质用途硅单质半导体材料、光电池(计算器、人造卫星、登月车、探测器)SiO2饰物、仪器、光导纤维、玻璃硅酸钠矿物胶、具有粘性,能做木材的防火剂。

金属及其化合物知识清单一、碱金属1、碱金属性质递变规律结构决定性质,由于碱金属的原子结构具有相似性和递变性,所以其化学性质也具有相似性和递变性。
①相似性:a、都能与氧气等非金属反应b、都能与水反应生成氢氧化物和氢气c、均为强还原剂。
②递变规律(锂→铯)a、与氧气反应越来越剧烈,产物结构越来越复杂b、与水反应剧烈程度依次增强c、还原性依次增强,金属性依次增强2、NaOH的性质①物理性质:俗名苛性钠、火碱、烧碱,是一种白色固体,极易潮解;有强烈的腐蚀性,能腐蚀磨口玻璃瓶,使瓶口与瓶塞粘结。
②化学性质a、与酸碱指示剂作用,使紫色的石蕊溶液变蓝,无色的酚酞变红。
b、与酸性氧化物作用,生成盐和水c、与酸作用,生成盐和水d、与盐作用,生成新碱和新盐。
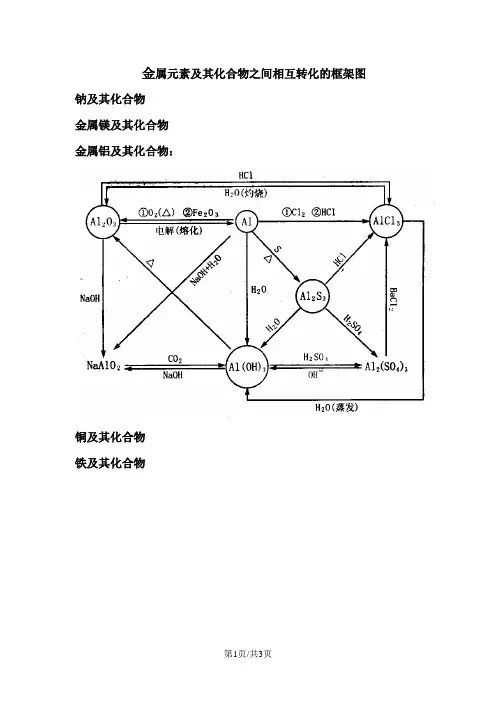
(要满足复分解反应发生的条件,同时参加反应的碱和盐一般是易溶解的碱和盐)e、与一些单质的反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑Cl2+2NaOH=== NaClO+NaCl+H2OSi+2NaOH+H2O=== Na2SiO3+2H2↑③制法:2NaCl+2H2+H2↑+Cl2↑Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH二、几种重要的金属1、铝及其化合物间的相互转化关系、反应现象及图象分析①向AlCl3溶液中滴加NaOH 溶液直至过量,如图所示。
②现象:白色沉淀逐渐增多达最大值,继续加NaOH溶Al(OH)3 (mol)液沉淀逐渐溶解,直至完全消失。
4nAl3++3OH-=== Al(OH)3Al(OH)3+OH―=== AlO2―+2H2O3n4n NaOH(mol)②向NaOH 溶液中滴加AlCl 3溶液直至过量,如下图所 示。
现象:开始时无沉淀,接着产生沉淀。
达最大值后 不增减。
Al 3++4OH -=== AlO 2―+2H 2O3AlO 2―+Al 3++6H 2O === 4 Al(OH)3↓ ③向NaAlO 2溶液中滴加盐酸直到过量,如图所示。

思维导图是一种有效的组织思维和记忆的方式,它可以帮助我们整理铁及其化合物的
相关知识体系。
首先,铁是一种常见的元素,在原子序号为26的元素中排第四位,其原子量为
55.85,是地壳中最丰富的金属元素,在大气层、水层中都有分布,其具有高度磁性。
其次,铁的化合物具有广泛的应用,其中最常见的是氧化铁,它是一种铁的氧化物,
有三种形态:α-Fe2O3、γ-Fe2O3和δ-Fe2O3,其中α-Fe2O3常用于制造颜料,γ-Fe2O3
制作磁性材料,δ-Fe2O3制作电磁铁及磁铁等;此外,还有其他常见的铁化合物如氢氧化铁、硫酸铁等,这些都是具有重要用途的化合物,在工业生产中有着广泛的应用。
最后,铁及其化合物的分析和检测也是重要的内容,常见的分析方法有物理性质分析,包括熔点、沸点、溶解度、电导率等;化学性质分析,包括氧化性、水解性、碱解性、离
子交换性等;以及分光光度法、X射线衍射法、电化学分析法和核磁共振法等其他分析技术。
总之,铁及其化合物的相关知识体系是相当丰富的,通过使用思维导图的方式,我们
可以更加有效地整理这些知识之间的关系,更好地记忆和理解这些知识点。

金属及其化合物之间的相互转化(尽量写出下列转化的化学方程式或离子方程式) (1)钠及其化合物(2)镁、铝及其化合物(3)铁、铜、银及其化合物Na Na 2S NaOH Na 2CO 3 NaHCO 3 CO 2 H 2O ①△②OH -CO 2 Ca(OH)2 H 2O SNa 2O 2 H 2O O 2点燃 CO 2C 2H 5ONa NaCl C 2H 5OH 电解水溶液HCl △ Mg MgOMgCO 3 Mg(OH)2 MgCl 2MgSO 4 H 2SO 4 H 2SO 4 H 2SO 4 电解 沸水HClNaOH Ca(OH)2H 2O 煅烧 ①O 2点燃 ②CO 2点燃 Cl 2 Fe FeO H 2SO 4 Cl 2 FeFeCl 2 FeS FeSO 4 Fe 2O 3 FeCl 3Fe(SCN)3 Fe(OH)3 Fe(OH)2 Fe 3O 4 H 2SO 4 H 2SO 4H 2SO 4 HCl NaOH HCl NaOH C O 2 Al H 2O C O 2 AlCO O 2 O 2 H 2O△S △ KSCN Al Al 2O 3 NaAlO 2AlCl 3 Al(OH)3 ①O 2点燃②Fe 2O 3高温电解 NaOH NaOHNaOH NaOH 、NH 3·H 2O HCl HCl HClHCl 、CO 2 △H 2SO 4 △ NaOHFeFe HNO 3Cu H 2SO 4△HNO 3 CuO Cu(OH)2Cu 2OCu(NO 3)2CuSO 4Cu 2S CuSH 2S浓H 2SO 4S 点燃O 2 △CO △ HNO 3 高温 RCHO 水浴加热 AgOHNa 2SS △FeAgAgNO 3Ag 2SAg(NH 3)2OHRCHO 水浴加热Ag 2CO 3AgI AgBr AgClH 2SHNO 3 HNO 3 NH 3·H 2O NH 3·H 2OHCl硅及其化合物之间的相互转化关系氯气及其化合物相互转化关系Cl2PCl 3、PClO 2②点燃NaClAgClNaOH光照3硫及其化合物相互转化关系H3Na SO 4223H 22SO 4O ,燃烧2NaOHO 2BaCl 2H 2O2氮及其化合物相互转化关系NH 4N NO 3243N 23·H 2ONH 4+ OH +H 2,催化剂高温 高压O 2 , 放电2O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O。

金属及其化合物知识点总结思维导图【学习目标】1、掌握氧化钠与过氧化钠的性质,了解过氧化钠的用途;2、理解并掌握碳酸钠的物质性质、化学性质及用途;3、了解焰色反应及K、Na的特征焰色。
【重要方程式】【学习内容】一、氧化钠和过氧化钠1、氧化钠(Na2O)(氧元素的化合价-2价)(1)物理性质白色固体,碱性氧化物,与水化合生成NaOH,接触潮湿的空气会变质.(2)化学性质具有碱性氧化物的通性:①与水反应:Na2O + H2O = 2NaOH②与酸性氧化物反应:Na2O + CO2 = Na2CO3③与酸反应:Na2O + 2HCl = 2NaCl + H2O④加热时:Na2O + O2 = 2Na2O22、过氧化钠(Na2O2)(氧元素的化合价为-1价)(1)物理性质淡黄色固体,过氧化物(2)化学性质①与水反应(滴水生火)实验:将水滴入装有少量过氧化钠固体的试管中,立即在试管口放一根带火星的木条,检查产生的气体。
用手轻轻触摸试管外壁,有什么感觉?然后向反应后的溶液中滴加酚酞溶液。
会发生什么?振荡后是什么现象?现象:反应剧烈,产生大量气体,带火星的木条复燃,试管外壁发热,溶液变红,红色褪色。
解释:反应产生O2,反应放出热量,有NaOH生成, Na2O2有漂白性。
方程式:2Na2O2+ 2H2O = 4NaOH + O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑用途:Na2O2具有强氧化性,有漂白作用。
为氧化性漂白、永久性漂白。
②与二氧化碳反应(吹气生火)实验:用长玻璃管向蘸有Na2O2的脱脂棉吹气。
现象:Na2O2与CO2反应放出大量的热,同时产生氧气,导致脱脂棉燃烧。
方程式:2Na2O2+ 2CO2= 2Na2CO3+ O2↑(Na2O2常作供氧剂)用途:利用此反应Na2O2可以用于呼吸面具或潜水艇中作为氧气的来源。
3、氧化钠(Na2O)与过氧化钠(Na2O2)的区别二、碳酸钠和碳酸氢钠【注意】1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。

金属及其化合物框架图高中化学必修一金属及其化合物第三章金属及其化合物第1课时金属与非金属、酸和水的反应[知识点梳理]一、钠单质1、物理性质:。
2、化学性质:①与非金属单质的反应:常温下:加热时:,现象:②钠与酸反应:与盐酸反应的化学方程式:③与H2O 反应:化学方程式:,现象:离子方程式:3、钠元素的存在:以态存在。
4、保存:保存在中。
钠着火用灭火。
二、铝单质1、化学性质:①与非金属反应:常温下铝能与O2反应生成,保护内层金属。
②与酸反应:与盐酸反应的化学方程式[作业题]1、下列有关钠的物理性质的叙述中正确的是①银白色金属②质软,可以用小刀切割③熔点低于100℃④密度比水小⑤热和电的良导体A 、①②④B 、①②③④C 、①③④D 、①②③④⑤2、以下说法错误的是A 、钠在常温下就容易被氧化B 、钠受热后能够着火燃烧C 、钠在空气中缓慢氧化能自燃D 、钠在氧气中燃烧更为激烈3、从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是A 、NaB 、NaClC 、NaOHD 、Na2O4、下列关于金属钠的说法中,不正确的是A、钠具有银白色金属光泽,密度比水小B、钠的还原性很强,在空中易被氧气氧化而变成过氧化钠C、由于钠的密度比煤油大且不与煤油反应,所以可将少量的钠保存在煤油里D、钠在上业上用于制氯化钠、氢氧化钠、碳酸钠等化合物5、下列关于金属铝的叙述中,说法不正确的是A 、Al 是地壳中含量最多的元素B 、Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性C 、铝箔在空气中受热可以熔化,且发生剧烈燃烧D 、铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落6、活泼金属在空气中易与氧气反应,在表面生成一层氧化膜,氧化膜致密,可以保护内层金属不被继续氧化的金属是A 、铁B 、钠C 、铝D 、镁7、把钠投入到水中,发生化学反应。
假设水无蒸发现象,所得溶液中溶质的质量分数是A 、%B 、%C 、%D 、10%8、欲使每10个水分子中溶有1个钠离子,则90ml 水中应投入金属钠的质量是A 、B 、C 、21gD 、23g9、在钠、镁、铜、铁中,能与冷水反应的是,能与沸水反应的是能与水蒸气反应的写出有关的化学方程式。
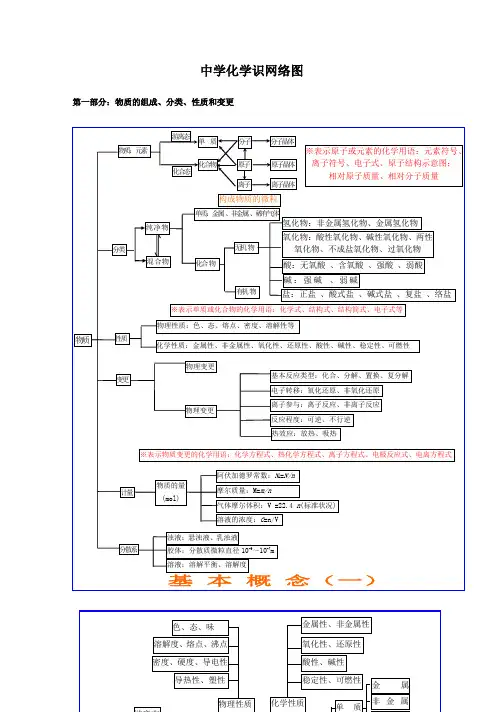
中学化学识网络图第一部分:物质的组成、分类、性质和变更其次部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系第四部分:有机化学有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n -2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n -2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n -6(n ≥6)自然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n -6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。

1.钠及其重要化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的离子方程式
①Na和H2O的反应
2Na+2H2O===2Na++2OH-+H2↑
②Na和CH3COOH的反应
2Na+2CH3COOH===2CH3COO-+2Na++H2↑
③Na2O2和H2O的反应
2Na2O2+2H2O===4Na++4OH-+O2↑
④NaH和水的反应
NaH+H2O===Na++OH-+H2↑
⑤向NaOH溶液中通入过量CO2
OH-+CO2===HCO3-
⑥将Na2CO3溶液与石灰乳混合
CO32-+Ca(OH)2===CaCO3↓+2OH-
⑦向Na2CO3溶液中通入过量CO2
CO32-+CO2+H2O===2HCO3-
⑧将Na2CO3和Ca(HCO3)2混合
CO32-+Ca2+===CaCO3↓
⑨将NaHCO3溶液和NaOH溶液等物质的量混合
HCO3-+OH-===CO32-+H2O
⑩将NaHCO3溶液与澄清石灰水等物质的量混合HCO3-+Ca2++OH-===CaCO3↓+H2O
⑪将NaHCO3溶液与少量澄清石灰水混合
2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O ⑫向饱和Na2CO3溶液中通入过量CO2气体
2Na++CO32-+CO2+H2O===2NaHCO3↓
2.铝及其重要化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的离子方程式
⑬Al和NaOH溶液的反应
2Al+2OH-+2H2O===2AlO2-+3H2↑
⑭Al(OH)3和NaOH溶液的反应
Al(OH)3+OH-===AlO2-+2H2O
⑮Al(OH)3和盐酸的反应
Al(OH)3+3H+===Al3++3H2O
⑯Al2O3和NaOH的反应
Al2O3+2OH-===2AlO2-+H2O
⑰Al2O3和盐酸的反应
Al2O3+6H+===2Al3++3H2O
⑱NaAlO2和过量盐酸的反应
AlO2-+4H+===Al3++2H2O
⑲向NaAlO2溶液中通入过量CO2气体
AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
⑳将NaAlO2与NaHCO3混合
AlO 2-+HCO 3-+H 2O===Al(OH)3↓+CO 32-
○
21将NaAlO 2与AlCl 3溶液混合 3AlO 2-+Al 3++6H 2O===4Al(OH)3↓
○
22向AlCl 3溶液中加入过量NaOH 溶液 Al 3++4OH -===AlO 2-+2H 2O
○
23向AlCl 3溶液中加入过量氨水 Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+
○
24将AlCl 3溶液与NaHCO 3溶液混合 Al 3++3HCO 3-===Al(OH)3↓+3CO 2↑
3.铁及其重要化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
○
25Fe 和过量稀HNO 3的反应 Fe +4H ++NO 3-===Fe 3+
+NO ↑+2H 2O ○
26Fe 高温下和水蒸气的反应 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2
○
27Fe 2O 3和Al 的反应 Fe 2O 3+Al=====高温2Fe +Al 2O 3
○
28Fe 2O 3高温下和CO 的反应 Fe 2O 3+3CO=====高温2Fe +3CO 2
○
29FeCl 3溶液和Cu 的反应 2Fe 3++Cu===2Fe 2++Cu 2+
○
30FeCl 3与KSCN 的反应 Fe 3++3SCN -===Fe(SCN)3
○
31向FeCl 2溶液中加入等物质的量的Na 2O 2 4Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3+8Na ++O 2↑ ○
32向FeCl 2溶液中加入NaClO 2Fe 2++ClO -+4OH -+H 2O===2Fe(OH)3↓+Cl - ○
33Fe(OH)2长时间置于空气中 4Fe(OH)2+O 2+2H 2O===4Fe(OH)3
○
34Fe 3O 4和HCl 的反应 Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O
○
35Fe 3O 4和稀HNO 3的反应 3Fe 3O 4+28H ++NO 3-===9Fe 3++NO ↑+14H 2O ○
36FeO 和HCl 的反应 FeO +2H +===Fe 2++H 2O
○
37FeO 和稀HNO 3的反应 3FeO +10H ++NO 3-===3Fe 3++NO ↑+5H 2O ○
38Fe(OH)2和HCl 的反应 Fe(OH)2+2H +===Fe 2++2H 2O
○
39Fe(OH)2和稀HNO 3的反应 3Fe(OH)2+10H ++NO 3-===3Fe 3++NO ↑+8H 2O ○
40Fe(OH)3和HI 的反应
2Fe(OH)3+6H ++2I -===2Fe 2++I 2+6H 2O
○
41FeBr 2和少量Cl 2的反应 2Fe 2++Cl 2===2Fe 3++2Cl -
○
42FeBr 2和Cl 2等物质的量反应 2Fe 2++2Br -+2Cl 2===2Fe 3++Br 2+4Cl -
○
43FeBr 2和过量Cl 2的反应 2Fe 2++4Br -+3Cl 2===2Fe 3++2Br 2+6Cl -
4.铜及其重要化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
○
44Cu 在硫蒸气中燃烧 2Cu +S=====△Cu 2S
○
45铜在空气中生成铜绿 2Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3
○
46用惰性电极电解CuSO 4溶液 2Cu 2++2H 2O=====通电2Cu +4H ++O 2↑
○
47Cu 和浓HNO 3的反应 Cu +4H ++2NO 3-===Cu 2++2NO 2↑+2H 2O
○
48Cu 和稀HNO 3的反应
3Cu +8H ++2NO 3-===3Cu 2++2NO ↑+4H 2O ○
49Cu 和浓H 2SO 4的反应 Cu +2H 2SO 4(浓)=====△Cu 2++SO 42-+SO 2↑+2H 2O
○
50胆矾受热分解 CuSO 4·5H 2O=====△CuSO 4+5H 2O ↑。