北京化工大学2004考研物理化学试题
- 格式:doc
- 大小:1.11 MB
- 文档页数:10




华南理工大学2004年攻读硕士学位研究生入学考试试卷(329)参考答案科目名称:物理化学(化)适用专业:无机化学、分析化学、物理化学、环境科学说明:本答案由葛华才老师完成,试题做了规范化和少量处理,若有不恰当之处特别是错误之处,欢迎用电子邮件方式告知葛老师本人(邮箱:**************)。
一. 2 mol 乙醇在正常沸点(78.4℃)下,变为蒸汽,其摩尔汽化焓为41.50kJ . mol-1,乙醇蒸汽可视为理想气体。
(1)试求该相变过程的Q,W,△U,△S,△A,△G。
(2)若乙醇摩尔汽化焓可认为与温度无关时,那么50℃时乙醇的饱和蒸汽压应为多少?(3)当2mol乙醇蒸汽在101325Pa下,从78.4℃升温至100℃时,△H,△S各为多少?(已知C p,m(C2H5OH,g)=65.44 J . mol-1 . K-1)。
(本题15分)解:(1) Q p=∆H=n ∆vap H m= 2mol×41.50kJ . mol-1= 83.00 kJW= -p∆V= -pV g= -nRT= -[2×8.315×(273.15+78.4)] J =5846J∆U=Q+W= 83.00kJ+5.846kJ=88.85kJ∆S=Q/T= 83000J/(273.15+78.4)K=236.1J . K-1∆G=0 (可逆相变)∆A=∆U-T∆S=W= 5846J(2) 已知T=351.55K,p=101.325kPa,蒸发焓∆vap H m= 41.50kJ . mol-1,利用克-克方程可求T’=323.15K时的蒸气压p’:ln(p’/101.325kPa)=-(41500/8.315)[(1/323.15)-(1/351.55)]p’=28.10kPa(3) 乙醇蒸汽C p,m与温度无关,△H=nC p,m△T=(2×65.44×21.6)J = 2827J△S = nC p,m ln(T2/T1)=[2×65.44×ln(373.15/351.55)]J . K-1 = 7.804J . K-1二. 已知在298K,100 kPa下,反应:C2H4 (g)+H2O (l)==C2H5OH (l)数据如下:(C2H4(g)视为理想气体)C2H4 (g) H2O (l) C2H5OH (l) △f H mθ/kJ . mol-152.26 -285.83 -277.7S m θ/J . mol -1 . K -1219.6 69.91 161 C p ,m /J . mol -1 . K -1 43.56 75.291 111.5(1) 试求在298K 下,反应的标准平衡常数K θ。
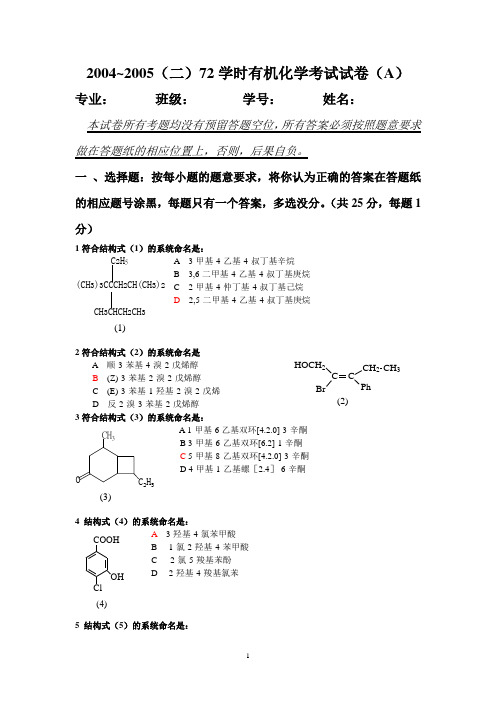
2004~2005(二)72学时有机化学考试试卷(A )专业: 班级: 学号: 姓名:本试卷所有考题均没有预留答题空位,所有答案必须按照题意要求做在答题纸的相应位置上,否则,后果自负。
一 、选择题:按每小题的题意要求,将你认为正确的答案在答题纸的相应题号涂黑,每题只有一个答案,多选没分。
(共25分,每题1分)1符合结构式(1)的系统命名是:A 3-甲基-4-乙基-4-叔丁基辛烷B 3,6-二甲基-4-乙基-4-叔丁基庚烷C 2-甲基-4-仲丁基-4-叔丁基己烷D 2,5-二甲基-4-乙基-4-叔丁基庚烷2符合结构式(2)的系统命名是A 顺-3-苯基-4-溴-2-戊烯醇B (Z)-3-苯基-2-溴-2-戊烯醇C (E)-3-苯基-1-羟基-2-溴-2-戊烯D 反-2-溴-3-苯基-2-戊烯醇3符合结构式(3)的系统命名是:A 1-甲基-6乙基双环[4.2.0]-3-辛酮B 3-甲基-6-乙基双环[6.2]-1-辛酮C 5-甲基-8-乙基双环[4.2.0]-3-辛酮D 4-甲基-1-乙基螺[2.4]-6-辛酮4 结构式(4)的系统命名是:A 3-羟基-4-氯苯甲酸B 1-氯-2-羟基-4-苯甲酸C 2-氯-5-羧基苯酚D 2-羟基-4-羧基氯苯5 结构式(5)的系统命名是:CH 3CHCH 2CH 3C 2H 5(CH 3)3CCCH 2CH(CH 3)2(1)C CH 2CH 3Ph HOCH 2Br (2)(3)O CH 3C 2H 5COOHOH Cl(4)A 5-乙基-1-萘磺酸B 5-乙基-2-萘磺酸C 4-乙基-1-萘磺酸C6-磺酸基-1-乙基萘6结构式(6)的系统名称是:A 2-甲基-1-环己基-3-丁酮B 3-甲基-4-环己基-2-丁酮C 2-环己烷甲基-3-丁酮D 2-甲基-1-环己基-3-羰基丁烷7(7)的系统命名名称是:A N ,O, 6-三甲基-3-庚胺B 2-甲基-4-甲氧基-5-甲氨基庚烷C 2-甲基-5-甲氧基-6-氨甲基庚烷D 6-甲基-3-甲氨基-4-甲氧基庚烷8结构式(8)的系统命名是:A (2S ,3S )N-苯基-3-氯-2-溴丁酰胺B (2R ,3R )3-氯-2-溴丁酰苯胺C (2S ,3R )3-氯-2-溴丁酰苯胺D (2R ,3S )3-氯-2-溴丁酰苯胺9 与(S )-α-碘代丁醛成对映异构体的结构是:3I CH 3H H OHCCOHCI3HHABC10 顺-1-甲基-4-异丙基环己烷的优势构象是:11 下列自由基的稳定性由大到小的顺序为:.SO 3H(5)(6)CH 2CH CH 3C OCH 3(7)CH 3CH 2CHCHCH 2CH 2CH(CH 3)2NHCH 3OCH 3(8)3ClH BrH CONHPh 3HHCH(CH 3)2CCH(CH 3)2HCH 3A CH(CH 3)2HH3DHHCH 3CH(CH 3)2B.CH 3CH 2CCH 2CH 2CH 2CH 3CH 3CH 2CHCHCH 3CH 2CH 3CH 3CH 2CCH 2CH 3CH 2CH 3(1)(2)(3)A. (1)>(2)>(3)B. (2)>(1)>(3)C. (3)>(2)>(1) 12 下列化合物中,具有光学活性的的化合物是:Cl HCl H COOH3CH 3Br ABCDCOOHCOOHNO 213.下列化合物发生亲电取代反应的活性由大到小的顺序为:C 2H 5COOH NO 2Cl(1).(2)..(3).(4).A. ⑴>⑵>⑶>⑷B. ⑵>⑴>⑶>⑷C. ⑷>⑵>⑴>⑶D. ⑴>⑷>⑵>⑶14.根据H ückel 规则,下列单体物质中具有芳香性的是:(1)(3)(4)(2)NCH 3CH 3OO (5)15. 下列化合物在NaI 的CH 3COCH 3溶液中反应的快慢顺序为: (1). 3-溴-1-丙烯 (2). 溴乙烯 (3). 1-溴丁烷 (4). 2-溴丁烷A. ⑴>⑵>⑶>⑷B. (1)>(3)>(4)>(2)C. ⑵>⑴>⑶>⑷D. ⑶>⑴>⑵>⑷ 16. 下列各组化合物与AgNO 3的乙醇溶液反应速率快慢顺序为:CH 2CH 2BrCH 2BrCH CH 3Br(1).(2).(3).(4).A⑵>⑴>⑶>⑷ B. ⑶>⑵>⑴>⑷ C. ⑵>⑴>⑶>⑷ D. (1)>(3)>(4)>(2) 17. 下列化合物的酸性强弱顺序是:OH NO 2COOH(1) .(2) .(3).(4).CF 3COOHCH 3CH 2OHA.⑶>⑷>⑴>⑵B. ⑶>⑴>⑵>⑷C.⑴>⑵>⑷>⑶D. (2) >(1)> (4)>(3) 18. 与HCN 加成反应活性大小顺序为:(1)(2). PhCHO PhCOCH 3O(3)CH 3CH 2CHO(4)A. ⑵>⑴>⑶>⑷B. ⑶>⑵>⑴>⑷C. ⑴>⑵>⑷>⑶D. (4)> (1) > (3) > (2) 19.下列不属于S N 1反应特征的是:A 反应速率与亲核试剂浓度无关;B 反应物有多种重排产物C 空间位阻影响反应时间D 极性溶剂有利于反应进行 20 下列四个物种的亲核性顺序是:O-CH 3COO -CH 3CH 2O -OH -(2)(1)(3)(4)A ⑵>⑴>⑶>⑷ B. ⑶>⑷>⑵>⑴ C. ⑷>⑴>⑶>⑵ D. (4)>(1)>(2)>(3) 21 下列引入卤素的反应中,属于亲电取代历程的反应是:A 甲苯上甲基的卤化B 苯的卤化C 酸催化醛酮的α位卤代D 烯烃加次卤酸 22. 下列四个化合物的碱性由大到小的顺序为:. (1).NH 3(2).CH 3CH 2NH 2(3).PhNH 2(4). PhNHCOCH 3A. ⑴>⑷>⑵>⑶B. (3)>(2)>(4)> (1)C. ⑵>⑷>⑶>⑴D. ⑷>⑵>⑴>⑶ 23. 理论上判断,下列化合物沸点从高到低的顺序应为: (1). 对苯二酚 (2) 甲苯 (3) 对氯苯酚 (4). 苯甲醚A. ⑴>⑶>⑷>⑵B. (1) >(3)>(2)> (4)C. ⑵>⑷>⑶>⑴D. ⑵>⑴>⑶>⑷ 24. 下列化合物在水中溶解度从大到小的顺序,理论上判断应为: ⑴.苯甲酸 ⑵.丙三醇 ⑶. 乙酸乙酯 ⑷. 乙苯A. ⑴>⑵>⑷>⑶B.⑴>⑵>⑶>⑷C. ⑵>⑴>⑶>⑷D. (4)>(1)>(2)>(3) 25 下列哪一个描述对于E2反应是不正确的: A 试剂的碱性增强可以加快E2反应。

北京化工大学攻读硕士学位研究生入学考试物理化学样题注意事项1.答案必须写在答题纸上,写在试卷上均不给分.........。
2.答题时可不抄题,但必须写清题号。
3.答题必须用蓝、黑墨水笔或圆珠笔,用红笔或铅笔均不给分。
-23-11.将1mol在温度T及其饱和蒸汽压p*下的H2O(l)分别经过程I:等温、等压蒸发及过程II:向真空蒸发,变为相同温度、相同压力下的H2O(g)。
下列关系正确的是。
A.ΔG(I) ≠ΔG(II),ΔH(I) = Q(I),ΔH(II) ≠Q(II)B.ΔG(I) = ΔG(II),ΔU(I) = Q(I),ΔH(I) = ΔH (II)C.ΔG(I) = ΔG(II),ΔH(I)= ΔU(I),ΔH(II) ≠Q(II)D.ΔG(I) = ΔG(II),ΔH(I)= Q(I),ΔH(II) ≠Q(II)2.对封闭系统,下列自发性判据不正确...的是。
A.等温且W'=0的过程:ΔA≤W体积B.等温等压且W'=0的过程:ΔG≤0C.任意过程:ΔS隔离=ΔS系统+ΔS环境≤0D.恒熵恒容过程:ΔU≤W'3.下列有关偏摩尔物理量和化学势的说法不正确的是:A.偏摩尔物理量为恒温恒压下增加1mol某物质的量对容量性质的贡献值B.某物质在T、p条件下达气液平衡时,其气态化学势与液态化学势相等C.理想液态混合物在T、p条件下混合过程无吸、放热现象及无体积变化D.恒温恒压下,物质自发进行的方向是向着化学势减小的方向进行4.对于理想液态混合物的混合过程,混合前后下列关系正确的是。
A.ΔV=0,ΔH=0,ΔS>0,ΔG<0B.ΔV<0,ΔH>0,ΔS>0,ΔG<0C.ΔV<0,ΔH>0,ΔS<0,ΔG>0 D.ΔV=0,ΔH=0,ΔS<0,ΔG>05下列表达正确的是。
A.该反应的分解温度是897℃B.1200℃时分解压力为29.1×10-2 kPaC.600℃时该反应的平衡压力为2.45×10-3 kPaD.该反应为放热反应降低温度有利于反应进行6.反应器内放入N2(g)、O2(g)及一种固体催化剂,反应达平衡时生成两种气态氮氧化物,系统的独立组分数、相数及自由度数分别为:。
北京化工大学2004(选择题30题50分,其余计算题6题100分,共150分)注意事项:答案写在答题纸上,p =100kPa ≈101.325kPa ,用红色或铅笔不计成绩。
一、选择题(50分)1. 1mol 理想气体经恒温膨胀、恒容加热和恒压冷却三步完成一个循环回到始态,此过程气体吸热20.0 kJ 。
则过程的W :A. =20kJ ;B. <20kJ ;C. >20kJ ;D.等于其它值。
2. 若要通过节流膨胀达到致冷的目的,则焦耳-汤姆生系数为:A. H T J p T ⎪⎪⎭⎫ ⎝⎛∂∂=-μ=0B. H T J p T ⎪⎪⎭⎫⎝⎛∂∂=-μ>0C. HT J p T ⎪⎪⎭⎫⎝⎛∂∂=-μ<0 D 与T J -μ的取值无关 3. 若某化学反应的m p r C ,∆=0,则该反应的m rH ∆与温度的关系为:A. 随温度增加而增加;B. 随温度增加而减少;C. 与温度变化无关;D. 与温度变化无规律;。
4. 1mol 理想气体经过一个恒温不可逆压缩过程,则该过程:A. G ∆>A ∆;B. G ∆=A ∆;C. G ∆<A ∆;D. 无法比较5. 在298K 时已知气相反应)(2)()(2g C g B g A →+的θm r G ∆为-514.2 kJ ·mol -1,则发生1mol反应的θA ∆:A. θA ∆=-514.2 kJ ·mol -1B. θA ∆=0C. θA ∆>-514.2 kJ ·mol -1D. θA ∆<-514.2 kJ ·mol -16. 对于纯物质、单相、只做体积功的封闭系统,Tp G ⎪⎪⎭⎫⎝⎛∂∂的值:A. 大于零B. 小于零C. 等于零D. 无法确定7. 水的饱和蒸气压与温度的关系为:ln(p/kPa)=A -4883.8/(T/K)。
水的摩尔蒸发焓m Vap H ∆为:A. 40.603×103 kJ ·mol -1;B. 4.883×103 kJ ·mol -1;C. 0.587×103 kJ ·mol -1; D. 其它值。
8. 由2molA 和2molB 形成理想液态混合物,己知某温度下*A p =90kPa ,*B p =30kPa 。
则平衡气相摩尔分数之比y A ∶y B 为∶B. 3∶1 B. 4∶1C. 6∶1D. 8∶19. 由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中的化学势的是:A. 1,,2n p S n H ⎪⎪⎭⎫⎝⎛∂∂ B. 1,,2n p T n G ⎪⎪⎭⎫ ⎝⎛∂∂ C. 1,,2n V T n A ⎪⎪⎭⎫ ⎝⎛∂∂ D. 1,,2n p T n U ⎪⎪⎭⎫⎝⎛∂∂ 10. 298K 下,将两种液体恒温恒压混合,形成理想液态混合物,则混合前后下列热力学性质的变化情况为: A S ∆>0, G ∆<0 B. S ∆=0, G ∆<0 C. S ∆<0, G ∆>0 D. 以上均不对11. 恒温恒压下只作体积功的多组元(B,C,…,K),多相(α,β,…,Φ)系统,自发过程或达到平衡的判据是:A.∑∑ΦαααμKB BBdn ≥B.∑∑ΦαααμKB B B dn ≤C.ααμBKBBdn ∑≤0D.ααμB KBB dn ∑≥12. 反应23 H 2(g)+21 N 2(g)= NH 3(g),当H 2因反应消耗了0.3 mol 时,反应进度ξ为:A. 0.1B. 0.3C. 0.5D. 0.213. 理想气体化学反应平衡时(ν∆≠0),加入惰性气体,平衡不发生移动的条件是:A. 恒温恒压B. 恒温恒容C. 任意条件D. 绝热恒压14. 如图所示:将含有HNO 3为70%(摩尔百分数)的硝酸用高效精馏塔进行精馏时,塔项和塔釜分别得到:A. 塔项:恒沸混合物,塔釜:纯HNO 3B. 塔项:纯HNO 3, 塔釜:纯水C. 塔项:纯HNO 3, 塔釜:恒沸混合物D. 塔项:纯水, 塔釜:恒沸混合物15.1mol 某双原子分子理想气体在300K 等温膨胀时:A. tr q 、R q 、V q 、e q 、n q 均不变;B. tr q 变化,R q 、V q 、e q 、n q 均不变;C. R q 不变,tr q 、V q 、e q 、n q 均变;D. tr q 、R q 、V q 、e q 、n q 均变化。
16. 刚性转子的转动量子数为J 时,其转动能级简并度数为;A. JB. J(J+1)C. 2J+1D. 非简并能级17. 在吸附过程中,以下热力学量的变化正确的是:A. △G<0,△S<0,△H<0;B. △G>0,△S>0,△H>0;C. △G<0,△S>0,△H>0;D. △G>0,△S<0,△H<0。
18. 浓度为0.3 mol ·kg -1A 2B 电解质溶液的离子强度为A.0.9 mol ·kg -1B. 0.3 mol ·kg -1C. 0.6 mol ·kg -1D. 1.8 mol ·kg -1 19. 温度T 时,浓度为0.01 mol ·kg -1的NaCl ,CaCl 2,LaCl 3三种电解质水溶液,离子平均活度系数最小的是: A. NaCl B. CaCl 2 C. LaCl 3 D. 都相同 20. 下列电极298K 时其标准电极电势为:电极 θE /V 1. Cu ++e -= Cu 0.5222. Cu 2++2e -= Cu 0.3403. Cu 2++e -= Cu +0.158电池反应:Cu + Cu 2+= 2Cu +在298K 的标准平衡常数θa K 为: A. 1.8×10-6 B. 6.96×10-7 C. 8.34×10-4 D. 以上都不对 21. 298K 和θp 压力下,有化学反应:Ag 2SO 4(s)+H 2(θp )=2Ag(s)+H 2SO 4(aq)己知:θE {Ag 2SO 4/Ag,SO 42-}=0.627V ,θE {Ag +/Ag}=0.799V 。
如上电池的标准电池电动势θE 为:A. 0.627VB. -0.172VC. 0.799VD. 0.172V 22. 298K 和θp 压力下,有电池如下:Ag(s)|Ag +(+Ag a )||SO 42-(-24SO a )|Ag 2SO 4(s), Ag(s)己知:θE {Ag 2SO 4/Ag,SO 42-}=0.627V ,θE {Ag +/Ag -}=0.799V 。
如上电池的sp K 为: A. 1.72×10-6 B. 1.52×10-6 C. 1.72×10-9 D. 1.52×10-923. 有恒温、恒容下的某气相反应A(g)+B(g)→C(g),若用反应物A 的分压4.0A p 对时间t 作图为一直线,则该反应的反应级数为:A. 0.4B. 0.6C. 1.4D. 1.6 24. 有下列反应:式中k 1,k 2分别是正向、逆向基元反应的速率常数,298K 时其值分别为:3.33×10-3S -1,6.67×10-7(S ·θp )-1。
上述对行反应在298K 时的平衡常数K p :A. 5.0×10-3θp B. 2.0×104 θpC. 5.0×103θp D. 2.0×10-4θp25. 己知一平行反应,由两个基元反应构成:A →B 的速率常数为k 1,A →C 的速率常数为k 2,则该平行反应的总反应速率常数k 为:A. k 1+k 2B. k 1/k 2C. k 2 /k 1D. = k 126. 293K 时,乙醚—水、汞—乙醚、汞—水的界面张力为0.0107,0.379,0.375 N ·m -1,在乙醚与汞的界面上滴一滴水,其接触角θ 为:A. 68oB. 112oC. 168oD. 22o27. 473.2 K 时测定氧在某催化剂上的吸附作用,其吸附量满足如下方程:Γ=pp p p ⨯+⨯-)(22.11)(539.51θθ=2.27 dm 3·kg -1该吸附的饱和吸附量为:A. 2.27 dm 3·kg -1B. 4.54 dm 3·kg -1C. 5.539 dm 3·kg -1D. 1.22 dm 3·kg -128. Al(NO 3)3,Mg(NO 3)2和NaNO 3对AgI 水溶胶聚沉值分别为0.067 mol ·dm -3,2.60mol ·dm -3、,和140 mol ·dm -3,则该AgI 溶胶:A. 胶粒带正电B. 胶粒呈电中性C. 胶粒带负电D.无法确定29. 乙酸乙酯皂化反应动力学实验中,为了测定不同时间的乙酸乙酯的浓度变化,可采用物理法,选用的测量仪器是: A.折光仪 B. 电导仪 C. 旋光仪 D. 酸度计30. 采用静态法测液体的饱和蒸汽压时,实验步骤中要将溶在液体中的空气排出,测定不同温度下的饱和蒸汽压。
若实验中空气没有排净,则实验测得的蒸汽压值比理论值: A. 偏大 B. 偏小 C. 不影响 D. 没有规律 二、(20分)某气体服从状态方程:⎪⎪⎭⎫⎝⎛+2m V a p m V =RT (设a >0,常数) (1) 证明:温度恒定时气体的热力学能随体积增大而增加,即:T m m V U ⎪⎪⎭⎫⎝⎛∂∂>0 (2) 1mol 该气体由始态(T,V m )恒温可逆变化到终态(T,2V m ),计算过程的W 、Q 、△U m 、△H m 、△S m 。
三、(15分) 有化学反应:U(s)+23H 2(g)=UH 3(s)己知:温度在450K —725K 范围内,反应系统中H 2的平衡压力遵从方程:⎪⎭⎫ ⎝⎛Pa p ln =69.32―KT /10464.14⨯-5.65ln(T/K)(1) 写出UH 3(s)的标准摩尔生成焓与温度关系式; (2) 计算上述反应的标准摩尔热容差θm p r C ,∆四、(10分)己知N 2(g)的振动特征温度V Θ=3388 K ,若以振动基态为能量零点基准: (1) 计算298.15 K 时N 2分子振动配分函数0v q ;(2) 若在某温度下N 2分子的振动配分函数0v q =2;求此时系统的温度? 五、(20分)己知298K 时电池:Pt,H 2(100 kPa)|稀NaOH |Ag 2O(s),Ag(s) 的电动势E=1.172V 。