药物化学药物的化学结构与体内代谢转化
- 格式:doc
- 大小:4.12 MB
- 文档页数:15


药物化学重点药物化学结构及类型总结归纳药物化学是药学学科的重要分支,研究药物的化学结构及其在体内的转化代谢过程。
药物化学的目标是寻找新的药物分子,改进已有药物的性质,提高药物的疗效和安全性。
下面对药物化学的重点以及药物化学结构及类型进行总结归纳。
重点药物化学结构:1.天然药物结构:天然药物是从动植物、微生物或矿物中提取的具有治疗作用的化合物。
常见的天然药物结构包括植物碱、生物碱、黄酮类化合物等。
例如:华法林(Warfarin)是一种抗凝药物,其结构中含有香豆素环并有杂原子(柳树苷结构)。
2.合成药物结构:合成药物是通过化学合成的方式制备出来的药物。
常见的合成药物结构包括芳香环、饱和环、杂环等。
例如:阿司匹林(Aspirin)是一种常用的非处方药,其结构中含有芳香环、酯基和醇基。
3.基础结构与活性团:药物分子的活性来自于其基础结构和活性团。
基础结构是药物分子的骨架,而活性团是具有特定活性的功能基团。
药物化学研究着重于发现和优化药物分子的基础结构和活性团,以提高药物的药效和选择性。
4.药物基团及键的导向作用:药物分子中的基团和键可以通过导向作用改变药物的性质和活性。
例如,引入取代基可以改变药物分子的溶解度、稳定性和活性。
导向作用是药物化学的重要概念之一,它指导了药物分子的设计、合成和改进。
药物化学的类型:1.pH敏感药物:pH敏感药物指的是药物的溶解度或释放行为受环境pH值的影响。
例如,肠溶片是一种常见的pH敏感药物,它只在肠道酸性环境下才能溶解释放药物。
2.离子对药物:离子对药物是指药物分子中含有正离子和负离子,它们之间通过离子键结合在一起。
离子对药物通常具有高溶解度和良好的生物利用度,因此被广泛应用于药物设计和合成。
3.靶向药物:靶向药物是指具有选择性作用于特定靶点的药物。
它们通常具有特定的结构特征,能够与靶点发生相互作用,并发挥治疗作用。
例如,酪氨酸激酶抑制剂普利都巴(Imatinib)是一种靶向白血病细胞的药物,其结构能够与癌细胞的激酶结合,从而抑制细胞生长。

药物化学药物的化学结构与体内代谢转化药物化学是研究药物的化学结构和活性关系,以及药物在体内吸收、分布、代谢和排泄的学科。
其中,药物的化学结构与其在体内的代谢转化过程是理解药物作用机制的关键。
本文将探讨药物化学药物的化学结构与体内代谢转化的关系。
药物的化学结构决定了其物理化学性质,进而影响其在体内的药动学和药效学。
例如,脂溶性药物容易通过细胞膜,而水溶性药物则更容易被肾排出。
药物的化学结构也决定了其是否能够被体内酶系代谢以及代谢产物的性质。
药物在体内的代谢转化主要涉及氧化、还原、水解和结合等反应。
这些反应主要在肝脏进行,由肝微粒体中的酶促反应完成。
药物的代谢产物通常比原药具有更低的活性,甚至可能产生不良反应。
因此,药物的代谢转化对于理解药物的作用机制和不良反应的发生至关重要。
药物的化学结构决定了其在体内的代谢转化路径。
例如,一些药物可以被肝脏中的CYP450酶系氧化,而其他药物则可能被其他酶系进行代谢。
了解药物的代谢转化路径可以更好地预测药物之间的相互作用,避免不良反应的发生。
药物的化学结构与体内代谢转化是理解药物作用机制的关键。
药物的化学结构决定了其物理化学性质和代谢转化路径,而代谢转化则影响了药物在体内的药动学和药效学。
因此,在药物设计和开发过程中,需要对药物的化学结构和体内代谢转化进行深入研究,以优化药物的疗效和安全性。
当我们回顾药物发现与发展的历史,不难发现天然药物在其中扮演了至关重要的角色。
然而,随着科技的进步,化学药物逐渐成为了现代医学的支柱。
本文将探讨天然药物向化学药物转化的历程,以及这一过程中所涉及的新思路和新技术的应用。
在过去的几个世纪里,天然药物向化学药物的转化经历了漫长的历程。
最早的天然药物,如吗啡和阿司匹林,都是从植物中提取的。
随着有机合成技术的不断发展,化学家们开始尝试合成这些天然药物及其类似物。
这一阶段的代表性成果包括合成抗生素和抗疟药等。
通过这一过程,人们逐渐认识到天然药物转化为化学药物的重要性和必要性,因为这不仅可以提高药物的产量和质量,还可以通过结构优化来实现药物效果的进一步提升。
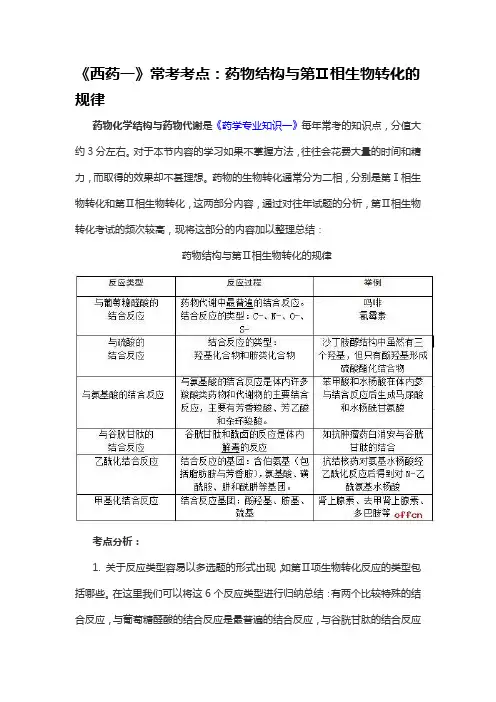
《西药一》常考考点:药物结构与第Ⅱ相生物转化的规律
药物化学结构与药物代谢是《药学专业知识一》每年常考的知识点,分值大约3分左右。
对于本节内容的学习如果不掌握方法,往往会花费大量的时间和精力,而取得的效果却不甚理想。
药物的生物转化通常分为二相,分别是第Ⅰ相生物转化和第Ⅱ相生物转化,这两部分内容,通过对往年试题的分析,第Ⅱ相生物转化考试的频次较高,现将这部分的内容加以整理总结:
药物结构与第Ⅱ相生物转化的规律
考点分析:
1. 关于反应类型容易以多选题的形式出现,如第Ⅱ项生物转化反应的类型包括哪些。
在这里我们可以将这6个反应类型进行归纳总结:有两个比较特殊的结合反应,与葡萄糖醛酸的结合反应是最普遍的结合反应,与谷胱甘肽的结合反应
可以解毒;有两个带“化”的反应,即乙酰化结合反应和甲基化结合反应;有两个带“酸”的结合反应,即与硫酸的结合反应和与氨基酸的结合反应。
通过归纳总结我们就可以将6种结合反应的类型全部掌握了。
2. 在考题当中以B型题(配伍选择题)的形式考查具体的药物是哪一类型的结合反应,在这里我们采用口诀的方式进行记忆:流沙氨酸马绿糖,肽白甲多肾一对。
流沙——沙丁胺醇的结合反应是与硫酸的结合反应;
氨酸——与氨基酸结合的反应主是羧酸类药物,如苯甲酸和水杨酸;
马绿糖——吗啡与氯霉素反应类型为与葡萄糖醛酸的结合反应;
肽白——白消安的反应类型是与谷胱甘肽的结合反应;
甲多肾——肾上腺素、去甲肾上腺素和多巴胺的反应类型是甲基化结合反应;
一对——对氨基水杨酸的反应类型是乙酰化结合反应。
通过对以上知识点的归纳总结和口诀记忆,就可以将药物结构与第Ⅱ相生化转化的规律的考点都掌握了。




药物化学药物的化学结构与体内代谢转化药物化学是研究药物的化学结构和性质,以及药物在体内代谢转化的学科。
在药物研发中,了解药物的化学结构和代谢转化对于评估药物的活性、药代动力学特性以及副作用具有重要意义。
本文将对药物化学和药物代谢转化进行详细探讨。
药物的化学结构是指药物在化学上所具有的特定的分子结构。
药物的化学结构决定了药物的药理活性、物化性质以及与靶标结合的方式。
药物的化学结构可以通过研究药物的组成元素、原子结构以及化学键进行探索。
药物的化学结构是药物研发的起点,研究者通过对化学结构的改造来提高药物的活性、选择性以及药物代谢特性。
药物的体内代谢转化是指药物在机体内的生物化学反应和代谢过程。
药物在体内代谢转化主要通过酶的催化作用完成。
药物代谢可以分为两个主要阶段,即相应的阶段Ⅰ反应和阶段Ⅱ反应。
阶段Ⅰ反应是指药物通过氧化、还原、水解、脱甲基等反应转化成更活性或更易代谢的物质。
其中最常见的反应是氧化反应,通过细胞色素P450(CYP)酶家族参与催化。
CYP酶催化的氧化反应通常发生在药物的碳、氮或硫原子上,从而形成药物的代谢产物。
其他的阶段Ⅰ反应还包括还原反应、水解反应和脱甲基反应等。
这些反应主要发生在肝脏中的内质网中,使药物转化为亲水性更强的代谢产物。
阶段Ⅰ代谢转化可以增加药物的药理活性、提高药物的水溶性,也可能产生毒性代谢产物。
阶段Ⅱ反应是指药物代谢产物通过与内源性物质(如葡萄糖、甘氨酸、硫酸等)结合,形成更极性、更易排泄的产物。
阶段Ⅱ代谢反应通常被称为“偶联反应”,其中最常见的是葡萄糖醛酸转移酶(GT)参与的糖基化反应。
阶段Ⅱ代谢转化可以大大增加药物的水溶性,使药物更容易排除。
药物的代谢转化对药物的活性、毒性以及体内停留时间有很大的影响。
药物代谢转化的主要作用是将药物从机体中排除,并减少药物的毒性。
然而,一些药物的代谢转化也可能产生活性代谢产物,并参与药物的药理作用。
药物的代谢转化的机制和调控对于药物疗效的评估和优化具有重要意义。



药物代谢与体内药物浓度的关系药物代谢是指药物在人体内经过化学反应而被转化成不同的物质的过程。
这个过程涉及多个因素,包括有机体本身的代谢能力、药物的化学结构、药物用量和给药途径等等。
药物代谢的速率和效率对于药物的疗效和安全性都有着非常重要的影响。
在很多情况下,药物代谢会直接影响体内药物浓度的水平。
那么,药物代谢和体内药物浓度之间究竟有什么样的关系呢?药物代谢与体内药物浓度的基本原理药物在体内代谢被分成两个阶段:第一阶段药物代谢和第二阶段药物代谢。
第一阶段药物代谢通常包括氧化、还原、羟基化和脱氧等反应,这些反应可以使药物的分子结构发生改变,从而更容易被第二阶段代谢和排泄。
第二阶段药物代谢主要涉及药物和代谢产物之间的结合,包括酰化、硫酸化和甘氨酸化等反应。
这些反应使得药物及其代谢产物更容易在肝脏和其他组织中被排泄出体外,从而达到了维持体内药物浓度在适宜水平的作用。
在药物代谢过程中,绝大部分药物都经过肝脏代谢,在代谢物通过肝脏后,药物的浓度就会随着时间流逝而下降。
这就是为什么需要多次给药,以维持药物浓度在治疗水平的原因。
同样,药物代谢的速率也会直接影响体内药物浓度和疗效的水平。
如果药物代谢过快,则药物浓度下降较快,导致药效不足,甚至失去疗效;而如果药物代谢过慢,则药物积累在体内的可能性会增加,导致药物中毒的危险性。
因此,药物代谢和体内药物浓度之间的关系非常重要。
药物代谢的影响因素药物代谢的过程是非常复杂的,涉及众多因素。
药物代谢的主要影响因素包括以下几点。
1. 组织血流。
药物代谢过程主要发生在肝脏中,而肝脏对于血液循环有着非常重要的作用。
因此,组织血流的速度和经过此组织的血量可以直接影响药物代谢的速率和效率。
2. 酶系统。
药物代谢主要依赖于体内的酶系统。
酶是大分子的蛋白质,具有催化某些化学反应的能力。
药物通常是通过肝脏酶系统代谢的,这些酶固定存在于肝脏小管上皮细胞内。
酶的种类和数量是肝脏代谢药物速率和效率的重要因素。
药物化学---药物的化学结构与体内代谢转化方浩第一部分概述对人体而言,绝大多数药物是一类生物异源物质(Xenobiotics)。
当药物进入机体后,一方面药物对机体产生诸多生理药理作用,即治疗疾病;另一方面,机体也对药物产生作用,即对药物的吸收、分布,排泄和代谢。
药物代谢既是药物在人体内发生的化学变化,也是人体对自身的一种保护机能。
药物代谢是指在酶的作用下将药物(通常是非极性分子)转变成极性分子,再通过人体的正常系统排出体外。
药物代谢多使有效药物转变为低效或无效的代谢物,或由无效结构转变成有效结构。
在这过程中,也有可能将药物转变成毒副作用较高的产物。
因此,研究药物在体内代谢过程中发生的化学变化,更能阐明药理作用的特点、作用时程、结构转变以及产生毒性的原因。
药物代谢在创新药物发现和临床药物合理应用中具有重要的地位。
通过对近十年来许多创新药物在临床失败的案例,科学家们发现与药物代谢有关的问题是创新药物临床研究失败的重要原因。
因此当前进行创新药物研究的过程中,应当在候选药物研究阶段就重视考察其药物代谢的相关问题,并将候选药物的代谢问题作为评判其成药性的重要研究内容。
在药理学和生物药剂学课程中,对于药物在体内发生的药物代谢转化反应和代谢产物讲述内容较少。
因此我们将在药物化学的讲述中,重点从药物代谢酶角度入手,讨论药物在体内发生的生物转化,以帮助大家更好的认识药物在体内所反应的代谢反应以及其与药物发现和临床合理应用的关系。
药物的代谢通常分为两相:即第Ⅰ相生物转化(PhaseⅠ)和第Ⅱ相生物转化(PhaseⅡ)。
第Ⅰ相主要是官能团化反应,包括对药物分子的氧化、还原、水解和羟化等,在药物分子中引入或使药物分子暴露出极性基团,如羟基、羧基、巯基和氨基等。
第Ⅱ相又称为结合反应(Conjugation),将第Ⅰ相中药物产生的极性基团与体内的内源性成分,如葡萄糖醛酸、硫酸、甘氨酸或谷胱甘肽,经共价键结合,生成极性大、易溶于水和易排出体外的结合物。
天然药物化学成分生物转化的特点,研究程序一、天然药物化学成分的定义天然药物化学成分是指从植物、动物或微生物等天然来源中提取的化学成分,具有一定的药用价值。
天然药物化学成分具有多样性和复杂性,其具体化学结构和药理作用机制常常需要通过深入研究才能揭晓。
二、天然药物化学成分的生物转化特点1.来源多样性天然药物化学成分来源于植物、动物、微生物等多种生物体,因此具有高度的多样性。
这种多样性不仅体现在化学结构上,也体现在生物合成途径、生物代谢途径等方面。
2.生物转化途径复杂天然药物化学成分通常需要通过生物转化途径才能够被生物体吸收、代谢和发挥药理作用。
由于生物转化途径的复杂性,天然药物化学成分的作用机制经常难以完全理解。
3.代谢途径多样天然药物化学成分在生物体内的代谢途径通常涉及多种酶系统、代谢产物等,其代谢途径的研究对于揭示其药理作用机制具有重要意义。
4.生物合成机制独特天然药物化学成分通常是通过生物合成途径由生物体内的代谢产物合成而来。
这一生物合成机制的独特性使得天然药物化学成分的结构和性质常常难以通过化学合成方法来模拟。
三、天然药物化学成分生物转化研究的程序1. 提取与纯化天然药物化学成分的生物转化研究通常首先需要从天然来源中提取和纯化目标化合物。
这一步骤需要综合考虑不同来源的原料特性以及提取技术的选择。
2. 结构鉴定与活性评价对于提取得到的化合物,需要进行结构鉴定和活性评价。
结构鉴定通常涉及质谱、核磁共振等技术的应用,活性评价则需要进行生物学实验和药理学研究。
3. 生物转化途径研究在确定了目标化合物的结构和药理活性后,研究人员需要进一步探索其在生物体内的生物转化途径。
这一步骤通常需要利用酶学、代谢组学等技术手段。
4. 生物合成途径解析研究人员需要通过转录组学、蛋白质组学等手段来研究天然药物化学成分在生物体内的生物合成途径,揭示其生物合成机制和调控机制。
四、天然药物化学成分生物转化研究的意义和前景天然药物化学成分的生物转化研究有着重要的科学意义和应用前景。
药物在体内发生化学结构变化的过程随着科学技术的不断进步,药物的研发和应用已经成为人们生活中不可或缺的一部分。
然而,药物究竟是如何在人体内发生作用的呢?本文将从药物在体内发生化学结构变化的过程进行深入探讨,帮助读者更好地理解药物的作用机理。
一、药物在体内的吸收过程1. 消化道吸收药物的口服给药是最常见的一种途径。
药物经过口服给药后,将在胃肠道内进行吸收。
这个过程中,药物会受到胃酸、胆汁和肠液的作用,有些药物甚至需要通过肠道壁才能被吸收到血液中。
2. 皮肤吸收有些药物可以通过皮肤被吸收,然后进入循环系统。
这种途径主要用于局部治疗,例如外用药物。
3. 静脉注射静脉注射是药物直接进入血液循环系统的途径,这种方式下药物能够迅速被吸收。
二、药物在体内的代谢过程1. 肝脏的代谢一旦药物进入血液循环系统后,大部分药物都会经过肝脏进行代谢。
肝脏中的药物代谢酶会将药物转化成代谢产物,有些药物的代谢产物具有更强的药理活性,有些则是毒性产物。
2. 细胞内代谢一些药物在体内还可能会在细胞内进行代谢。
细胞内的酶可以将药物降解成代谢产物,以便更容易被排出体外。
三、药物在体内的排泄过程1. 肾脏的排泄大部分药物会通过肾脏排泄出体外。
肾小球滤过对小分子药物的排泄起主要作用,而近曲小管和远曲小管则对药物的重吸收和排泄发挥影响。
2. 胆汁的排泄一些药物以及它们的代谢产物也会通过肝脏排泄到胆汁中,再经过肠道排泄出体外。
药物在体内发生化学结构变化的过程是一个既复杂又精密的过程。
这个过程包括药物在体内的吸收、代谢和排泄三个环节。
只有深入了解药物在体内的作用过程,才能更好地指导临床用药,增强药物治疗效果,减少不良反应的发生,从而更好地服务于人类健康事业的发展。
药物在体内发生化学结构变化的过程是一个十分复杂的系统工程。
在药物进入人体后,经历了吸收、代谢和排泄等一系列过程,才能发挥作用或被排出体外。
在这个过程中,药物的分子结构可能会发生改变,从而影响药物的药理活性和药效。
药物化学—--药物的化学结构与体内代谢转化方浩第一部分概述对人体而言,绝大多数药物是一类生物异源物质(Xenobiotics)。
当药物进入机体后,一方面药物对机体产生诸多生理药理作用,即治疗疾病;另一方面,机体也对药物产生作用,即对药物的吸收、分布,排泄和代谢.药物代谢既是药物在人体内发生的化学变化,也是人体对自身的一种保护机能。
药物代谢是指在酶的作用下将药物(通常是非极性分子)转变成极性分子,再通过人体的正常系统排出体外。
药物代谢多使有效药物转变为低效或无效的代谢物,或由无效结构转变成有效结构.在这过程中,也有可能将药物转变成毒副作用较高的产物.因此,研究药物在体内代谢过程中发生的化学变化,更能阐明药理作用的特点、作用时程、结构转变以及产生毒性的原因。
药物代谢在创新药物发现和临床药物合理应用中具有重要的地位.通过对近十年来许多创新药物在临床失败的案例,科学家们发现与药物代谢有关的问题是创新药物临床研究失败的重要原因。
因此当前进行创新药物研究的过程中,应当在候选药物研究阶段就重视考察其药物代谢的相关问题,并将候选药物的代谢问题作为评判其成药性的重要研究内容。
在药理学和生物药剂学课程中,对于药物在体内发生的药物代谢转化反应和代谢产物讲述内容较少。
因此我们将在药物化学的讲述中,重点从药物代谢酶角度入手,讨论药物在体内发生的生物转化,以帮助大家更好的认识药物在体内所反应的代谢反应以及其与药物发现和临床合理应用的关系。
药物的代谢通常分为两相:即第Ⅰ相生物转化(PhaseⅠ)和第Ⅱ相生物转化(PhaseⅡ)。
第Ⅰ相主要是官能团化反应,包括对药物分子的氧化、还原、水解和羟化等,在药物分子中引入或使药物分子暴露出极性基团,如羟基、羧基、巯基和氨基等。
第Ⅱ相又称为结合反应(Conjugation),将第Ⅰ相中药物产生的极性基团与体内的内源性成分,如葡萄糖醛酸、硫酸、甘氨酸或谷胱甘肽,经共价键结合,生成极性大、易溶于水和易排出体外的结合物.但是也有药物经第Ⅰ相反应后,无需进行第Ⅱ相的结合反应,即可排出体外。
第二部分基本概念、基本知识及重点、难点一、药物代谢的酶(Enzymes forDrug Metabolism)第Ⅰ相生物转化是官能团化反应,是在体内多种酶系的催化下,对药物分子引入新的官能团或改变原有的官能团的过程.参与药物体内生物转化的酶类主要是氧化-还原酶和水解酶。
本节主要介绍细胞色素P—450酶系、还原酶系、过氧化物酶和其它单加氧酶、水解酶。
(一)细胞色素P-450酶系CYP—450(Cytochrome P-450enzyme system,CYP—450)是一组酶的总称,由许多同功酶和亚型酶组成,是主要的药物代谢酶系,在药物和其它化学物质的代谢、去毒性中起着非常重要的作用。
CYP-450存在于肝脏及其它肝脏外组织的内质网中,是一组由铁原卟啉偶联单加氧酶(Heme—coupled monooxygenases)、需要NADPH和分子氧共同参与、主要催化药物生物转化中氧化反应(包括失去电子、脱氢反应和氧化反应)的酶系。
它主要是通过“活化”分子氧,使其中一个氧原子和有机物分子结合,同时将另一个氧原子还原成水,从而在有机药物的分子中引入氧。
CYP-450催化的反应类型有烷烃和芳香化合物的氧化反应,烯烃、多核芳烃及卤代苯的环氧化反应,仲胺、叔胺及醚的脱烷基反应,胺类化合物的脱胺反应,将胺转化为N-氧化物、羟胺及亚硝基化合物以及卤代烃的脱卤反应。
CYP-450还催化有机硫代磷酸酯的氧化裂解,氧化硫醚成亚砜等的反应(见表1)。
表1CYP-450催化的一些药物代谢的氧化反应类型底物产物CYP—450属于体内的氧化—还原酶系,除了催化上述氧化反应外,还能将含重氮和硝基的药物还原成芳香伯胺。
(二)还原酶系还原酶系主要是催化药物在体内进行还原反应(包括得到电子、加氢反应、脱氧反应)的酶系,通常是使药物结构中的羰基转变成羟基,将含氮化合物还原成胺类,便于进入第Ⅱ相的结合反应而排出体外。
参加体内生物转化还原反应的酶系主要是一些氧化-还原酶系。
-这些酶具有催化氧化反应和催化还原反应的双重功能,如CYP-450酶系除了催化药物分子在体内的氧化外,在肝脏微粒体中的一些CYP—450酶还能催化重氮化合物和硝基化合物的还原,生成伯胺。
硝基化合物的还原也经历亚硝基、羟胺等中间体过程,因此CYP—450酶系对这些基团也有还原作用。
另一个重要的酶系是醛—酮还原酶,这些酶需要NADPH或NADH作为辅酶。
醛—酮还原酶也是双功能酶,一方面催化醛、酮还原成醇,另一方面也会使醇脱氢生成醛、酮(见表2).表2 药物代谢过程中的还原反应类型底物产物在药物代谢中起作用的其它还原酶还有谷胱甘肽还原酶(Glutathione oxidoreductase)和醌还原酶。
(三)过氧化物酶和其它单加氧酶过氧化物酶属于血红素蛋白,是和CYP-450单加氧酶最为类似的一种酶.这类酶以过氧化物作为氧的来源,在酶的作用下进行电子转移,通常是对杂原子进行氧化(如N—脱烃基化反应)和1,4—二氢吡啶的芳构化.其它的过氧化酶还有前列腺素—内过氧化物合成酶、过氧化氢酶及髓过氧物酶.单加氧酶中除了CYP—450酶系外,还有黄素单加氧酶(Flavin monooxygenase,FMO)和多巴胺β—羟化酶(Dopamine β—hydroxylase)。
FMO和CYP-450酶系一起共同催化药物分子在体内的氧化,但FMO通常催化含N和S杂原子的氧化,而不发生杂原子的脱烷基化反应,如将叔胺、肼类化合物氧化成N—氧化物,仲胺氧化成羟基胺,羟胺氧化成硝基化合物,硫醇氧化成二硫醚,二硫醚氧化生成S—氧化物,硫醚氧化成亚砜和砜(见表3).表3黄素单加氧酶催化药物代谢的氧化反应底物产物(四)水解酶水解酶主要参与羧酸酯和酰胺类药物的代谢,这些非特定的水解酶大多存在于血浆、肝、肾和肠中。
因此,大部分酯和酰胺类药物在这些部位发生水解。
哺乳类动物的组织中也含有这些水解酶,使药物发生水解代谢.但是肝脏、消化道及血液具有更大的水解能力。
酯水解酶包括酯酶,胆碱酯酶及许多丝氨酸内肽酯酶。
其它如芳磺酸酯酶、芳基磷酸二酯酶、β—葡萄糖苷酸酶和环氧化物酶(Epoxide hydrolase)等和酯水解酶的作用相似。
通常酰胺类化合物比酯类化合物稳定而难水解,水解速度较慢,因此大部分酰胺类药物是以原型从尿中排出。
二、第Ⅰ相的生物转化PhaseⅠBiotransformation药物的第Ⅰ相生物转化是指体内各种酶对药物分子进行的官能团化反应,主要发生在药物分子的官能团上,或分子结构中活性较高、位阻较小的部位,包括引入新的官能团及改变原有的官能团。
本节讲授的主要内容包括氧化反应、还原反应、脱卤素反应和水解反应。
(一)氧化反应药物代谢中的氧化反应包括失去电子、氧化反应、脱氢反应等,是在CYP—450酶系、单加氧酶、过氧化酶等酶的催化下进行的反应。
我们结合有关药物在体内的生物转化,探讨一下这些氧化反应的有关规律。
1.芳环及碳-碳不饱和键的氧化(1)含芳环药物氧化代谢反应下面是双氯酚酸钠在体内的代谢转化,我们可以看到其代谢产物主要以两个芳环引入酚羟基为主。
根据有关的研究发现,含芳环药物在体内被氧化为酚羟基的原理是CYP—450酶系首先将其氧化为环氧化合物。
由于环氧化合物比较活泼,在质子的催化下会发生重排生成酚,或被环氧化物酶水解生成二羟基化合物。
芳环药物的氧化代谢以生成酚的代谢产物为主,一般遵照芳环亲电取代反应的原理,供电子取代基能使反应容易进行,生成酚羟基的位置在取代基的对位或邻位;吸电子取代基则削弱反应的进行程度,生成酚羟基的位置在取代基的间位。
如果药物分子中含有二个芳环时,一般只有一个芳环发生氧化代谢。
若二个芳环上取代基不同时,一般的是电子云较丰富的芳环易被氧化。
如抗精神病药氯丙嗪(Chlorpromazine)易氧化生成7-羟基化合物,而含氯原子的苯环则不易被氧化。
(2)含烯烃和炔烃药物的代谢由于烯烃化合物比芳香烃的π键活性较大,因此烯烃化合物也会被代谢生成环氧化合物。
这些环氧化合物比较稳定,常常可以被分离出及确定其性质。
例如抗癫痫药物卡马西平(Carbamazepine)在体内代谢生成10,11-环氧化合物,是卡马西平产生抗癫痫作用的活性成分。
该环氧化合物会经进一步代谢,被环氧化物酶水解产生卡马西平的二羟基化合物,并随尿液排出体外。
烯烃类药物经代谢生成环氧化合物后,可以被转化为二羟基化合物,或将体内生物大分子如蛋白质、核酸等烷基化而产生毒性,导致组织坏死和致癌作用。
例如黄曲霉素B1(Aflatoxin)经代谢后生成环氧化合物,该环氧化合物会进一步与DNA作用生成共价键化合物,是该化合物致癌的分子机理。
炔烃类反应活性比烯烃大,被酶催化氧化速度也比烯烃快。
根据酶进攻炔键碳原子的不同,生成的产物也不同。
若酶和氧连接在炔键的碳原子是端基碳原子,则随后发生氢原子的迁移,形成烯酮中间体,该烯酮可能被水解生成羧酸,也可能和蛋白质进行亲核性烷基化反应;若酶和氧连接在非端基炔键碳原子上,则炔烃化合物和酶中卟啉上的吡咯氮原子发生N-烷基化反应.这种反应使酶不可逆的去活化。
如甾体化合物炔雌醇就会发生这类酶去活化反应。
2.饱和碳原子的氧化(1)含脂环和非脂环结构药物的氧化烷烃类药物经CYP—450酶系氧化后先生成含自由基的中间体,再经转化生成羟基化合物,酶在催化时具有区域选择性,这种选择性取决于被氧化碳原子附近的取代情况。
生成的羟基化合物有可能一步脱水生成烯烃化合物。
长碳链的烷烃常在碳链末端甲基上氧化生成羟基,羟基化合物可被脱氢酶进一步氧化生成羧基称为ω—氧化;氧化还会发生在碳链末端倒数第二位碳原子上,称ω—1氧化。
烷烃化合物除了ω-和ω-1氧化外,还会在有支链的碳康子上发生氧化,主要生成羟基化合物。
如布洛芬(Ibuprofen)的氧化,其氧化主要发生在异丙基侧链上,有的氧化发生生末端甲基(ω—氧化),有的代谢产物属于ω—1氧化。
部分ω—氧化产物进一步氧化为羧酸.饱和的脂环容易发生氧化生成羟基化合物,如四氢萘的氧化主要是发生在脂肪环上,而不是在芳香环上.取代的环己基药物在氧化代谢时,一般是环己基的C3或C4上氧化生成羟基化合物,并有顺、反式立体异构体.如降血糖格列本脲(Glibenclamide),其反式-4羟基代谢产物是主要代谢产物,顺式-3羟基代谢产物仅占15% 。
(2)和sp2碳原子相邻碳原子的氧化当烷基碳原子和sp2碳原子相邻时,如羰基的 -碳原子、芳环的苄位碳原子及双键的α碳原子,由于受到sp2碳原子的作用使其反应活性增强,在CYP-450酶系的催化下,易发生氧化生成羟基化合物。