液体精馏
- 格式:pptx
- 大小:3.96 MB
- 文档页数:157


精馏工艺流程图
精馏工艺是一种将混合液体分离成纯液体或液体混合物的方法。
其基本原理是利用了不同组分的汽化温度不同的特性,通过加热使混合液体汽化,在冷凝器中冷凝并收集纯液体或液体混合物。
以下是精馏工艺的基本流程图:
1. 供料系统:混合液体通过供料系统输入精馏塔。
供料系统包括自动计量泵、进料阀门等设备,用于精确控制供给速率和流量。
2. 蒸汽生成系统:精馏塔的底部装有加热器,通过加热器提供热量,将混合液体加热至汽化温度。
加热器采用蒸汽加热或电加热,具有快速加热、能耗低的特点。
3. 蒸馏系统:混合液体在加热器中被加热,部分组分开始汽化。
汽化的组分随着蒸汽上升,进入精馏塔顶部。
精馏塔内装有多个塔板,塔板上通常有填料或塔盘,用于增加液体和蒸汽的接触面积。
在各个塔板上,汽化的组分与未汽化的组分发生传质和传热过程。
4. 冷凝系统:精馏塔顶部通过冷凝器进行冷却,将部分蒸汽冷凝成液体。
冷凝器是一个换热器,利用冷却介质或冷水将蒸汽冷却,使其变成液体。
5. 分离系统:冷凝后的液体通过分流器分离成不同组分的产物。
分流器具有多个出口,分别收集纯液体或液体混合物。
6. 冷却系统:分离后的产物通过冷却器进行冷却,使其达到所需的温度。
冷却器通常采用冷却介质或冷水进行冷却。
7. 收集系统:经过冷却后的产物被收集到不同容器中,用于进一步的处理或包装。
以上就是精馏工艺的基本流程图。
根据实际需要,可以根据不同的物料和要求进行调整和改进。
此外,精馏工艺还可以与其他工艺结合使用,如萃取、蒸汽压缩等,以获得更高的分离效果和节能效果。
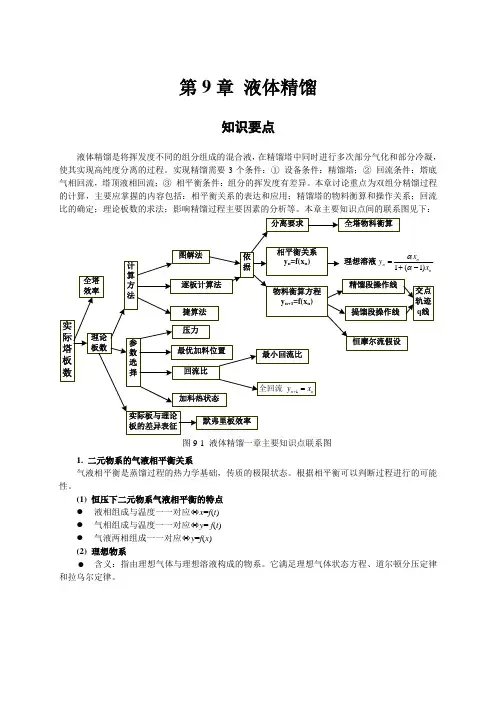
第9章液体精馏知识要点液体精馏是将挥发度不同的组分组成的混合液,在精馏塔中同时进行多次部分气化和部分冷凝,使其实现高纯度分离的过程。
实现精馏需要3个条件:①设备条件:精馏塔;②回流条件:塔底气相回流,塔顶液相回流;③相平衡条件:组分的挥发度有差异。
本章讨论重点为双组分精馏过程的计算,主要应掌握的内容包括:相平衡关系的表达和应用;精馏塔的物料衡算和操作关系;回流比的确定;理论板数的求法;影响精馏过程主要因素的分析等。
本章主要知识点间的联系图见下:图9-1 液体精馏一章主要知识点联系图1. 二元物系的气液相平衡关系气液相平衡是蒸馏过程的热力学基础,传质的极限状态。
根据相平衡可以判断过程进行的可能性。
(1) 恒压下二元物系气液相平衡的特点●液相组成与温度一一对应⇔x=f(t)●气相组成与温度一一对应⇔y= f(t)●气液两相组成一一对应⇔y=f(x)(2) 理想物系含义:指由理想气体与理想溶液构成的物系。
它满足理想气体状态方程、道尔顿分压定律和拉乌尔定律。
拉乌尔定律相对挥发度/1/1A A A B B B p x y xp x y xναν-===⋅- (9-1)11y xy xα-=⋅- (气相服从道尔顿分压定律) 相对挥发度α愈是大于1 ,则y 愈是大于x ,物系愈容易分离。
● 泡点方程x -toB ooA Bp p x p p -=- (9-2) ● 露点方程y -to A BA A Bp p p y p p p -=⋅- (9-3) ● 相平衡方程y-x()11xy xαα=+- (9-4)● t -y (x )相图两端点A 与B :端点A 代表纯易挥发组分A(x =1),端点B 代表纯难挥发组分B(x =0)。
两线:t -x 线为泡点线,泡点与组成x 有关;t-y 线为露点线,露点与组成y 有关。
3区:t -x 线以下为过冷液体区;t-y 线以上为过热蒸汽区;在t-x 与t -y 线之间的区域为气液共存区,只有体系落在气液共存区才能实现一定程度的分离。


精馏的操作技巧精馏是一种分离液体混合物中各组分的常用方法,主要应用于化工、石油、制药等领域。
在进行精馏操作时,需要遵循一系列的操作技巧,以提高分离效率和产品纯度。
下面是一些关键的精馏操作技巧:1. 选择合适的精馏塔:根据混合物的特性,选择合适的精馏塔类型,例如平板塔、填料塔或结构塔。
不同类型的塔适用于不同的操作条件和分离效果。
选用合适的精馏塔能够提高分离效率。
2. 控制进料速率:控制进料速率是精馏操作中重要的一步,过高或过低的进料速率都会对分离效果产生负面影响。
应根据具体情况合理调节进料速率,以保证塔内的气液平衡。
3. 维持适当的冷凝温度:冷凝器的冷凝温度是精馏操作中的关键因素之一。
过低的冷凝温度会导致过度凝结和附壁现象,影响精馏塔内的传质和传热效果。
而过高的冷凝温度则会降低塔内温度,使分离效果下降。
应根据混合物的沸点范围选择合适的冷凝温度。
4. 调整塔内压力:塔内压力对精馏操作具有重要影响。
较低的塔内压力会使焓泄漏减少,增加分离效率。
但过高的塔内压力会增加能耗和操作难度。
应根据分离要求和设备性能优化调整塔内压力。
5. 控制塔底液位:塔底液位的控制对精馏操作至关重要。
过高的液位会导致部分液体通过不规则出口溢出,影响分离效果。
过低的液位会使精馏液下降,减少分离效果。
应根据实际情况合理控制塔底液位。
6. 确保塔内充分传质:充分传质是精馏操作中的关键步骤。
通过增加传质的有效面积和传质速度,可以提高分离效果。
合理选择塔内的填料材料、塔板孔径和塔板间距等参数,以增加传质效果。
7. 反应塔与精馏塔的选择:在某些情况下,可能需要在反应过程中进行精馏操作。
这时,应根据反应塔和精馏塔的特性选择合适的操作方式和顺序。
合理的反应塔与精馏塔的选择可以提高反应效率和产品纯度。
8. 缺陷修复:发现塔内存在缺陷时,如裂缝、漏气等,应及时进行修复。
塔内缺陷会影响操作的稳定性和产品纯度,需要及时处理。
9. 定期检查和维护:精馏操作之后,需要对设备进行定期检查和维护。

精馏和蒸馏的区别在于溶液中还是液体
精馏和蒸馏是在化学实验室中常用的分离技术,它们都是通过液体的沸点差异
来实现对混合物的分离。
尽管它们都涉及液体蒸发和重新凝结的过程,但二者在操作原理和应用范围上存在一些显著的差异。
精馏的基本原理
精馏是一种将混合液体分离的技术,利用不同成分的沸点差异来实现。
在精馏中,混合物首先被加热至沸点,然后蒸气通过冷凝器凝结成液体。
这种方法非常适用于分离液态混合物,特别是混合物的成分具有明显的沸点差异时。
蒸馏的基本原理
蒸馏是一种将液体与溶质分离的技术,通常应用于从溶液中提取纯净物质。
在
蒸馏中,混合物中所含的溶质在加热至沸点时先蒸发成气体,然后通过冷凝器重新凝结成液态。
这种方法适用于分离溶液中的溶质,而不是液态混合物。
区别
1.适用对象不同:精馏通常用于分离液态混合物,而蒸馏则更适用于
分离液体和溶质。
2.操作原理不同:精馏是根据沸点差异来分离混合物中的不同成分,
而蒸馏是通过蒸发和冷凝将液体和溶质分离。
3.应用领域不同:精馏常用于酒精、石油等液态混合物的分离,而蒸
馏则广泛应用于从水溶液中提取纯净水等实际应用场景。
结论
总的来说,精馏和蒸馏虽然都是利用液体的沸点差异进行分离,但在适用对象、操作原理和应用领域上存在明显的区别。
熟练掌握这两种技术的原理和操作方法,对于化学实验室的分离工作将会大有裨益。

精馏的工艺
精馏是一种分离混合物组分的工艺,通常用于分离液体混合物中的不同挥发性组分。
它基于不同组分的沸点差异来进行分离,通过加热混合物,使其沸点高的组分蒸发,然后将蒸汽冷凝收集,得到纯净的组分。
精馏过程一般包括以下几个步骤:
1. 加热:将混合物加热到使其中一个或多个组分蒸发的温度。
温度通常由系统达到平衡时所需的沸点决定。
2. 蒸发:在加热中,挥发性组分开始从液体相转变为气体相,并形成蒸汽。
3. 冷凝:将蒸汽通过冷凝器冷却,使其重新变成液体。
冷凝器通常是一个管道或器皿,用冷却剂如水或空气传热来冷凝蒸汽。
4. 分离:冷凝后的液体被收集,其中包含主要是挥发性组分的纯净物质。
5. 循环:在一些工艺中,收集的液体可能被再度加热,再次蒸发,以进一步提高分离效果。
精馏的效果受到多个因素的影响,如温度、压力、混合物的成分和性质等。
根据不同的应用和要求,可能需要采用不同的精馏工艺,如简单蒸馏、连续蒸馏、真
空蒸馏等。


精馏和蒸馏的区别在于回流液体
精馏和蒸馏是常见的分离和提纯混合物的方法,它们在化学工业和实验室中被
广泛应用。
尽管它们都涉及液体的汽化和凝结过程,但两者之间有着明显的区别,其中一个关键区别就在于回流液体的利用方式。
蒸馏的基本原理
蒸馏是利用液体的不同沸点来分离混合物的过程。
在蒸馏过程中,混合物被加
热至其中组分的沸点,产生蒸气,然后通过冷凝器使蒸气重新凝结成液体。
这样,通过蒸馏就能够将混合物中的不同成分分离开来。
精馏的基本原理
精馏是一种更加高效的蒸馏方法,通过利用回流液体来增加馏分的纯度。
在精
馏过程中,液体首先被加热至其中一种组分的沸点,产生蒸气。
然后,一部分蒸气被冷凝器冷却并回流到蒸馏瓶中。
这样,回流液体可以继续蒸发和冷凝过程,从而提高纯度。
区别分析
1.回流液体利用方式不同:蒸馏中,液体直接进入冷凝器,而精馏中,
回流液体经过冷凝器后重新返回蒸馏瓶。
2.分离效果不同:精馏由于回流液体的再蒸发和冷凝,能够提高产物
的纯度,分离效果更好。
3.能耗不同:精馏相较于蒸馏,需要更多的能量来保证回流液体的再
蒸发。
总的来说,精馏相对于蒸馏来说更适合需要更高纯度产物的场合,而蒸馏则被
广泛应用在一般的分离和提纯过程中。
以上就是精馏和蒸馏的区别,希望通过本文的介绍,能够更好地理解这两种常
见的分离方法。

简述精馏的流程
精馏的流程主要包括原料准备、加热蒸馏、冷凝收集和分馏四个步骤。
首先是原料准备。
精馏过程中需要准备好待分馏的混合物,通常是液态物质。
这些混合物可以是两种或两种以上的液体,它们具有不同的沸点。
在精馏过程中,通过控制温度,将这些液体分离出来。
接下来是加热蒸馏。
待分馏的混合物被加热至其沸点以上,使其部分或全部蒸发成气体。
这些气体进入精馏设备的上部,经过冷却后凝结成液体,并滴入收集瓶中。
然后是冷凝收集。
在精馏设备中设有冷却系统,将上部蒸发的气体迅速冷却,使其凝结成液体。
这样的液体便是所需的产品。
通过调节冷却系统的温度和速度,可以控制不同组分的凝结速度,实现不同组分的分离。
最后是分馏。
通过调节精馏设备的温度和压力,可以控制不同组分在不同温度下的沸点,从而实现不同组分的分离。
较低沸点的组分首先蒸发并凝结,被收集;而较高沸点的组分则在较高温度下蒸发,较低温度下凝结,也被分离出来。
精馏是一种通过加热蒸馏、冷凝收集和分馏等步骤将混合物中不同组分分离的方法。
通过控制温度和压力等参数,可以实现对不同组分的有效分离,得到纯净的产品。
精馏在化工、制药等领域有着广
泛的应用,是一种重要的分离技术。
精馏的原理及应用场景1. 精馏的定义精馏是一种通过将混合物加热并使其蒸发,然后再以不同的速率冷却和收集蒸汽以分离不同成分的过程。
这种分离是基于不同组分的蒸汽压力差异以及可能的反应性差异。
2. 精馏的原理精馏是基于液体混合物中不同成分的沸点差异而进行的。
在进行精馏时,混合物被加热到使其沸腾,产生蒸汽。
然后,该蒸汽被冷凝,并通过不同的收集器进行收集。
不同成分的沸点不同,因此它们会在不同温度下转化为蒸汽。
通过控制温度和冷凝速度,可以将混合物中的不同成分分离开来。
3. 精馏的过程精馏主要包括以下几个步骤:•加热混合液体:通过加热混合液体,使其中的成分开始沸腾并转化为蒸汽。
•冷凝蒸汽:将产生的蒸汽传导到冷凝器,使其冷却并转化为液体。
•收集液体:将冷凝的液体收集到不同的收集器中,以获取不同成分的纯净产品。
•重复过程:如果需要进一步提纯,可以重复以上步骤多次。
4. 精馏的应用场景精馏在许多领域中都有广泛的应用,下面列举了一些常见的应用场景:•石油提炼:石油中含有多种不同组分,通过精馏可以将其分离成不同的燃料和润滑剂。
•酒精酿造:酒精酿造过程中,通过精馏可以提取出所需的酒精成分。
•化学制药:在药物生产中,精馏常常用于纯化药物成分。
•食品加工:对于某些食品原料,如酱油、醋等,精馏可以用于去除杂质,提取纯度较高的成分。
•海水淡化:精馏是海水淡化过程中的一个重要步骤,通过精馏可以将海水中的盐分去除,得到淡水。
5. 精馏的优缺点精馏具有以下优点:•可以实现高效、精确的分离。
•适用于各种不同成分的混合物。
•可以提供高纯度的产品。
然而,精馏也存在一些局限性:•需要消耗大量能量进行加热和冷却。
•对于某些具有相似沸点的成分,精馏效果可能不理想。
•部分混合物可能具有反应性,导致破坏或降低纯度。
综上所述,精馏是一种有效的分离技术,在许多领域中有着广泛的应用。
通过控制温度和收集过程,可以实现不同成分的分离和提纯。
然而,使用精馏也需要考虑能源消耗和可能的反应性问题。
精馏和蒸馏区别
精馏和蒸馏是常见的分离纯净液体混合物的方法,它们在化工、制药、酿酒等领域有着广泛的应用。
虽然它们都是利用液体混合物中成分的沸点差异来实现分离的,但在操作原理以及应用场景上有着一些明显的区别。
精馏的原理和过程
•精馏是一种逐步加热液体混合物,并利用各成分的沸点差异来分离的方法。
•在精馏过程中,混合物首先被加热至液体最易挥发的成分开始蒸发,然后通过冷凝器将蒸汽冷凝成液体,得到所需的纯净成分。
•精馏通常用于分离液体混合物中沸点差异较小的成分,例如水和酒精的分离。
蒸馏的原理和过程
•蒸馏是将液体混合物加热至混合物的成分逐个蒸发,并通过再冷凝的方法分离。
•蒸馏是将整个混合物加热至沸点,使液体转化为蒸气,然后通过冷凝器将蒸汽冷凝成液体,得到所需的纯净成分。
•蒸馏适用于分离沸点差异较大的液体混合物,例如水和盐的分离。
精馏和蒸馏的区别
1.操作原理:精馏是逐步加热液体混合物,分别蒸发和冷凝各成分;而
蒸馏是整体加热混合物至沸点,再蒸发和冷凝。
2.应用场景:精馏用于分离沸点差异较小的成分,蒸馏适用于沸点差异
较大的成分。
3.效果:精馏相对耗时但能更精确地分离,蒸馏效率较高但不能精确分
离。
综上所述,精馏和蒸馏是利用液体混合物中成分沸点差异来实现分离的常见方法,它们在操作原理和应用场景上有一些明显的区别。
了解这些区别可以根据需要选择合适的方法进行分离纯净液体混合物。
精馏与蒸馏的区别和联系
在化学工业中,精馏和蒸馏是两种常用的分离技术,它们被广泛应用于提纯液体混合物。
尽管这两种技术在表面上看起来相似,但它们在原理和应用上有着明显的区别和联系。
精馏的定义和原理
精馏是一种通过液体混合物的沸点差异来实现分离的过程。
在精馏过程中,液体混合物被加热至其中一个组分的沸点,该组分转变为气态,然后被重新冷凝,从而分离出纯净的组分。
精馏通常用于分离液态混合物中的两种或多种不同沸点的成分。
蒸馏的定义和原理
蒸馏是一种利用液体蒸汽与不同温度下的沸点来将液体混合物分离的技术。
在蒸馏过程中,混合物被加热至使其中一个或多个组分转化为气态,然后通过冷凝将其收集,从而实现分离。
蒸馏广泛应用于提纯液体混合物、分离溶剂和水的混合物等。
精馏与蒸馏的联系
尽管精馏和蒸馏在实践中用于不同的目的,但它们都利用了物质的沸点差异来实现分离。
两种过程都包含加热和冷却的步骤,以实现液体混合物中组分的分离。
在实际操作中,有时会将精馏和蒸馏结合使用,以达到更高的纯度要求。
总之,精馏和蒸馏是两种常见的分离技术,它们在原理和应用上有着一定的区别,但又有着联系。
通过深入理解这两种技术的原理和特点,我们可以更好地应用它们在化学工程领域中的实践。
第9章 液体精馏一、填空1精馏过程是利用 部分冷凝 和 部分汽化 的原理而进行的。
精馏设计中,回流比越 大 ,所需理论板越少,操作能耗 增加 ,随着回流比的逐渐增大,操作费和设备费的总和将呈现 先降后升 的变化过程。
2精馏设计中,当回流比增大时所需理论板数 减小 (增大、减小),同时蒸馏釜中所需加热蒸汽消耗量 增大 (增大、减小),塔顶冷凝器中冷却介质消耗量 减小 (增大、减小),所需塔径 增大 (增大、减小)。
3分离任务要求一定,当回流比一定时,在5种进料状况中, 冷液体 进料的q 值最大,提馏段操作线与平衡线之间的距离 最远 , 分离所需的总理论板数 最少 。
4相对挥发度α=1,表示不能用 普通精馏分离 分离,但能用 萃取精馏或恒沸精馏分离 分离。
5某二元混合物,进料量为100kmol/h ,x F =0.6,要求得到塔顶x D 不小于0.9,则塔顶最大产量为 66.7 kmol/h 。
6精馏操作的依据是 混合液中各组分的挥发度差异 ,实现精馏操作的必要条件包括 塔顶液相回流 和 塔底上升蒸气 。
7负荷性能图有 五 条线,分别是 液相上限线 、 液相上限线 、 雾沫夹带线 、 漏液线 和 液泛线 。
8写出相对挥发度的几种表达式 =B A v v /=BB A A x p x p //=BA B A x x y y //=oB o A p p /。
二、选择1 已知q=1.1,则加料中液体量与总加料量之比为 C 。
A 1.1:1B 1:1.1C 1:1D 0.1:1 2 精馏中引入回流,下降的液相与上升的汽相发生传质使上升的汽相易挥发组分浓度提高,最恰当的说法是 D 。
A 液相中易挥发组分进入汽相; B 汽相中难挥发组分进入液相;C 液相中易挥发组分和难挥发组分同时进入汽相,但其中易挥发组分较多;D 液相中易挥发组分进入汽相和汽相中难挥发组分进入液相必定同时发生。
3 某二元混合物,其中A为易挥发组分,液相组成x A=0.6,相应的泡点为t1,与之相平衡的汽相组成y A=0.7,相应的露点为t2,则⎽⎽⎽A⎽⎽⎽A t1=t2B t1<t2C t1>t2D 不确定4某二元混合物,进料量为100kmol/h,x F=0.6,要求得到塔顶x D不小于0.9,则塔顶最大产量为⎽⎽⎽B⎽⎽⎽。
液体精馏学习要点一、描述精馏过程的基本关系(一)气液平衡关系溶液的气液平衡关系是蒸馏过程的热力学基础,了解气液平衡是理解和掌握蒸馏过程的基本条件1、气液平衡的作用(1)选择分离方法依据物系的气液平衡关系,对特定的分离任务,可确定或选择分离方法。
例如对相对挥发度接近1的物系,宜采用特殊精馏或萃取等分离操作(2)在相图(t-x-y)上说明蒸馏原理即采用多次部分汽化和部分冷凝的操作,可使物系得到所需要的高纯度分离。
相对挥发度越大,相图(x-y)中平衡曲线偏离对角线越远,分离越容易。
(3)气液平衡方程是精馏过程的特征方程,即是计算理论板数的基本方程之一(4)利用气液平衡,可分析,判断精馏操作中的实际问题. 例如在精馏塔中, 恒压下操作, 温度和组成间具有对应关系,因此可利用易于测量的温度来判断难于测量的浓度.在实际生产中,时常在精馏塔的适当部位(通常称为灵敏板)上安装温度计,用它来控制,调节整个精馏过程. 又如在真空精馏中,如温度出现异常现象,则应考虑系统的气密问题等.2. 气液平衡的表达方式在精馏过程中,气液平衡可用相图书馆和气液平衡方程表示.(1)t – x – y图和x—y 图相图中t 代表温度(C) ,x 和y 分别代表液,气相中易挥发组分的摩尔分率.在利用相图时应注意以下几点:①精馏过程的分析多利用 t – x – y 图,过程计算多利用x —y.②了解沸点,泡点和露点的概念. 对同一组成下,露点总是高于泡点.对理论板而言, 离开该板的气液两相温度相等,即露点等于泡点,但两相组成不等,而呈平衡关系。
③液化率或汽化率,可在相图上用杠杆规则求得。
部分汽化和部分冷凝是精馏的基础。
④恒压下不同物系具有不同的x —y 曲线。
当平衡曲线偏离对解线愈远时,表示传质推动力愈大,该物系愈易分离。
对于具有恒沸点的非理想溶液,在恒沸点处y=x ,因此不能用普通精馏方法分离该混合液。
⑤同一物系下,不同压强的x —y 曲线也不相同,一般在低压力下平衡曲线偏离对角线愈远,即愈易分离,可见低压操作有利于精馏分离。