高三化学第七章专题十四烃——甲烷、乙烯、苯乙烯和苯的主要性质和用途
- 格式:ppt
- 大小:774.00 KB
- 文档页数:33
![[最新]高考化学一轮讲义:甲烷乙烯苯煤和石油(含解析)](https://uimg.taocdn.com/c89f534f3968011ca200912e.webp)
最新教学资料·高考化学第一节甲烷__乙烯__苯__煤和石油明考纲要求理主干脉络1.了解有机化合物中碳的成键特征及同分异构现象。
2.了解甲烷、乙烯、苯等有机化合物的主要性质。
3.了解煤、石油、天然气综合利用的意义。
常见烃的结构与性质1.甲烷、乙烯、苯的组成与结构 甲烷 乙烯 苯 分子式 CH 4 C 2H 4 C 6H 6 空间构型正四面体平面形 平面正六边形结构特点 全部是单键,属于饱和烃含碳碳双键,属于不饱和烃碳碳键介于碳碳单键和碳碳双键之间的独特的键2.甲烷、乙烯、苯的化学性质 (1)甲烷。
①稳定性:与强酸、强碱和强氧化剂等一般不发生化学反应。
②燃烧反应:CH 4+2O 2――→点燃CO 2+2H 2O③取代反应:在光照条件下与Cl 2生成一氯甲烷的化学方程式:CH 4+Cl 2――→光照CH 3Cl +HCl ,进一步取代又生成了二氯甲烷、三氯甲烷和四氯化碳。
(2)乙烯。
H 2、H 2O 、HCl 等 ①燃烧反应:反应:C 2H 4+3O 2――→点燃2CO 2+2H 2O , 现象:火焰明亮且伴有黑烟。
②氧化反应:通入酸性KMnO 4溶液中,现象为溶液紫红色褪去。
③加成反应:通入溴的四氯化碳溶液中,反应:CH 2=== CH 2+Br 2―→CH 2BrCH 2Br , 现象:溶液颜色褪去。
与H 2:CH 2=== CH 2+H 2――→催化剂△CH 3CH 3。
与HCl :CH 2=== CH 2+HCl ―→CH 3CH 2Cl 。
与H 2O :CH 2=== CH 2+H 2O ――→一定条件CH 3CH 2OH 。
④加聚反应:n CH 2=== CH 2――→引发剂CH 2—CH 2。
(3)苯。
①稳定性:不能与酸性KMnO 4溶液反应,也不与溴水(或溴的四氯化碳溶液)反应。
②取代反应:a .卤代反应:苯与液溴发生溴代反应的化学方程式+Br 2――→FeBr 3Br +HBr 。

教师辅导讲义.物理性质:无色、无味的气体,不溶于水,比空气轻,是天然气、沼气的主要成分。
.定义:烃的分子里碳原子间都以单键互相连接成链状,碳原子的其余的价键全部跟氢原子结合,达到饱和状态。
乙烯的产量是用来衡量一个国家石油化工水平的重要标志。
用于植物生长调节剂和水果的催熟剂、化工原料。
苯是无色有特殊气味的液体,熔点5.5 ℃,沸点80.1 ℃,易挥发,不溶于水,密度比水小,易溶于酒精等有机溶剂。
反应物:苯和液溴(不能用溴水)反应条件:催化剂(Fe或FeBr3)。
溴苯的制取甲烷型:正四面体个原子中最多有3个原子共平面。
(2)乙烯型:平面结构位于乙烯上的6个原子共平面。
(3)苯型:平面结构⎩⎪⎨⎪⎧位于苯环上的12个原子共平面位于对角线位置上的4个原子共直线 .单键可以旋转,双键不能旋转下列关于有机化合物的说法中,正确的是典型例题③下列关于结构简式为的烃的说法中正确的是,一个—Cl,它的可能结构有四种。
请写出这四种可能的结构简式:.某单烯烃经氢化后得到的饱和烃是,该烯烃可能有的结构是2发生加成反应.该有机种得到粗溴苯后,要用如下操作精制:①蒸馏;C.④②③①⑤D.②④①⑤③乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是反应。
在一定的条件下,乙烯还能发生5.6 L的质量为10.5 g,10.5 g该烃完全燃烧时生成.实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。
有人设计下列实验以确认上述________________________________。
确证含11。

专题9.1 甲烷、乙烯、苯的性质1.了解有机化合物中碳的成键特征。
2.了解甲烷、乙烯、苯等有机化合物的主要性质。
3.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
热点题型一有机物的组成和结构例1、下列化学用语表示正确的是( )①甲基的电子式:②乙烯的结构简式:CH2CH2③蔗糖的分子式:C12H22O11④苯分子的比例模型:A.①②③ B.③④ C.②③④ D.④【答案】B【解析】解答本题的关键是掌握电子式的书写、结构简式的表示形式。
①中甲基的电子式应为,②中乙烯的结构简式为CH2===CH2。
【提分秘籍】1.甲烷、乙烯、苯的空间构型分析结构式空间构型示意图分析甲烷正四面体结构4个C—H键不在同一平面上,5个原子中最多有3个原子共平面乙烯平面结构六个原子均在同一平面上苯平面正六边形结构六个碳原子和六个氢原子共平面2.有机化合物分子空间构型的判断方法母体模型法:以简单分子作母体模型,以母体模型为基准进行判断。
需要掌握烃类中甲烷、乙烯、苯三种分子的空间构型,以其为母体模型并将其从结构上衍变至复杂有机物中,便能准确判断原子是否共线、共面。
(1)甲烷型当甲烷分子中某氢原子被其他原子或原子团取代时,该代替原子的共面问题,可将它看作是原来氢原子位置。
如甲烷中的一个氢原子换为甲基,则变为乙烷,如图1所示:说明:C—C单键可以自由转动,同样这些原子不能共面。
结论:凡是碳原子以单键形式存在,其所连四个碳原子不能共面。
引申:凡是碳原子与4个原子形成4个共价键时,空间结构都是四面体结构。
(2)乙烯型若将其中的氢原子换成氯原子,其与所有碳、氢原子共面。
若将一个氢原子换成甲基,即为丙烯,则如图2;将两个氢原子换成甲基则为2丁烯,如图3:说明:实线框内所有原子共面,由于C—C单键转动,实线框外的氢原子有一个可能转到纸面与框内所有原子共面。
结论:凡与C===C直接相连的原子连同自身两个碳原子共面。
引申:凡是位于乙烯结构上的六个原子共平面。

第一节甲烷、烷烃【学习目标】1、初步认识有机化合物种类繁多的原因;2、掌握甲烷的结构特点、性质和用途,理解取代反应的本质;3、掌握烷烃的特征、性质和通式;4、了解同系物、同分异构现象、同分异构体等概念,并掌握烷烃同分异构体的书写。
【要点梳理】要点一、有机物1、有机物的定义含碳元素的化合物叫有机化合物,简称有机物。
要点诠释:①个别含碳的化合物如CO、CO2及碳酸和碳酸盐等结构与性质跟无机物相似,故仍属无机物。
②有机物一定是含碳元素的化合物。
③有机物除含有氢、氧元素外,还含有氮、硫、卤素、磷等。
有机物与无机物的区别见下表所示性质和反应有机物无机物溶解性多数不溶于水,易溶于有机溶剂大多数溶于水,而不溶于有机溶剂耐热性多数不耐热,熔点较低,一般在400℃以下多数耐热,难熔化,熔点一般比较高可燃性多数可以燃烧多数不能燃烧电离性多数是非电解质多数是电解质2、有机物种类繁多的主要原因:①碳原子的结构特征是最外层有4个电子,常常以共价键与碳原子或别的原子结合;②碳碳间除能形成单键外,还能形成双键和三键,并且能形成长的碳链或碳环,;③有机物普遍存在同分异构现象。
3、烃的定义仅由碳和氢两种元素组成的一类有机物称为烃,也叫碳氢化合物。
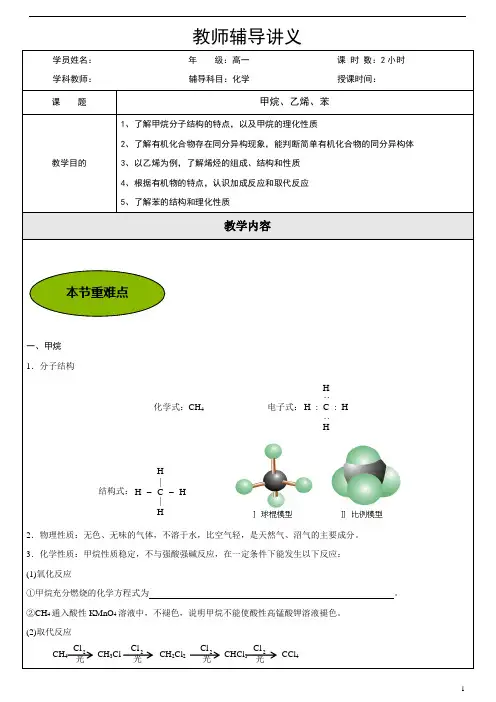
要点二、甲烷1、分子结构在甲烷分子里,1个碳原子与4个氢原子形成4个C—H共价键。
甲烷分子是正四面体形,C原子居于正四面体的中心,4个H原子位于4个顶点,4个C—H键的键长、键能相等,键角均为109°28′。
①分子式:CH4②电子式:③结构式:2、物理性质甲烷是无色无味的气体,标准状况下的密度为0.717g/L ,极难溶于水。
3、化学性质(1)稳定性:通常情况下,甲烷与强酸、强碱、强氧化剂一般都不发生反应,也不能使酸性KMnO 4溶液和溴水褪色。
但在特定的条件下,也会发生某些反应。
(2)取代反应:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫取代反应。
要点诠释:①反应需在光照条件下进行,参加反应的物质必须是氯气不能是氯水。
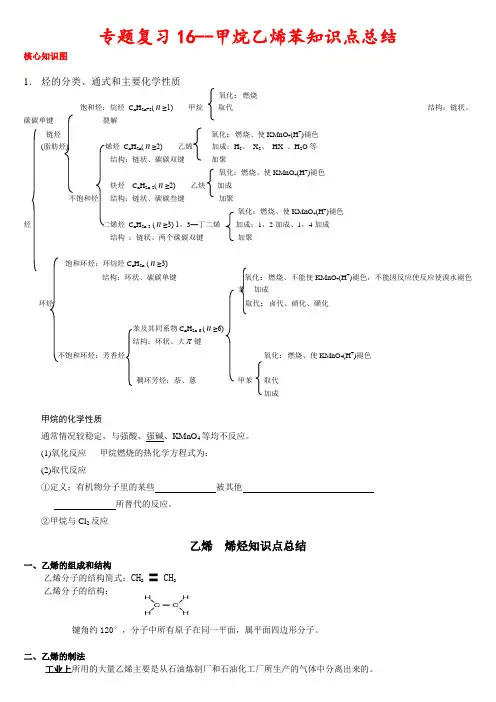
专题复习16--甲烷乙烯苯知识点总结核心知识图1.烃的分类、通式和主要化学性质氧化:燃烧饱和烃:烷烃C n H2n+2(n≥1) 甲烷取代结构:链状、碳碳单键裂解链烃氧化:燃烧、使KMnO4(H+)褪色(脂肪烃) 烯烃C n H2n(n≥2) 乙烯加成:H2、X2、HX 、H2O等结构:链状、碳碳双键加聚氧化:燃烧、使KMnO4(H+)褪色炔烃C n H2n-2(n≥2) 乙炔加成不饱和烃结构:链状、碳碳叁键加聚氧化:燃烧、使KMnO4(H+)褪色烃二烯烃C n H2n-2 (n≥3) 1,3—丁二烯加成:1,2加成、1,4加成结构:链状、两个碳碳双键加聚饱和环烃:环烷烃C n H2n (n≥3)结构:环状、碳碳单键氧化:燃烧、不能使KMnO4(H+)褪色,不能因反应使反应使溴水褪色苯加成环烃取代:卤代、硝化、磺化苯及其同系物C n H2n-6 (n≥6)结构:环状、大 键不饱和环烃:芳香烃氧化:燃烧、使KMnO4(H+)褪色稠环芳烃:萘、蒽甲苯取代加成甲烷的化学性质通常情况较稳定,与强酸、强碱、KMnO4等均不反应。
(1)氧化反应甲烷燃烧的热化学方程式为:(2)取代反应①定义:有机物分子里的某些被其他所替代的反应。
②甲烷与Cl2反应乙烯烯烃知识点总结一、乙烯的组成和结构乙烯分子的结构简式:CH2〓 CH2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。


知识点梳理:甲烷、乙烯、乙炔、烷烃、烯烃、炔烃(记忆,回来检测)一、甲烷1、几种表达方式2、物理性质_______ 色、______ 味的气体,密度比空气 __________ ,_________ 溶于水3、化学性质(写出下列反应方程式并在括号内注明反应类型)(1 ) CH 4 + O 2 T ____________________________________________________________________ ( )甲烷燃烧现象: ________________________________________________________甲烷通入到酸性高锰酸钾溶液或溴水(溴的四氯化碳溶液) ______ (能或不能)使之褪色,一般遇强酸强碱 __________ (能或不能)反应。
(2) CH4 + Cl 2 T ___________________________________________________________________________ ( )三、乙烯、乙炔1、几种表达方式注:C=C的键能和键长______________________ (填等于或不等于)C-C的两倍,说明C=C双键中有一个键容易2、乙烯的物理性质:常温下为_______ 色、_________ 味的气体,比空气_______________ ,________ 溶于水。
3、乙烯的化学性质:(写出下列反应方程式并在括号内注明反应类型)⑴、燃烧反应:_________________________________________________________________________________________ ()现象: _____________________________________________________ (能或不能)使酸性高锰酸钾溶液褪色(2)将乙烯气体通入溴水或溴的CC14溶液中,可以见到溴的红棕色_______________________写出反应方程式_________________________________________________________________________ ()CH2=CH 2 + H2 TCH2=CH 2 + HX TCH2=CH 2 + H2O T(3)乙烯制聚乙烯的反应_____________________________________________________________________()单体: ___________________ 链节:_________________________ 聚合度: __________________________4、乙烯的用途(1 )有机化工原料(2 )植物生长_______________思考:1、鉴别甲烷和乙烯的试剂有_____________________________________________________除去甲烷中乙烯的试剂为__________________________________________________2、要获得CH3CH2CI有两种方法,方法一:CH3CH3和CI2取代,方法二:CH2=CH2和HCI加成,应选 _______________________________________5、乙炔的物理性质_____ 色、________ 味的气体,比空气___________________________ , __________________ 溶于水,溶于有机溶剂。



专题十四烃——甲烷、乙烯、苯考纲展示考情汇总备考指导1.了解有机化合物中碳的成键特征。
2.了解有机化合物的同分异构现象。
3.了解甲烷、乙烯、苯等有机化合物的主要性质。
4.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
2019年6月:202019年1月:17,232018年6月:21,44,452018年1月:14,23,25,33,342017年:442016年:24,25,27,33,37甲烷、乙烯、苯是重要的化工原料,利碳原子的成键特点,分析分子结构及性质关系,以结构决定性质理念分析。
有机物甲烷1.有机物的概念,同分异构体(1)有机物①定义:一般将含有碳元素的化合物称为有机化合物,简称有机物。
有机物的组成中除了碳元素外,常有H、O、S、N、P、卤素等元素。
②碳原子的成键特征:在有机物中,碳原子呈四价,碳原子既与其他原子形成共价键,也相互形成碳碳单键、双键或三键等,有机化合物有链状分子和环状分子。
(2)同分异构体:化合物分子式相同,结构不同的现象称同分异构现象,其化合物互称同分异构体。
(3)烃:仅含碳、氢两种元素的有机物称为碳氢化合物,也称为烃。
如:CH 4、C 2H 4、苯等。
(4)分类烃⎩⎪⎨⎪⎧脂肪烃(链状)⎩⎪⎨⎪⎧饱和烃→烷烃(如:甲烷)不饱和烃→烯烃(如:乙烯)芳香烃(含有苯环)(如:苯)2.甲烷的结构与性质(1)甲烷的存在①甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
②我国的天然气主要分布在中西部。
(2)分子结构:CH 4是正四面体结构分子,分子中4个共价键完全等同。
CH 4是最简单的烷烃。
(3)物理性质:甲烷是一种无色、无味、密度比空气小,极难溶于水的气体。
(4)化学性质:在通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂、强酸、强碱不反应。
易燃烧,高温分解,能发生取代反应。
①燃烧反应方程式:CH 4+2O 2――→点燃CO 2+2H 2O(淡蓝色火焰,天然气是清洁能源)。
高考化学:有机化学甲烷、乙烯、苯、乙醇、乙酸考点一览!考点1 乙烯的分子组成和结构(1)分子组成:C2H4(属于烯烃)(2)分子结构:①电子式②结构式③结构简式:CH2 === CH2球棍模型空间填充模型考点2 乙烯的物理性质考点3 乙烯的化学性质(1)氧化反应点燃①可燃性CH2=CH2+ 3O22CO2+2H2O现象:火焰明亮且伴有黑烟同时放出大量的热。
②被KMnO4(H+)氧化:使KMnO4溶液褪色。
生成CO2(2)加成反应有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应。
乙烯可以与与卤素单质、水、氢气、卤化氢等加成。
CH2=CH2+Br2―→CH2BrCH2BrCH2=CH2+H2CH3CH3CH2=CH2+HCl CH3CH2ClCH2=CH2+H2O CH3CH2OH。
催化剂由乙烯制取聚乙烯:n CH2=CH2—[- CH2—CH2-] n—考点4 乙烯的用途考点5 苯的分子组成和结构(选修内容)③分子模型:考点6 苯的物理性质(选修内容)考点7 苯的化学性质(选修内容)(1)氧化反应苯不能被KMnO4 (H) 氧化,能在空气中燃烧。
反应方程式:2C6H6+15 O212CO2 + 6H2O ①苯的溴化反应:浓硫酸与H2加成。
考点1 乙醇的组成和结构考点2 乙醇的物理性质乙醇俗称酒精。
无色透明具有特殊香味的易挥发液体,密度比水小,沸点78.5℃,可与水以任意比互溶。
考点3 乙醇的化学性质2CH3CH2OH+2Na→2CH3CH2ONa+H2↑1.乙醇的氧化反应2.点燃(1)燃烧:(2)催化氧化——生成乙醛。
乙醇催化氧化过程的反应机理:醇的催化氧化规律:a.与羟基(—OH)相连的碳原子上有两个或三个氢原子的醇,被氧化生成醛。
2RCH2OH+O2 2RCHO+2H2Ob.与羟基(—OH)相连的碳原子上有一个氢原子的醇,被氧化生成酮。
+O2 +2H2Oc.与羟基(—OH)相连的碳原子上没有氢原子的醇,在通常情况下不能被氧化。
第一节 甲烷 乙烯 苯 煤、石油、天然气的综合利用一、甲烷的结构与性质1.分子组成与结构(1)甲烷俗名沼气(存在于池沼中)、坑气(瓦斯,煤矿的坑道中)、天然气(地壳中)。
(2)分子式:CH 4;电子式:结构式:。
(3)甲烷空间结构的描述:甲烷是正四面体结构,碳原子位于正四面体的中心,顶点都是氢原子。
2.甲烷的物理性质甲烷是无色无味气体,比空气密度小,难于水,但溶于CCl 4。
3.甲烷的化学性质(1)稳定性:一般情况下,性质很稳定,跟强酸、强碱或强氧化剂等不反应。
(2)可燃性:CH 4+2O 2−−−→点燃CO 2+2H 2O (淡蓝色火焰) (3)取代反应:CH 4+Cl 2−−→光CH 3Cl+HCl(CH 3Cl 一氯甲烷,不溶于水的气体)、 CH 3Cl+Cl 2−−→光CH 2Cl 2+HCl(CH 2Cl 2二氯甲烷,不溶于水)、 CH 2Cl 2+Cl 2 −−→光 CHCl 3+HCl(CHCl 3三氯甲烷,俗名氯仿,不溶于水,有机溶剂)、 CHCl 3+Cl 2 −−→光 CCl 4+HCl(CCl 4四氯甲烷,又叫四氯化碳,不溶于水,有机溶剂) 二、烷烃的组成、结构与性质1.烷烃:碳原子间以单键结合成链状,碳原子剩余价键全部跟氢原子结合的烃称为烷烃(也叫饱和烃)2.烷烃的通式:C n H2n+2(n≥1)3.烷烃物理通性:(1)状态:C1-C4的烷烃常温为气态,C5-C11液态,C数>11为固态(2)熔沸点、密度:C原子数越多,熔沸点越高,密度越大。
C原子数相同时,支键越多,熔沸点越低。
(3)水溶性:不溶于水,易溶于有机溶剂。
液态烷烃密度比水小。
4.烷烃的燃烧通式:烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色①取代反应:可与氯气发生取代反应,生成氯代物。
②氧化反应:燃烧通式5.同系物和同分异构体(1)同系物①定义:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互相称为同系物;同系物的化学性质相似,物理性质呈现一定的递变规律。