高一小班元素周期表和元素周期律
- 格式:doc
- 大小:998.00 KB
- 文档页数:13


高一化学知识点梳理元素周期表和元素周期律这篇高一化学元素周期表和元素周期律知识点梳理是特地为大家整理的,希望对大家有所帮助!高一化学元素周期表和元素周期律知识点①原子组成:原子核中子原子不带电:中子不带电,质子带正电荷,电子带负电荷原子组成质子质子数==原子序数==核电荷数==核外电子数核外电子相对原子质量==质量数②原子表示方法:A:质量数 Z:质子数 N:中子数 A=Z+N决定元素种类的因素是质子数多少,确定了质子数就可以确定它是什么元素③同位素:质子数相同而中子数不同的原子互称为同位素,如:16O和18O,12C和14C,35Cl和37Cl④电子数和质子数关系:不带电微粒:电子数==质子数带正电微粒:电子数==质子数电荷数带负电微粒:电子数==质子数+电荷数⑤118号元素(请按下图表示记忆)H HeLi Be B C N O F NeNa Mg Al Si P S Cl Ar⑥元素周期表结构短周期(第1、2、3周期,元素种类分别为2、8、8)元周期(7个横行) 长周期(第4、5、6周期,元素种类分别为18、18、32)素不完全周期(第7周期,元素种类为26,若排满为32) 周主族(7个)(ⅠAⅦA)期族(18个纵行,16个族) 副族(7个)(ⅠBⅦB)表 0族(稀有气体族:He、Ne、Ar、Kr、Xe、Rn)Ⅷ族(3列)⑦元素在周期表中的位置:周期数==电子层数,主族族序数==最外层电子数==最高正化合价⑧元素周期律:从左到右:原子序数逐渐增加,原子半径逐渐减小,得电子能力逐渐增强(失电子能力逐渐减弱),非金属性逐渐增强(金属性逐渐减弱)从上到下:原子序数逐渐增加,原子半径逐渐增大,失电子能力逐渐增强(得电子能力逐渐减弱),金属性逐渐增强(非金属性逐渐减弱)所以在周期表中,非金属性最强的是F,金属性最强的是Fr (自然界中是Cs,因为Fr是放射性元素)判断金属性强弱的四条依据:a、与酸或水反应的剧烈程度以及释放出氢气的难易程度,越剧烈则越容易释放出H2,金属性越强b、最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强c、金属单质间的相互置换(如:Fe+CuSO4==FeSO4+Cu)d、原电池的正负极(负极活泼性正极)判断非金属性强弱的三条依据:a、与H2结合的难易程度以及生成气态氢化物的稳定性,越易结合则越稳定,非金属性越强b、最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强c、非金属单质间的相互置换(如:Cl2+H2S==2HCl+S)注意:相互证明由依据可以证明强弱,由强弱可以推出依据⑨化学键:原子之间强烈的相互作用共价键极性键化学键非极性键离子键共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素间形成。


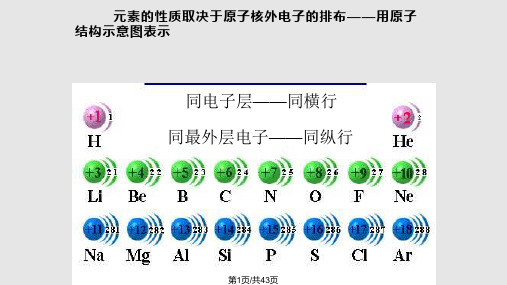
微专题——元素周期律(一)知识框架① 、按原子序数递增的顺序从左到右排列;排列原则 ②、将电子层数相同的元素排成一个横行;③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期)周期(7个横行) ②、长周期(四、五、六周期)周期表结构 ③、不完全周期(第七周期)① 主族(ⅠA ~ⅦA 共7个)1、元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律 ①、核电荷数,电子层结构,最外层电子数 ②、原子半径性质递变 ③、主要化合价④、金属性与非金属性 ⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性2、元素周期律元素的性质随着原子序数的递增而呈周期性变化,这个规律叫做元素周期律。
元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
原子结构及性质变化规律七主七副零和八三长三短一不全①与水反应置换氢的难易②最高价氧化物的水化物碱性强弱金属性强弱③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)④互相置换反应依据:⑤原电池反应中正负极①与H2化合的难易及氢化物的稳定性元素的非金属性强弱②最高价氧化物的水化物酸性强弱金属性或非金属③单质的氧化性或离子的还原性性强弱的判断④互相置换反应①、同周期元素的金属性,随荷电荷数的增加而减小,如:Na>Mg>Al;非金属性,随荷电荷数的增加而增大,如:Si<P<S<Cl。
规律:②、同主族元素的金属性,随荷电荷数的增加而增大,如:Li<Na<K<Rb<Cs;非金属性,随荷电荷数的增加而减小,如:F>Cl>Br>I。
③、金属活动性顺序表:K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au电子层数:相同条件下,电子层越多,半径越大。

高一化学《元素周期表 元素周期律》知识总结一、原子的结构1、原子的构成:。
2、原子结构中常见的微粒关系(1)原子:质量数=质子数+中子数;质子数=核电荷数=原子序数=核外电子数。
(2)离子的核外电子数:核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数。
(3)符号baX +cd +e 中各数字的含义:。
二、元素、核素、同位素1、元素:具有相同核电荷数(即质子数)的同一类原子的总称。
2、核素:具有一定数目质子和一定数目中子的一种原子。
可用符号AZ X 表示。
3、同位素(1)概念:质子数相同而中子数不同的同一种元素的不同核素互称为同位素。
(2)特征:①具有相同存在形态的同位素,化学性质几乎完全相同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)有关同位素的四点说明①“同位”是指这几种核素的质子数(核电荷数)相同,在元素周期表中占据同一个位置。
②因许多元素存在同位素,故原子的种数多于元素的种数。
有多少种核素就有多少种原子。
但也并非所有元素都有同位素,如Na 、F 、Al 等就没有同位素。
③同位素分为稳定同位素和放射性同位素。
④同位素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
三、核外电子排布1、排布方式:多电子原子核外的电子是分层排布的,即2、排布规律(1)电子一般总是首先排在能量最低的电子层里,即最先排在第1层,当第1层排满后,再排第2层,依次类推。
(2)每层最多容纳的电子数为2n2(n代表电子层数)。
(3)最外层电子数不超过8个(K层为最外层时,最多不超过2个),次外层不超过18个,倒数第3层不超过32个。
四、元素周期律1、定义:元素的性质随原子序数的递增而呈周期性变化的规律。
2、实质:元素原子核外电子排布周期性变化的结果。
3、元素周期表中元素的电子排布和化合价规律(1)从元素周期表归纳电子排布规律①最外层电子数等于或大于3(小于8)的一定是主族元素。
专题14 元素周期表和元素周期律【知识串讲】【归纳总结】一、元素周期表1.元素周期表的编排(1)原子序数与元素的原子结构间的关系①原子:原子序数=核电荷数=核外电子数。
②阴离子:原子序数=核外电子数−所带电荷数。
③阳离子:原子序数=核外电子数+所带电荷数。
(2)元素周期表的编排原则①按原子序数递增的顺序,从左到右将电子层数相同的元素排成横行。
②把不同横行中最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行。
(3)元素周期表的结构①周期(每一横行):周期序数=电子层数元素周期表中具有相同电子层数的元素,按原子序数递增的顺序排列的一个横行称为一个周期。
周期表中有7个横行,即有7个周期,从上到下依次为第一周期到第七周期。
除第一周期外,每周期的元素都是从活泼金属——碱金属开始,逐渐过渡到活泼非金属——卤素,最后以稀有气体结束。
周期的分类及各周期元素数目:在第六周期和第七周期中有特殊的镧系和锕系元素,镧系元素包括从57号元素镧(La)到71号元素镥(Lu)共十五种元素,锕系元素包括从89号元素锕(Ac)到103号元素铹(Lr)共十五种元素。
它们的电子层结构相似、性质相似,为了表的结构紧凑,将它们放在第六、七周期的同一格内,并按原子序数递增的顺序排列,分两行独列在表的下方。
此外,排布在92号元素铀(U)之后的元素多数是人工进行核反应制得的元素,叫超铀元素。
②族(每一纵列):元素周期表中共有18个纵列,第8、9、10三个纵列叫做Ⅷ族。
主族元素包括除He、Ne、Ar之外的所有短周期元素及部分长周期元素;副族元素全在长周期内。
稀有气体元素因为性质稳定,有稳定的电子结构,化合价为0,因此称为0族。
过渡元素:元素周期表中从ⅧB到ⅧB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
同一主族元素原子最外层电子数相同,且自上而下电子层数递增,原子半径逐渐增大。
由于镧系和锕系位于第3列,所以各族中元素种类最多的是ⅧB族,共32种。
元素周期表和元素周期律(一)教学目标:回顾基本概念,注意细节,认真审题,再解决题目,重视解题后的总结与归纳。
训练学生的解题技能,让学生练习相关高考题。
学习方法:回顾基本概念,逐字分析题目,书写每个方程式,重视总结归纳。
考点一元素周期表1.原子序数2.编排原则3.结构(1)周期(7个横行, 个周期):(2)族(18个纵行,个族):4.元素周期表中元素的分区(1)分界线:如上图所示,沿着元素周期表中B、Si、As、Te、At与Al、Ge、Sb、Po的交界处画一条斜线,即为金属元素和非金属元素的分界线(氢元素除外)。
(2)金属元素:位于分界线的左面区域,包括所有的过渡元素和部分主族元素。
(3)非金属元素:位于分界线的右面区域,包括部分主族元素和0族元素。
(4)分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。
5.元素周期表中的特殊位置(1)过渡元素:元素周期表中部从第ⅢB族到第ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。
(2)镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
(3)锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
1.最外层电子数是2的元素一定是第ⅡA族吗?2.最外层电子数为3~7个的原子一定属于主族元素吗?3.同周期第ⅡA族和第ⅢA族的原子序数一定相差1吗?4.到目前发现的元素为止,哪一族含有的元素最多?命题角度一元素周期表中周期和族概念的考查[典例1](2014·东城模拟)根据中学化学教材中所附元素周期表判断,下列叙述不正确的是() A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等1.下列叙述正确的是()A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.副族元素没有非金属元素C.碱金属元素是指第ⅠA族的所有的元素D.周期表中的各主族元素都含有金属元素和非金属元素2.对于短周期元素,下列说法正确的是()A.若两元素原子序数相差8,则周期数一定相差1 B.两种简单离子不可能相差3个电子层C.同族的两元素之间不可能形成化合物D.最外层电子数相同的元素一定位于同一族命题角度二元素周期表整体结构的考查4.(2014·安徽蚌埠模拟)结合如图所示元素周期表,回答下列问题:(1)表中所列元素,属于短周期元素的有________(填字母,下同),属于主族元素的有________;g元素位于第________周期第________族,i元素位于第________周期第________族。
(2)f元素位于第________周期第________族,请按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
______________________________________。
(3)简述元素在元素周期表中的位置与元素原子结构的关系。
________________________________________________________________________命题角度三元素周期表中元素性质的考查[典例2](2014·江西景德镇模拟)元素周期表短周期的一部分如表所示。
下列有关A、B、C、D、E五种元素的叙述中,正确的是()A.D在过量的B中燃烧的主要产物为DB3B.C的氢化物的水溶液酸性比E的强C.A与B形成的阴离子可能有AB2-3、A2B2-4D.E单质中由于形成了氢键,所以很容易液化5A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,e元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强6.下列说法中正确的是()A.同一周期元素原子,半径越小越容易失电子B.在同一周期,第ⅠA族单质的熔点比第ⅡA族的高C.所有主族元素的最高化合价与它的族序数数值相等D.同主族元素的气态氢化物,相对分子质量越大,沸点不一定越高1.(双选)(2013·广东高考)元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。
则下列判断正确的是()A.非金属性:Z<T<X B.R与Q的电子数相差26C.气态氢化物稳定性:R <T<Q D.最高价氧化物的水化物的酸性:T>Q2.(2013·福建高考)四种短周期元素在周期表中的位置如图,其中只有M为金属元素。
下列说法不正确的是()A.原子半径Z<M B.Y的最高价氧化物对应水化物的酸性比X的弱C.X的最简单气态氢化物的热稳定性比Z的小D.Z位于元素周期表中第二周期第ⅥA族考点二 元素周期律教学过程:1.定义元素的性质随 的递增而呈 变化的规律。
2.实质元素原子 的结果。
4.元素金属性强弱的比较(1)结构比较法:最外层电子数越少,电子层数越多,元素金属性越强。
(2)位置比较法⎩⎪⎨⎪⎧同周期:从左到右,元素金属性减弱同主族:从上到下,元素金属性增强左下右上位:左下方元素金属性较强(3)实验比较法 ⎩⎪⎨⎪⎧ 依最高价氧化物对应水化物碱性强弱比较:碱性强的对应元素金属性强依与水、酸反应的难易或剧烈程度:越易反应或反应越剧烈,对应元素金属性越强依单质的还原性强弱:还原性越强,对应元素的金属性越强依阳离子氧化性的强弱:氧化性越弱,对应元素的金属性越强依单质与同一物质反应的难易程度:越易进行反应,对应元素的金属性越强依原电池正负极:一般来说,作负极的金属对应元素的金属性强5.元素非金属性强弱的比较(1)结构比较法:最外层电子数越多,电子层数越少,非金属性越强。
(2)位置比较法⎩⎪⎨⎪⎧ 同周期:从左到右,非金属性增强同主族:从上到下,非金属性减弱左下右上位:左下方元素非金属性较弱(3)实验比较法 ⎩⎪⎨⎪⎧ 依最高价氧化物对应水化物酸性强弱比较:酸性强的对应元素非金属性强依与H 2反应的难易或剧烈程度:越易反应或反应越剧烈,对应元素非金属性越强依单质的氧化性强弱:氧化性越强,对应元素的非金属性越强依简单阴离子的还原性强弱:还原性越弱,对应元素的非金属性越强依单质与同一物质反应的难易程度:越易进行反应,对应元素的非金属性越强依置换反应:非金属性较强的元素单质能置换出非金属性较弱的元素单质1.最外层电子数相同的元素,其化学性质一定相同吗?2.对于主族元素,元素的最高正化合价和主族族序数相同,所以氧和氟最高正价分别为+6和+7,这种说法对吗?3.同主族从上到下,酸性:HF>HCl>HBr ,这种比较方法正确吗?4.碳酸的酸性强于次氯酸,能否说明C 的非金属性强于Cl?命题角度一 元素性质的直接判断1.下列排列顺序正确的是( )①热稳定性:H 2O >HF >H 2S ②原子半径:Na >Mg >O③酸性:H 3PO 4>H 2SO 4>HClO 4 ④结合质子能力:OH ->CH 3COO ->Cl -A .①③B .②④C .①④D .②③2.(2014·河南焦作高三联考)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是A .原子半径:Z>Y>XB .气态氢化物的稳定性:R<WC .WX 3和水反应形成的化合物是离子化合物D .Y 和Z 两者最高价氧化物对应的水化物能相互反应3.(2014·长沙模拟)运用元素周期律分析下面的推断,其中错误的是( )A .已知Ra 是第七周期第ⅡA 族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强B .已知As 是第四周期第ⅤA 族的元素,故AsH 3的稳定性比NH 3的稳定性强C .已知Cs 的原子半径比Na 的原子半径大,故Cs 与水反应比Na 与水反应更剧烈D .已知Cl 的核电荷数比Al 的核电荷数大,故Cl 的原子半径比Al 的原子半径小命题角度二 元素金属性和非金属性强弱的比较[典例1] 下列各项叙述中一定能说明元素X 的非金属性比元素Y 的非金属性强的是( )A .X 原子在反应中得到的电子数比Y 原子在反应中得到的电子数少B .气态氢化物溶于水后的酸性,X 比Y 强C .X 的最高正价比Y 的最高正价高D .X 单质能与Y 的氢化物反应生成Y 单质4.将甲、乙两种金属的性质相比较,已知①甲与H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶液中置换出乙单质;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④与某金属反应时甲原子得电子数目比乙原子得电子数目多;⑤甲单质的熔、沸点比乙的低。
能说明甲的金属性比乙强的是()A.①④B.①②③C.③⑤D.①②③④⑤命题角度三粒子半径大小比较[典例2]A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C -具有相同的电子层结构。
下列说法中正确的是()A.原子序数:A>B>C B.原子半径:A>B>CC.离子半径:A2->B2+>C-D.原子最外层电子数:A>C>B规律小结微粒半径大小比较方法:6.下列各组粒子中粒子半径由大到小的是()A.O、Cl、S、P B.Al3+、Mg2+、Ca2+、Ba2+C.K+、Mg2+、Al3+、H+D.Li、Na、K、Cs命题角度四元素性质递变规律的实验探究7.(2014·郑州模拟)某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。
请你帮助该学生整理并完成实验报告。
(1)实验目的:____________________________________________________。
(2)实验用品:仪器:①________;②________(请填写两种主要玻璃仪器)。
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
(3)实验内容((4)实验结论:__________________________________________。
(5)问题和讨论:①请用物质结构理论简单说明得出上述结论的原因:________________________________________________________________________②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱。
试列举两个事实说明F的非金属性比Cl强:______________________________________________。