骨肿瘤诊疗原则与方法
- 格式:docx
- 大小:19.37 KB
- 文档页数:9

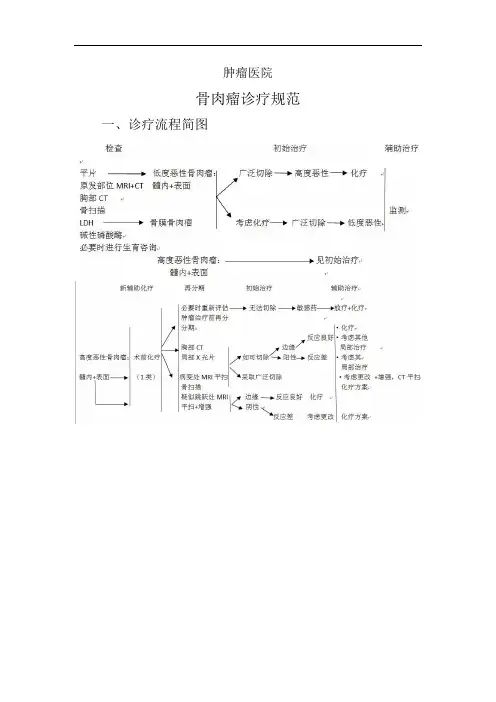
肿瘤医院骨肉瘤诊疗规范一、诊疗流程简图二、诊断骨肉瘤就是起源于间叶组织得恶性肿瘤,以产生骨样组织得梭形基质细胞为特征。
经典型骨肉瘤就是原发于髓腔内得高度恶性肿瘤,肿瘤细胞产生骨样组织,可能就是极少量。
㈠流行病学经典型骨肉瘤占所有骨肉瘤得80%,主要发生于儿童与青少年,中位发病年龄为20岁。
常见发病部位为股骨远端与胫骨近端,首发症状常为疼痛及肿胀,最常见得转移方式就是血行转移至肺脏。
㈡症状症状基本上持续超过几周或几个月。
骨肉瘤最常见得临床表现就是疼痛与肿块。
疼痛可放射至临近关节,初期疼痛多为间断性隐痛,随病情发展疼痛逐渐加重,多发展为持续性疼痛,休息、制动或者一般止痛药无法缓解。
㈢体征体格检查可能发现局限肿块,有压痛。
运动受限,局部发热与毛细血管扩张及听诊上得血管杂音。
在病情进展期,常见到局部炎症表现与静脉曲张、病理性骨折发生在5-10%得病人中,多见于以溶骨性病变为主得骨肉瘤。
肿瘤突然得增大要怀疑继发得改变,如囊内出血、骨骺虽就是骨肉瘤进入骺端得屏障,但极少数病例中,肿瘤侵及或穿透骨骺,出现关节积液,有些病例可经骨骺穿入关节。
肿瘤晚期可有局部淋巴结肿大,一般为吸收所致得淋巴结炎,个别见于淋巴结转移或受侵。
早期一般状态较好,消瘦、精神萎靡及贫血常在出现肺转移以后发生、㈣诊断具有恶性征象得经典骨肉瘤患者应转诊至专家医院或综合医院得专科进行诊治。
所有疑似患者活检后应进行分期,需完成以下检查:(1)胸部CT与骨扫描;(2)局部影像学检查(X线、CT或MRI);(3)血常规、乳酸脱氢酶与碱性磷酸酶;(4)病理组织学检查、1、实验室检查包括碱性磷酸酶升高、乳酸脱氢酶升高及血常规异常。
2、影像学检查常见表现:(1)骨内始发骨破坏;(2)可破坏骨皮质;(3) 可在骨外形成软组织肿块;(4)可伴有骨膜反应;(5)病变基质可分为成骨、溶骨或者混合;(6)病变局部可见卫星病灶及跳跃转移;(7)可有肺转移灶、3、原发部位病变影像检查主要包括X线、CT、MRI 及全身骨扫描。

骨肿瘤的分期和切除原则骨肿瘤的分期随着骨肿瘤基础研究的深入和治疗水平的提高,骨肿瘤治疗的观念和效果较以往有明显的不同。
在骨肿瘤治疗前,进行系统而准确的肿瘤分期,对于手术方案的制定和选择以及估计肿瘤的预后都有极其重要的意义。
Enneking经过长期研究,大量观察骨肿瘤与宿主之间的相互作用,并基于病理组织学观察,提出了一套非常实用的良、恶性骨肿瘤分期系统。
在这一分期系统中,良、恶性肿瘤分别用阿拉伯数字(1、2、3)和罗马数字(Ⅰ、Ⅱ、Ⅲ)分为3期。
概括地说,这套分期系统对于理解良、恶性骨肿瘤的生物学和临床行为非常有意义。
该分期系统的指标包括:肿瘤的组织学分级(G)、解剖部位(T)和有无转移(M)。
组织学分级G分为G0、G1、G2。
其中G0,指良性病变;肿瘤边界清,有完整包膜,极少远处转移;X线表现:肿瘤界清,囊内生长呈膨胀性,罕见穿破囊壁者;组织学表现:细胞分化良好,基质细胞比例正常,核分裂相极少见。
G1,指低度恶性病变,肿瘤可向囊外生长,但生长速度较慢,可有软组织肿块,偶有远处转移;X线表现:肿瘤界欠清,呈侵袭性生长;组织学表现:细胞分化中等,基质细胞较多,可见核分裂相但较少。
G2,指高度恶性病变,临床症状明显,肿瘤生长快,有跳跃性生长和软组织肿块,常早期就发生局部和远处转移;X线表现:病变侵袭破坏明显,骨膜反应,软组织肿块;组织学表现:细胞分化极差,基质细胞多,核分裂相多见。
解剖部位T分为T0、T1、T2。
其中T0指良性囊内和间室内病变,边界清楚。
T1指无真性包膜,但有假包膜,反应带内有指状突起或卫星灶,原发病灶和反应带均局限在病灶的原发间室内;皮质骨内,未穿破骨膜和骨髓腔,关节内,未穿破关节囊;骨旁间隙内,未进入骨皮质,未穿破骨膜侵犯肌、筋膜。
T2指间室内病变穿破解剖学间室:肿块本身穿出反应带超出原发间室意外创伤和不恰当的手术切除污染多个间室;病变或其反应带临近或侵犯主要血管、神经束者;一些缺乏阻止肿瘤扩散的内在屏障的解剖学部位,如腹股沟等;骨内病变向软组织侵犯;骨旁病变侵犯骨皮质,侵犯髓腔肘窝、腋窝、guo窝、腹股沟、骨盆内。

骨转移瘤诊疗规范一、恶性肿瘤骨转移的临床诊断与治疗(一)概述骨骼是晚期恶性肿瘤最常见的转移部位。
随着抗癌治疗方法的不断改进,晚期癌症患者的生存时间不断延长,患者出现骨转移及骨骼并发症的风险也随之明显增加。
骨转移常见于乳腺癌、肺癌、前列腺癌、胃癌、肾癌、甲状腺癌、宫颈癌、骨及软组织肉瘤等恶性肿瘤。
晚期恶性肿瘤的骨转移发生率:乳腺癌65%〜75%,前列腺癌65%〜75%,鼻咽癌67%〜75%,肺癌30%〜40%,甲状腺癌60%,黑色素瘤14%〜45%,肝癌13%〜41%,肾癌20%〜25%,结直肠癌1%〜7%,胃癌13%,其他头颈癌25%。
多发性骨髓瘤累及骨骼所致的骨病发生率为70%〜95%。
恶性肿瘤骨转移的确切发病机制尚未完全弄清。
癌细胞转移至骨骼导致RANK/RANKL系统的平衡破坏被认为是恶性肿瘤骨转移和骨破坏的主要发病机制。
恶性肿瘤细胞转移到骨骼并释放可溶介质,激活破骨细胞和成骨细胞。
激活的破骨细胞释放细胞因子又进一步促进肿瘤细胞分泌骨溶解介质,从而形成恶性循环。
恶性肿瘤骨转移常导致严重的骨疼痛和多种骨并发症,其中包括骨相关事件(skeletal related event, SREs)。
骨相关事件是指骨转移所致的病理性骨折、脊髓压迫、高钙血症、为缓解骨疼痛进行放射治疗、为预防或治疗脊髓压迫或病理性骨折而进行的骨外科手术等[12]。
骨转移所致的骨骼病变及骨相关事件,不仅严重影响患者自主活动能力和生活质量,而且还威胁患者的生存。
恶性肿瘤骨转移虽然都是肿瘤疾病晚期预后差,但是合理的治疗对患者仍然有积极意义。
止痛药治疗、双膦酸盐类药物治疗、放射治疗、手术治疗等方法均在骨转移治疗中起重要作用。
控制恶性肿瘤骨转移病变,常常需要接受多种方法综合治疗。
因此,深入认识恶性肿瘤骨转移病变、综合治疗骨转移病变可减少骨转移并发症,减少或避免骨相关事件,是改善骨转移患者生活质量的重要策略。
(二)诊断确诊为恶性肿瘤的患者,一旦出现骨疼痛、病理性骨折、碱性憐酸酶升高、脊髓压迫或脊神经根压迫或高钙血症相关症状等临床表现,应进一步检查排除骨转移病变。

骨转移瘤诊疗规范一、恶性肿瘤骨转移的临床诊断与治疗(一)概述骨骼是晚期恶性肿瘤最常见的转移部位。
随着抗癌治疗方法的不断改进,晚期癌症患者的生存时 间不断延长,患者出现骨转移及骨骼并发症的风险也随之明显增加。
骨转移常见于乳腺癌、肺癌、前列腺癌、胃癌、肾癌、甲状腺癌、宫颈癌、骨及软组织肉瘤等恶性肿瘤。
晚期恶性肿瘤的骨转移发生率:乳腺癌65%〜75%,前列腺癌65%〜75%,鼻咽癌67%〜75%,肺癌30%〜40%,甲状腺癌 60%,黑色素瘤14%〜45%,肝癌13%〜41%,肾癌20%〜25%,结直肠癌1%〜7%,胃癌13%,其 他头颈癌25%。
多发性骨髓瘤累及骨骼所致的骨病发生率为70%〜95%。
恶性肿瘤骨转移的确切发病机制尚未完全弄清。
癌细胞转移至骨骼导致RANK/RANKL系统的平衡 破坏被认为是恶性肿瘤骨转移和骨破坏的主要发病机制。
恶性肿瘤细胞转移到骨骼并释放可溶介质,激活破骨细胞和成骨细胞。
激活的破骨细胞释放细 胞因子又进一步促进肿瘤细胞分泌骨溶解介质,从而形成恶性循环。
恶性肿瘤骨转移常导致严重的骨疼痛和多种骨 并发症,其中包括骨。
骨相关事件是指骨转移所致相关事件(skeletal related event, SREs)的病理性骨折、脊髓压迫、高钙血症、为缓解骨疼痛进行放射治疗、为预防或治疗脊髓压迫或病理性骨折而进行的骨外科手术等[12]。
骨转移所致的骨骼病变及骨 相关事件,不仅严重影响患者自主活动能力和生活质量,而且还威胁患者的生存。
恶性肿瘤骨转移虽然都是肿瘤疾病晚期预后差,但是合理的治疗对患者仍然有积极意义。
止痛药治疗、双膦酸盐类药物治疗、放射治疗、手术治疗等方法均在骨转移治 疗中起重要作用。
控制恶性肿瘤骨转移病变,常常需要接受多种方法综合治疗。
因此,深入认识恶性肿瘤骨转移病变、综合治疗骨转移病变可减少骨转移并发症,减少或避免骨相关事件,是改善骨转移患者生活质量的重要策略。
(二)诊断确诊为恶性肿瘤的患者,一旦出现骨疼痛、病理性骨折、碱性憐酸酶升高、脊髓压迫或脊神经根 压迫或高钙血症相关症状等临床表现,应进一步检查排除骨转移病变。


骨肿瘤的诊断骨肿瘤是一种常见但复杂的疾病,它可以发生在任何年龄段并且可能引起严重的健康问题。
准确的骨肿瘤诊断对于选择适当的治疗方案至关重要。
本文将讨论骨肿瘤的诊断方法和技术。
首先,骨肿瘤的诊断需要一系列的评估工具。
其中最常用的是影像学检查,如X射线、磁共振成像(MRI)和计算机断层扫描(CT)。
X射线可以提供骨骼的整体结构,并显示任何可疑的异常。
然而,X射线只能提供二维图像,对于复杂的骨肿瘤可能无法准确诊断。
因此,MRI和CT常常与X射线配合使用,以提供更详细的信息。
MRI可以检测软组织肿块和血管情况,而CT则可以提供更清晰的骨骼图像。
除了影像学检查,还可以通过活检来确定骨肿瘤的性质。
活检是指通过取样并鉴定病理学特征来确定肿瘤类型的过程。
常用的活检方法包括穿刺活检、骨髓活检和手术切除活检。
穿刺活检是最常见的方式,通过使用针头在病灶中取样,并送往实验室进行检测。
骨髓活检则是通过在骨髓中取样,可以确定骨髓内的恶性病变。
手术切除活检是一种侵入性的方法,适用于较大的肿瘤。
通过手术切除整个肿瘤,并将其送往实验室进行进一步检测。
在进行活检之前,还可以使用一些辅助诊断技术来指导活检过程。
其中包括针刺活检导航、骨髓穿刺导航和超声引导活检等。
这些技术使用实时图像导航,可以减少操作风险,并提高活检的准确性。
除了上述传统的骨肿瘤诊断方法,近年来还出现了一些新的技术和方法。
例如,基因检测技术可以通过分析肿瘤细胞的DNA来确定特定基因的突变情况。
这些基因突变可能与特定类型的骨肿瘤相关联,因此基因检测可以帮助确定肿瘤类型和预后。
此外,蛋白质组学技术也可以通过分析肿瘤细胞中的蛋白质组成来识别特定的生物标志物,并用于诊断和预后评估。
需要注意的是,骨肿瘤的诊断是一个复杂的过程,需要多种方法和技术的综合应用。
医生在诊断过程中需要综合考虑患者的临床症状、影像学结果和病理学特征。
此外,骨肿瘤的诊断也需要与其他类似病症进行区分,如骨骼良性肿瘤、骨结核和骨转移等。

第十二章骨肿瘤骨肿瘤(Osteoma)是指发生于骨骼或其附属组织(血管、神经、骨髓等)的肿瘤,是常见病。
同身体其它组织一样,其确切病因不明;骨肿瘤有良性,恶性之分,良性骨肿瘤易根治,预后良好,恶性骨肿瘤发展迅速,预后不佳,死亡率高,至今尚无满意的治疗方法。
恶性骨肿瘤可以是原发的,也可以是继发的,从体内其它组织或器官的恶性肿瘤经血液循环,淋巴系统转移至骨骼或直接侵犯骨骼。
还有一类病损称瘤样病变,肿瘤样病变的组织不具有肿瘤细胞形态的特点,但其生态和行为都具有肿瘤的破坏性,一般较局限,易根治。
骨肿瘤与其他肿瘤相同、其发病因素很复杂。
西医目前对肿瘤的成因尚不明确。
可能与刺激因素、遗传、病毒、良性肿瘤及瘤样病变的恶变有关。
其临床特征:1.疼痛为骨肿瘤主要表现,但程度不同。
有的只有轻微的酸痛或不适;有的是在发现肿瘤以后才回忆起过去一些轻微疼痛;有些误认为是风湿样痛,与治疗关系不大,休息时也疼;有的疼痛剧烈。
呈待续性钝痛或刺痛,需服止痛剂。
良性肿瘤疼痛轻,发展慢。
恶性肿瘤疼痛重,且为进行性,影响饮食及睡眠。
2.肿块早期肿瘤位于骨内,随肿瘤生长,骨质扩张膨胀日益明显。
肿瘤突破骨质后形成软组织肿块。
肿块常与疼痛同时出现,有时肿块为首先表现。
肿瘤起源于骨,故不能移动。
良性骨肿瘤生长缓慢,体积不大,表面及周围皮肤正常。
恶性骨肿瘤生长迅速,表面皮肤发红、热感,皮下静脉充盈。
3.功能丧失因疼痛或肿块而影响患病的肢体活动,比如肱骨上端肿瘤影响肩关节活动,脊柱肿瘤可使脊椎活动受限而僵直或合并脊柱侧弯。
4.畸形由于肿瘤的生长,使骨质膨胀变形,坚固性受到破坏,当继续负重时就逐渐发生弯曲变形,如髋内翻、膝内外翻等。
严重的多发性骨软骨瘤可使生长、发育期的儿童身体矮;畸形。
5.压迫神经颅面肿瘤向颅神经压迫;第一肋骨附近的肿瘤压迫臂丛神经;脊柱肿瘤可发生肢体瘫痪等。
6.病理骨折骨内肿瘤生长致使轻微外力或一般日常活动就可以引起骨折,往往因为发生了骨折才发现骨肿瘤的存在。

骨及软组织肿瘤一、流行病学成熟骨骼由骨、软骨、骨髓和神经、血管、纤维等多种组织构成,其中任何一种组织可发生良性或恶性肿瘤。
原发性骨肿瘤总的发生率很低(男性为1.110/10万,女性为1.060/10万,约占全身肿瘤的2%-3%)二、临床表现原发性骨肿瘤可以毫无症状、有时是因其他原因行X线片检查而被偶然发现。
即使是恶性骨肿瘤,疼痛也可很轻微;但是疼痛越重,肿瘤为恶性的可能性越大。
夜间痛多提示为恶性肿瘤。
疼痛突变剧烈,很可能是发生了病理性骨折。
肿瘤邻近关节时,可以此起活动障碍;也可因累及神经、血管而引起相应症状。
恶性肿瘤可有消瘦、发热。
病史的长短和症状发展的快慢对于判断肿瘤的良恶性具有一定意义。
患者的年龄和患病部位对于原发性骨肿瘤的诊断有很大帮助。
对可疑为原发性骨肿瘤的患者,应进行全面细致的查体。
三、诊断明确诊断是合理治疗的前提,对原发性骨肿瘤的诊断一般按如下程序进行;首先要判断病变是否为肿瘤,再判断其良恶性,最后确定其具体的病理类型。
对于大多数原发性骨肿瘤,诊断必须坚持临床、影像和病理三结合的原则,违背此原则,单纯依靠其中任何一项都可能导致严重的误诊。
1.影像学检查(1)X线片:X线片不仅可发现骨肿瘤,对于判断骨肿瘤的良恶性和病理类型也有重要作用,而且还有助于决定是否采取和采取何种进一步的影像学检查,因此X线片是诊断骨肿瘤的最基本和首要的影像学检查方法。
阅读X线片时,应按照一定顺序进行。
首先,要判断X线片的质量。
中国生物治疗网杨教授特别指出,肺癌的早期症状其次,开始寻找病变部位。
最后,对病变部位进行细致的观察和分析。
应仔细观察以下方面:患者骨骺闭合情况、病变所在骨的类型(长骨、短骨、不规则骨)、病变有骨内的部位(骨干、干骺端、骺端;髓内、皮质内、皮质旁)、病变大小、边界是否清楚、基质是否均匀(有无钙化、骨化、残余骨等)骨皮质是否完整,有无骨膜反应及其类型、有无软组织包块及邻近骨有无改变等。
通过这些观察,可对骨肿瘤做出初步的定性诊断。

第三十五章骨肿瘤第一节概论骨肿瘤包括的范围较广,凡与骨骼系统相关的组织的原发性良、恶性肿瘤或继发性肿瘤均包含其中。
此外,还包括了部分骨组织或其附属组织内的瘤样病损,这些瘤样病损严格地说不是肿瘤,或尚未确定其性质是否属于真正的肿瘤,但由于这些病损中的一部分在一定情况下也会转化为真正的肿瘤,可发生复发或恶变,加上这些瘤样病损在临床、影像和病理上有时会和一些骨肿瘤相混淆,故常合并在一起讨论。
一、外科分期Enneking提出的肌肉骨骼的外科分期是目前较为全面的评价骨肿瘤恶性程度的系统。
对肿瘤的手术选择应考虑到肿瘤的解剖部位,因为解剖学间室是预防微小肿瘤扩散的天然屏障,在长骨,这些屏障是皮质骨和关节软骨;在关节,是关节囊和关节软骨;在软组织,是大的筋膜间隔和肌腱的起止点。
这个外科分期系统是将外科病理分级(G),外科区域即肿瘤与解剖间室的关系(T)以及有无区域性或远处转移(M)结合起来,设计出G-T-M 外科分级系统,并以此作为制定治疗方案和术前选择手术方式的科学依据(表35-1)。
骨肿瘤的诊断主要依靠病理学检查,并结合临床和影象学诊断。
良性肿瘤用阿拉伯数字1、2、3表示,分别代表潜隐性,活动性和侵袭性。
恶性肿瘤用罗马字Ⅰ,Ⅱ,Ⅲ表示,Ⅰ为低度恶性,Ⅱ为高度恶性,Ⅲ表示存在区域性和转移性病损。
用G表示肿瘤的良恶性程度,G0属良性,G1属低度恶性,G2属高度恶性(表35-2)。
T表示肿瘤的侵袭范围,以肿瘤囊和间室为分界。
T0为囊内;T1为囊外但仍在间室内;T2为囊外和间室外。
转移是指有无区域转移或远处转移,用M表示。
M0为无转移,M1为转移。
表35-1 Enneking外科分期类别分期分级部位转移代号性质良性 123 G0G0G0T0T0T1~2M0M0M0~1G0T0M0G0T0M0G0T1~2M0~1迟发性活跃性侵袭性恶性ⅠAⅠBⅡA G1G1G2T1T2T1M0M0M0G1T1M0G1T2M0G2T1M0低度恶性,无转移,间室内低度恶性,无转移,间室外高度恶性,无转移,间室内ⅡB ⅢA ⅢBG2G1~2G1~2T2T1T2M0M1M1G2T2M0G1~2T1M1G1~2T2M1高度恶性,无转移,间室外低/高度恶性,有转移,间室内低/高度恶性,有转移,间室外表35-2 骨肿瘤外科病理分级良性(G0)低度恶性(G1)高度恶性(G2)骨瘤骨旁骨肉瘤典型骨肉瘤骨样骨瘤骨内骨肉瘤照射后骨肉瘤骨母细胞瘤骨软骨瘤继发性软骨肉瘤原发性软骨肉瘤内生软骨瘤去分化软骨肉瘤软骨母细胞瘤间充质软骨肉瘤骨膜性软骨瘤纤维瘤纤维肉瘤,分化良好未分化纤维肉瘤纤维瘤病恶性纤维组织细胞瘤,分化良好恶性纤维组织细胞瘤骨巨细胞瘤恶性骨巨细胞瘤未分化梭形细胞肉瘤腱鞘巨细胞瘤腱鞘巨细胞肉瘤滑膜肉瘤神经纤维瘤上皮样肉瘤神经肉瘤神经鞘瘤脊索瘤小泡细胞肉瘤脂肪瘤粘液样脂肪肉瘤多形性脂肪肉瘤血管脂肪瘤血管内皮细胞瘤血管肉瘤血管瘤血管外皮细胞瘤牙釉质瘤Ewing肉瘤平滑肌肉瘤横纹肌肉瘤二、治疗(一)治疗原则对肌肉骨骼系统肿瘤的治疗,应该采取以手术为主的联合治疗方法。

骨肉瘤临床诊疗指南
类型、细胞间质成分及其分布情况。
常表现为T1WI低信号、T2WI高信号,增强后呈均匀或不均匀强化。
5【治疗原则】
5.1手术切除是治疗骨肉瘤的主要方法,术前应进行全身
评估,确定手术方案。
手术切除范围应包括瘤体及周围正常组织,尽可能达到肿瘤清除。
对于肢体骨肉瘤,术后应进行适当的康复训练。
5.2放疗可作为手术的辅助治疗,或作为术后辅助治疗。
对于无法手术切除的骨肉瘤或手术切除后病情不稳定的患者,放疗可用于控制局部病变和减少疼痛。
5.3化疗是骨肉瘤治疗的重要手段,常用方案有MAP、IE、METHOTREXATE等。
化疗可用于辅助手术治疗、控制局部
病变和预防转移。
6【预后】
6.1骨肉瘤的预后与病变的部位、大小、病理类型、分化
程度、病程长短、治疗方法等因素有关。
6.2肢体骨肉瘤的预后较好,而躯干骨肉瘤的预后较差。
常见骨科疾病的诊断和治疗方法作为人体重要的支撑结构和活动器官,骨骼系统很容易受到各种因素的影响而出现不同程度的疾病。
在骨科领域,常见的疾病包括骨骼肿瘤、关节炎、骨质疏松、骨折等,这些疾病都会导致患者身体功能的受限和活动能力的下降,严重的还会导致残疾和生命威胁。
本文旨在介绍常见骨科疾病的诊断和治疗方法。
一、骨骼肿瘤骨骼肿瘤是指起源于骨骼的各种良性或恶性的肿瘤。
其中恶性骨肿瘤较为常见,如骨癌、骨肉瘤等,这些肿瘤生长较快,易转移,严重影响患者的生命健康。
骨骼肿瘤的诊断主要依靠X线、CT、MRI等影像学检查,如有必要可以使用穿刺或骨髓活检等方式进行病理分析。
治疗方案包括手术切除、放射治疗、化疗等,具体方案需要根据患者的病情、病理类型、年龄、全身情况等多种因素综合考虑。
对于良性骨肿瘤,手术切除的治愈率较高;对于恶性骨肿瘤,多种治疗手段结合使用可以提高生存率和治愈率。
二、关节炎关节炎是一种慢性炎症性疾病,通常表现为关节肿胀、疼痛、畸形和功能障碍等。
其病因比较复杂,与年龄、遗传、环境(如感染、外伤、骨质疏松等)等因素有关。
诊断关节炎需要综合考虑患者的病史、体格检查、影像学检查等指标。
早期诊断可以提高治疗效果和预后。
治疗方案多种多样,包括改善生活方式、物理治疗、药物治疗等。
生活方式改善包括控制体重、多运动、避免过度使用有问题的关节等。
物理治疗包括物理疗法、按摩、理疗等。
药物治疗包括非甾体抗炎药、糖皮质激素、青霉素类药物等。
三、骨质疏松骨质疏松是一种常见的骨代谢性疾病,主要表现为骨量减少和骨质变薄,易导致骨折。
骨质疏松通常与年龄、性别、遗传、生活方式等因素有关。
诊断骨质疏松通常采用骨密度测定,可以使用DXA、QCT等方法。
此外,血钙、磷、碱性磷酸酶等指标也可以作为参考。
治疗骨质疏松包括生活方式改善、药物治疗等。
生活方式改善包括增加日光浴时间、增加钙摄入、运动等。
药物治疗包括抗骨吸收药物、促进骨形成药物等。
四、骨折骨折是指骨骼的断裂或破碎,通常由外力作用引起。
骨肿瘤诊疗原则与方法骨肿瘤发病率较低,在骨科范畴里是相对小众的亚专科,规范化专科医师培训尚未普及,一度成为骨科中“陷阱”最多的专科。
近十年来,随着医疗科技的发展,从组织病理学到分子探针,从单纯手术到综合治疗,骨肿瘤诊断方法和治疗手段获得了长足的进步,越来越多的骨科医师关注并参与到骨肿瘤的治疗中来。
基于此,骨肿瘤诊疗的原则与规范化亟待加强和推广,传统诊断方法和治疗手段的再评价,技术创新的适应证及应用范畴都值得关注。
贯彻执行这些原则和方法,需要深刻领悟骨肿瘤的自然病程和生物学特性,做到“先诊断、后治疗”,“无诊断、勿治疗”。
骨肿瘤的诊断骨肿瘤的误诊误治目前看来仍然不容忽视。
客观因素在于:骨肿瘤发病率低,医生缺乏足够的临床训练和经验,对于肿瘤的鉴别诊断缺乏认识;主观原因在于:医生没有按照已有的诊疗规范进行临床工作,如未进行基本的病史询问和物理体检,没有足够的影像学检查进行辅助支持,未进行肿瘤组织活检,将恶性肿瘤当成良性病变治疗,破坏了肿瘤自然屏障导致肿瘤播散,即便再次彻底切除亦难以达到预期效果。
“临床、影像、病理三结合”一直是骨肿瘤专科医师坚持的诊断原则之一。
在这里必须再次强调病史和体格检查的重要性,作为临床第一手资料重要的获得渠道,却往往被医生所忽视。
现代化的影像技术发展迅速,不再局限于动态增强、功能成像这些对于肿瘤诊断极为重要的方法,医疗信息化建设极大促进了医疗数据的扩展,影像数据分析、人工智能模块工具开发层出不穷,影像组学概念开始提出并实践运用。
计算机技术可以把影像资料转化为可识别和读取的量化数据,并和临床病理资料结合分析,再反馈于指导临床运用。
与传统影像数据基于形态和结构不同的是,影像组学技术对图像提取后的分级分阶统计特征以及纹理提取、数据融合后所代表的临床意义依靠多维度数据来实现和展示。
通过图像获取、图像分割、特征提取和模型建立等步骤对肿瘤特征及数据进行分析,从而指导临床。
在病理学诊断方面,传统的HE染色及免疫组化仍然是骨肿瘤诊断的重要方法,以往病理科提供给临床医师的诊断信息包括肿瘤的性质(良性,恶性,中间性),肿瘤组织来源,级别高低,是否转移及临床分期。
随着现代技术的进步,个体化和“精准医学”概念的提出,病理专业迈进分子诊断时代,通过对肿瘤易感基因检测,能够发现并了解靶向基因发生的断裂、融合、异位等分子事件,从而帮助我们更好地理解肿瘤发生、发展和转归的规律,寻找病人适用的肿瘤靶向治疗药物,提高用药效率和治疗效果,降低医疗费用,使治疗达到最好结果。
典型的范例是骨巨细胞瘤的H3F3A基因检测的分子诊断,使临床难以鉴别的骨巨细胞瘤能够明确诊断,同时骨巨细胞瘤中κB受体活化因子配体(RANKL)抑制剂地诺单抗的临床应用是基于对RANK/RANKL的检测,是目前针对包括骨巨细胞瘤的疾病转化研究的典范。
地诺单抗与RANK有高特异性亲和作用,通过竞争性结合RANK从而阻断RANK与配体RANKL的组合,负反馈抑制骨吸收信号通路传导,中断骨吸收溶解破坏的恶性循环,重新建立骨破坏和骨修复的动态平衡,疾病进展控制率在90%以上,本期专题中杨彩虹团队对地诺单抗STAT3信号通路抑制骨巨细胞瘤进行了相关探索研究,希望有更多的研究关注于骨肿瘤的诊断,使之不断的丰富与发展。
骨科肿瘤治疗的原则骨肿瘤学所涵盖的内容包括骨科学和肿瘤学,因此,对本专科疾病的诊断与治疗宜从这两方面来探讨。
内容涵盖肿瘤的生长方式和包膜形成、宿主的局部反应、宿主和肿瘤的相互作用、自然屏障、解剖间室、局部复发和远隔转移、运动系统损伤和功能重建等。
在对恶性骨肿瘤的治疗上也要首先满足肿瘤学的要求,根据Enneking理论在安全外科边界下切除肿瘤。
非肿瘤专科医生常易过分重视肢体功能学的保留及重建,忽略肿瘤学切除的原则,牺牲肿瘤边界而保留功能需求的初衷,最终将会同时失去二者。
恶性肿瘤的生物学行为对于保肢及生命存活至关重要,骨及软组织功能重建的优劣与生活质量息息相关。
临床上的诸多困惑和问题,最终可以归结为肿瘤学和骨科学孰为优先原则。
恶性骨肿瘤局部复发除了增加再截肢的风险,同时加剧了生物学行为的恶性转变,远隔转移风险急剧上升,而这正是绝大部分恶性骨肿瘤病人的死亡原因。
故而,肿瘤学的控制应作为首要目标,一旦肿瘤学失败,再完美的骨科重建也成为空谈。
从肿瘤学角度了解恶性骨肿瘤,需要首先深刻理解它的分期系统。
分期的目的:①便于同行间对相同危险因素的病人进行分类,评估病人的预后;②制定治疗计划的依据;③评价治疗效果。
它具备几个重要的参数:肿瘤分化程度、肿瘤发生部位、是否合并远隔转移等。
肿瘤初始和治疗后影像学及组织病理学的评估,肿瘤突变负荷和微卫星灶不稳定性等指标可以为医生制定合理方案提供决策依据。
治疗前完备的影像学检查,多学科协作及讨论制定严格的术前计划,锁定危险因素及部位,术后标本评估验证危险因素的处理结果及安全外科边界的获得与否均是肿瘤学治疗关键因素。
在现实工作中不同的专家治疗方法迥异,不同的学术观点可能来源于经验而不是临床研究结果。
先对手术标本的外科边界进行分析,然后通过随访得出结论是积累临床证据的好方法;对治疗的病人进行前瞻性队列研究,也是获取临床证据的可靠来源。
由于骨肿瘤的发病率低,难以在单中心积累足够的样本,单纯的病例分析也不失为一种证据的来源,本期专题中沙漠团队对于肿瘤治疗的传统方法——旋转成形术这一罕见术式进行了总结,是一种有益的尝试;老年骨肉瘤的发病率极低,本期专题中于秀淳团队对于40~60岁年龄段骨肉瘤治疗采用多中心研究,更容易积累病例,减少偏倚,使临床结果中的肿瘤学数据更具有信服力,值得借鉴。
骨科重建治疗原则与方法骨肿瘤学的另一个重要内涵就是骨科学重建问题。
随着外科技术、重建材料学及辅助治疗的进展,骨科重建技术的快速发展,能够在保证肿瘤彻底去除的前提下,通过手术重建肢体的功能。
重建材料常见的是大块异体骨、人工定制/组配型假体以及复合型材料(生物型和机械型),近年来快速发展的3D打印技术也为重建方式提供了个性化的选择。
理论上并没有哪种重建方式是完美无缺的。
生物型重建包括运用自体骨、异体骨和灭活再植技术,异体骨的高并发症和灭活骨再植术后的复发风险限制了其广泛使用。
不可忽视的是高级别恶性骨肿瘤术后化疗也是影响重建方式选择的重要因素之一。
早期恢复功能对于肿瘤病人至关重要,此外,功能重建的持久耐用也是重要考量指标。
肿瘤学治疗效果快速发展,病人生存期不断延长,也对持久耐用的重建方式选择提出了新的要求。
大块自体骨移植重建自体骨移植物的最大优势是愈合快、免疫反应及感染性疾病传播概率小,但缺点是来源有限以及人们对于自身供体取材导致残缺的接受度下降而难以广泛使用。
同时,从肿瘤学角度考虑,自体骨采集时,需使用单独的器械而不能让肿瘤污染。
最常用的自体骨采集区域是髂嵴的松质骨。
虽然大段腓骨和肋骨也常作为移植供区,但是采骨量仍十分有限,一旦供区少于骨缺损范围,则自体骨移植的短板凸显。
另一方面,带血管蒂的自体骨移植物感染率低于非血管化移植物,而愈合率大大提高。
最常用的是带血管蒂游离腓骨移植重建,在实际操作中,血管化的自体骨移植物对手术技术的要求很高,一定程度上限制了其广泛运用。
自体瘤骨灭活再植重建作为历史的产物,对于肿瘤溶骨破坏未造成主体结构损坏、非大片硬化型成骨的前提下,将肿瘤瘤段灭活再植重建骨缺损曾经是主流的选择。
早期缺乏骨库支持、肿瘤型假体相对费用昂贵且制作周期较长、有些地区甚至无假体可用,灭活再植技术显得难能可贵,成为骨缺损的重要重建方式,且由于匹配性高,愈合率满意,现今仍不失为一种良好的选择。
对于灭活的方法,既往常用的包括高温煮沸、术中放射灭活、酒精灭活、高渗盐水以及液氮冷冻等,此类方法杀伤肿瘤的同时,骨强度也会有不同程度的下降。
我国最早由北京积水潭医院提出的95%的酒精浸泡瘤骨30 min的酒精灭活再植术,曾经推广到全国。
大块/大段异体骨移植重建基于大型骨库的建设和发展,并可提供各种型号及尺寸的供体材料,大块/大段异体移植骨广泛用于骨肿瘤切除术后重建。
异体骨上可以留存韧带,或移植后供软组织附丽,通过肌肉的黏附保持软组织张力和关节稳定,都成为此类重建的闪光点。
大块/大段异体骨移植重建的主要并发症有骨折(约18%)、不愈合(约17%)、感染(约10%)。
骨折并发症可通过局部内固定辅以植骨来解决。
异体骨与宿主骨不愈合时会比较棘手,大约50%可通过再次植骨或其他治疗后骨愈合。
感染一旦出现则往往很难控制,绝大多数病人最终难免取出异体骨,骨盆部位发生感染则取出率更高。
良好的软组织覆盖和血运是减少并发症的重要方法。
肿瘤型人工假体置换重建肿瘤型人工假体置换重建骨肿瘤切除后大段骨缺损在近年来逐渐成为主流,与生物重建比较,人工假体重建的优势:术后可提供即刻稳定,人工假体及内植物持久耐用,随访功能满意,早期并发症发生率相对异体骨等生物重建降低。
病人肢体无需等待愈合时间,无骨不愈合之忧,生活质量较高,对于预计生存期短的病人具有重要意义。
同样人工假体置换也存在诸多并发症,根据国际保肢协会(ISOLS)五型失败因素分析,无菌性松动最为常见。
感染发生率约为5%,但是治疗最为棘手,保守治疗常常难以奏效而需要取出假体。
假体感染后常需要彻底清创灌洗、临时抗生素假体间隔物并选择敏感抗生素,Ⅱ期翻修是目前的主要方法。
对于无菌性松动这类并发症,肿瘤型假体几乎难以幸免。
复合材料重建生物工程和材料学科的发展为复合重建技术奠定了理论和物质基础,生物、机械及其他人造材料的联合运用拓展了复合重建的方法和空间,骨肿瘤切除后缺损进行复合重建已有卓有成效的报道。
自体/异体骨和人工假体是目前较常用的复合重建方法之一。
复合重建的优点是结合了生物重建愈合后的持久耐用和人工假体重建的即刻功能恢复。
常用的带血管蒂自体骨移植和异体骨复合重建大段骨缺损,愈合效率高于单纯异体骨,且一旦愈合即无后顾之忧。
复合重建(自体/异体骨)假体的失败率低于单纯假体重建,它虽然结合了两者的优点,但也兼具两者的并发症发生率。
长骨干肿瘤相对干骺端肿瘤来说,能够进行关节保留而对功能的影响相对较小。
本期专题中李浩淼团队采取的节段性假体复合移植治疗方法,作为一种有益的尝试,需要长期的随访结果进一步验证临床效果。
预后的评估和随访骨肿瘤的治疗效果需要标准化的规律随访来揭示最终的结果,同时预后的评价与治疗原则和方法又密切相关。
在正确诊断前提下,恰当的肿瘤学治疗和骨科重建预后为佳,反之预后不良,往往表现为肿瘤学的复发和转移,以及严重的重建并发症。
相对于原发恶性骨肿瘤,转移癌的发生率约为原发骨肿瘤的数十倍。
并且随着治疗手段的不断发展,癌症治疗效果显著提高,生存期明显延长,与此同时,癌症发生骨转移的概率和发病率也大大上升,而最易出现骨转移的部位也就是中轴骨,这对于骨肿瘤医师来说,未来将面对大量的转移癌病例。