氮肥的生产和使用PPT
- 格式:ppt
- 大小:299.50 KB
- 文档页数:10

氮肥的生产和使用教学目的 1、掌握氨和铵盐的主要性质和使用。
2、了解氨和铵盐的检验方法。
教学重难点 氨和铵盐的主要性质。
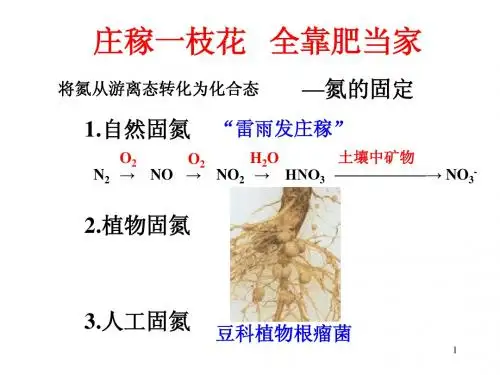
教学过程【导入】人们常说“雷雨发庄稼”,农作物的生长需要氮元素,而空气中的氮是以氮气的形式大量存在着,不能被农作物直接吸收(回顾上节课学习的自然固氮)。
【PPT 展示】三条固氮途径,自然固氮、生物固氮、工业固氮显然靠自然固氮无法满足农作物生产所需的氮元素。
为提高农作物产量,科学家一直设法将游离态的氮转化为化合态的氮。
20世纪初,德国科学家哈伯、波施(Calr Bosch )成功开发了合成氨的生产工艺。
缓解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
【板】一、氨的工业制法;N 2 + 3H 2 2NH 3【板】二、氨气 1.物理性质【展示试样】展示一瓶NH 3,观察其颜色、状态、并闻其气味(注意闻气味的方法)。
【小结】氨是无色、有刺激性气味的气体,密度比空气小,易液化,氨液化的同时放出大量的热;液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷(常用作致冷剂)。
极易溶于水。
常温下,1体积水约能溶解700体积的氨。
【设问1】虽然氨气中含有大量氮元素,但是但其适合做氮肥吗?氨气作为气体,密度比空气小,不易进入土壤被植物吸收,并且氨气具有刺激性气味,给生产生活带来很大不便,所以,氨气不适合做氮肥 【实验探究1】喷泉实验【设问2】通过观察样品和实验、描述实验现象,产生喷泉的原理是什么?分析实验现象你能得出什么结论?1、现象:将胶头滴管中的水挤入烧瓶,打开止水夹,烧杯中的水沿着导管喷入烧瓶,变成红色喷泉。
2、原理: 胶头滴管中的水挤入烧瓶,大量氨气溶于水使烧杯中气压急剧降低,水被吸入烧瓶形成喷泉。
【设问2 】喷泉试验中,我们看到的是红色的喷泉,那么氨气溶于水中是否又发生了些什么反应呢?【板】2.化学性质【板】(1)氨气与水的反应NH 3+H 2O NH 3· H 2O NH 3· H 2O NH 4++OH -【设问3】那么由气态到液态后,氨水适合做氮肥吗?【过渡提问1】我们知道氨水其实可以作为化肥,可是我们现在在实际生产应用中发现人们很少用它,通过刚才对氨气物理、化学性质的初步学习,大家知道其中的原因吗?答:氨水中的NH 3· H 2O 不稳定,容易分解生成氨气,而挥发掉促进植物生长的有效成分,降低了肥效。









PPT 1农作物每年需要从大自然中吸收大量的含氮化合物,作为氮肥以满足植物生长的需求,进一步用来解决人类对粮食作物的需求问题,可见氮肥对农作物的生长起着重要的作用,今天我们就一起来学习氮肥的生产和使用。
PPT 2请同学们回忆之前学过的知识思考,在大自然界中,如何把大自然中的氮气转化为适合植物吸收的含氮化合物?——自然固氮、生物固氮(植物根瘤菌)依靠大自然的力量所固定的氮,能否满足人类对粮食的需求?人类如何来解决这个问题?——人工固氮,即工业固氮,以满足农作物生长需要的大量氮肥是人类发展史上一个伟大的贡献,它解决了人类因粮食不足而导致的饥饿问题PPT 3请大家思考下,从经济角度出发,工业固氮会以什么为原料?——大气中含量最多的氮气工业上以氮气为原料与氢气反应,在高温高压催化剂的作用下,生成氨气,要注意这个反应是一个可逆的反应合成氨实现了人类工业固氮的目的,得到了氨气,接下来我们一起来学习氨气的性质PPT 4(取出一瓶制备好的氨气)通过各种感官的感觉,氨气有哪些物理性质呢?——颜色、气味(列出氨气的其他性质)通过对氨气这些物理性质的了解,问问大家,氨气适合做氮肥吗?为什么?——不适合,密度比空气小,不易进入土壤,并且刺激性的气味给生产生活带来不便既然气态的氨气不适合做氮肥,那么一起来看看氨气最后一个性质,易溶于水,到底多容易?我们一起来做一个实验PPT 5(进行演示实验)实验要求……看完实验,大家一起来描述下实验的现象产生这些现象的原因是什么呢?——一体积水大约可以溶解700体积的氨气,大量氨气溶于水中,是烧瓶内气压急剧降低,打开止水夹外界大气压将烧杯中的水压入烧瓶中,至于酚酞溶液变红,说明溶液呈碱性为什么溶液会呈碱性呢(进入PPT 6)PPT 6原来氨气溶于水中与水发生了一些反应,这就是氨气的第一个化学性质【板书,氨气与水反应】,大部分NH3 与水结合成NH3·H2O,NH3·H2O 呈弱碱性,NH3·H2O 可以小部分电离成NH4+和OH-。