九年级化学溶液的形成
- 格式:ppt
- 大小:1.66 MB
- 文档页数:47

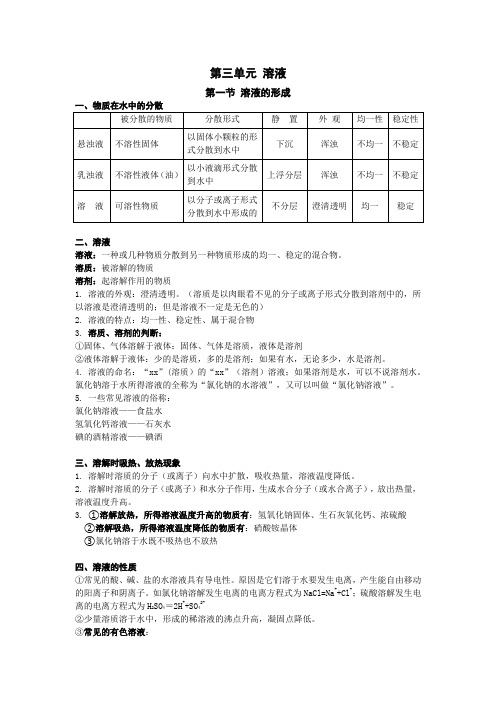
第三单元溶液第一节溶液的形成一、物质在水中的分散二、溶液溶液:一种或几种物质分散到另一种物质形成的均一、稳定的混合物。
溶质:被溶解的物质溶剂:起溶解作用的物质1.溶液的外观:澄清透明。
(溶质是以肉眼看不见的分子或离子形式分散到溶剂中的,所以溶液是澄清透明的;但是溶液不一定是无色的)2.溶液的特点:均一性、稳定性、属于混合物3.溶质、溶剂的判断:①固体、气体溶解于液体:固体、气体是溶质,液体是溶剂②液体溶解于液体:少的是溶质,多的是溶剂;如果有水,无论多少,水是溶剂。
4.溶液的命名:“xx”(溶质)的“xx”(溶剂)溶液;如果溶剂是水,可以不说溶剂水。
氯化钠溶于水所得溶液的全称为“氯化钠的水溶液”,又可以叫做“氯化钠溶液”。
5.一些常见溶液的俗称:氯化钠溶液——食盐水氢氧化钙溶液——石灰水碘的酒精溶液——碘酒三、溶解时吸热、放热现象1.溶解时溶质的分子(或离子)向水中扩散,吸收热量,溶液温度降低。
2.溶解时溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量,溶液温度升高。
3.①溶解放热,所得溶液温度升高的物质有:氢氧化钠固体、生石灰氧化钙、浓硫酸②溶解吸热,所得溶液温度降低的物质有:硝酸铵晶体③氯化钠溶于水既不吸热也不放热四、溶液的性质①常见的酸、碱、盐的水溶液具有导电性。
原因是它们溶于水要发生电离,产生能自由移动的阳离子和阴离子。
如氯化钠溶解发生电离的电离方程式为NaCl=Na++Cl-;硫酸溶解发生电离的电离方程式为H2SO4=2H++SO42-②少量溶质溶于水中,形成的稀溶液的沸点升高,凝固点降低。
③常见的有色溶液:蓝色溶液(含Cu 2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液浅绿色溶液(含Fe 2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液黄色溶液(含Fe 3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液 紫红色溶液:高锰酸钾溶液 紫色溶液:石蕊溶液五、饱和溶液与不饱和溶液1. 定义:在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。



第九单元9.1溶液的形成【学习目标】1.认识溶解现象;掌握溶液的概念并认识溶液、溶质、溶剂三者的关系。
2.掌握溶质溶于水时的放热或吸热现象。
3.了解溶液的应用;知道一些常见的乳化现象。
【要点梳理】要点一、溶液1.溶液、溶质、溶剂:(1)一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液;被溶解的物质叫做溶质;能溶解其他物质的物质叫溶剂。
(2)对溶液的认识要注意以下几点:①溶质在被分散前的状态可以是固体、液体、气体。
②溶液不一定都是无色的,其颜色由溶质、溶剂的性质而决定。
③水是最常用的溶剂,酒精(乙醇)、汽油等物质也可以作溶剂。
多种液体形成溶液时,量最多的一种为溶剂,其余为溶质;但当溶液中有水存在时,不论水的量有多少,习惯上把水看作溶剂;通常不指明溶剂的溶液,一般指的是水溶液。
2.溶液的特征:均一性、稳定性(1)均一性:是指溶液各部分的溶质浓度和性质都相同。
但溶液中分散在溶剂中的分子或离子达到均一状态之后,仍然处于不停地无规则运动状态之中。
(2)稳定性:是指外界条件(温度、压强等)不变时,溶液长期放置不会分层,也不会析出固体或放出气体。
3.溶液的用途:(1)许多化学反应在溶液中进行,可以加快反应的速率。
(2)溶液对动植物和人的生理活动有很重要的意义。
动物摄取食物里的养料必须经过消化,变成溶液后才能吸收;植物从土壤里获得各种养料,也要变成溶液,才能由根部吸收。
要点二、溶解过程中的吸热和放热现象1.溶解:溶质分散到溶剂中形成溶液的过程,叫做物质的溶解。
在物质溶解形成溶液的过程中,所发生的溶质的分子(或离子)向溶剂中扩散的过程吸收热量,而溶质的分子(或离子)与水分子作用生成水合分子(或水合离子)的过程放出热量,所以物质溶解通常伴随着热量的变化。
2.溶解热现象:(1)扩散吸热>水合放热——溶液温度降低(2)扩散吸热=水合放热——溶液温度不变(3)扩散吸热<水合放热——溶液温度升高要点三、乳浊液、乳化现象1.乳浊液:小液滴分散到液体里形成的混合物,叫乳浊液。

九年级溶液的形成知识点在我们日常生活中,溶液无处不在。
无论是饮料、香水、甚至是大海里的盐水,都是溶液的例子。
那么,什么是溶液?溶液是由溶质和溶剂组成的混合物,其中溶质是能够被溶剂溶解的物质。
在九年级的学习中,我们需要掌握一些与溶液形成相关的重要知识点。
一、溶解:溶解是指固体、液体或气体在液体中均匀分散形成溶液的过程。
溶解的程度可以通过溶解度来衡量。
溶解度是在一定温度和压力下,单位溶剂中最多溶解溶质的量。
了解溶解度有助于我们预测在某种条件下,是否能够将某物质溶解于溶剂中。
二、溶质与溶剂:溶质是指能够在溶剂中溶解的物质。
常见的溶质有盐、糖、酒精等。
溶剂是指能够溶解溶质的物质。
常见的溶剂有水、醇类溶剂等。
溶质与溶剂的选择对于所得到的溶液的性质和用途有着重要的影响。
三、溶解过程:溶解过程是一个能量转化的过程。
当溶质与溶剂相互作用时,溶质分子与溶剂分子之间会发生相互作用,其中包括吸热过程和放热过程。
吸热过程意味着吸收了热量,使溶液温度上升,而放热过程则会释放热量,使溶液温度下降。
这些能量转化的过程是溶解过程中的重要环节。
四、溶解度与温度、压力的关系:溶解度与温度、压力之间存在着一定的关系。
在大多数情况下,随着温度的升高,溶解度也会增加。
这是因为在较高温度下,溶剂分子的动能增加,使得溶剂更容易分子间距离,从而更容易与溶质分子作用而使其溶解。
而对于气体溶解于液体的情况,随着压力的升高,溶解度也会增加。
这是因为气体分子越多,压力越大,溶解度也会随之增加。
五、饱和溶液与过饱和溶液:当溶剂中溶质的数量达到一定限度时,溶质无法再被溶解,此时溶液被称为饱和溶液。
而过饱和溶液则是指当溶质的溶解度较低时,通过增加温度或者降低溶液的温度,使得溶质的溶解度增加,从而形成的溶液。
过饱和溶液是一种相对不稳定的状态,容易通过诱发结晶的方式转化为饱和溶液。
六、溶液的浓度:溶液的浓度是指单位溶剂中溶质的含量。
常见的浓度单位有质量浓度、体积浓度和摩尔浓度等。
九年级化学溶液笔记一、溶液的形成。
1. 溶液。
- 定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
- 特征:- 均一性:溶液中各部分的性质(如密度、浓度等)完全相同。
例如,一杯蔗糖溶液,上部和下部的甜度是一样的。
- 稳定性:只要外界条件不变(温度、压强等),溶液无论放置多久,溶质都不会从溶剂中分离出来。
- 组成:- 溶质:被溶解的物质。
可以是固体(如食盐中的氯化钠)、液体(如酒精溶液中的酒精)、气体(如汽水中的二氧化碳)。
- 溶剂:能溶解其他物质的物质。
水是最常见的溶剂,汽油、酒精等也可作溶剂。
例如,碘酒中碘是溶质,酒精是溶剂。
2. 溶解现象。
- 物质溶解时的热现象:- 有的物质溶解时吸热,如硝酸铵。
将硝酸铵固体加入水中,溶液温度会降低。
- 有的物质溶解时放热,如氢氧化钠。
把氢氧化钠固体放入水中,溶液温度会升高。
- 有的物质溶解时温度基本不变,如氯化钠。
3. 乳化现象。
- 乳浊液:小液滴分散到液体里形成的混合物。
乳浊液不均一、不稳定,静置后会分层。
例如,植物油和水混合形成的就是乳浊液。
- 乳化作用:洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,这种现象称为乳化作用。
乳化后的乳浊液稳定性增强,但仍然是乳浊液,不是溶液。
二、溶解度。
1. 饱和溶液与不饱和溶液。
- 定义:- 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种溶质的不饱和溶液。
- 相互转化:- 对于大多数固体溶质(如硝酸钾):- 不饱和溶液→(增加溶质、降低温度、蒸发溶剂)饱和溶液。
- 饱和溶液→(增加溶剂、升高温度)不饱和溶液。
- 结晶:- 定义:溶质从溶液中以晶体的形式析出的过程。
- 方法:- 蒸发结晶:适用于溶解度受温度影响较小的物质(如氯化钠)。
通过加热蒸发溶剂,使溶液达到饱和状态,继续蒸发溶剂,溶质就会结晶析出。