蛋白质的理化性质
- 格式:docx
- 大小:13.18 KB
- 文档页数:1



蛋白质的理化性质第四节蛋白质的理化性质一、两性离解和等电点蛋白质是由氨基酸组成的,在其分子表面带有很多可解离基团,如羧基、氨基、酚羟基、咪唑基、胍基等。
此外,在肽链两端还有游离的α-氨基和α-羧基,因此蛋白质是两性电解质,可以与酸或碱相互作用。
溶液中蛋白质的带电状况与其所处环境的pH 有关。
当溶液在某一特定的pH 条件下,蛋白质分子所带的正电荷数与负电荷数相等,即净电荷数为零,此时蛋白质分子在电场中不移动,这时溶液的pH 称为该蛋白质的等电点,此时蛋白质的溶解度最小。
由于不同蛋白质的氨基酸组成不同,所以蛋白质都有其特定的等电点,在同一pH 条件下所带净电荷数不同。
如果蛋白质中碱性氨基酸较多,则等电点偏碱,如果酸性氨基酸较多,等电点偏酸。
酸碱氨基酸比例相近的蛋白质其等电点大多为中性偏酸,约在5.0 左右。
1、两性解离蛋白质可以在酸性环境中与酸中和成盐,而游离成正离子,即蛋白质分子带正电,在电场中向阴极移动;在碱性环境中与碱中和成盐而游离成负离子,即蛋白质分子带负电,在电场中向阳极移动。
以“P”代表收集于网络,如有侵权请联系管理员删除收集于网络,如有侵权请联系管理员删除蛋白质分子,以―NH 2 和―COOH 分别代表其碱性和酸性解离基团,随pH 变化,蛋白质的解离反应可简示如下:(pH>pI ) (pH=pI ) (pH<pI )移向阳极 不移动 移向阴极2、等电点沉淀和电泳①等电点沉淀蛋白质在等电点时,以两性离子的形式存在,其总电荷数为零,这样的蛋白质颗粒在溶液中因为没有相同电荷而相互排斥的影响,所以极易借静电引力迅速结合成较大的聚集体,因而易发生沉淀析出。
这一性质常在蛋白质分离、提纯时应用。
在等电点时,除了蛋白质的溶解度最小外,其导电性、粘度、渗透压以及膨胀性均为最小。
②电泳蛋白质颗粒在溶液中解离成带电的颗粒,在直流电场中向其所带电荷相反的电极移动。
这种大分子化合物在电场中定向移动的现象称为电蛋白质的阴离子蛋白质的阳离子蛋白质的兼性离子(等电点)NH 3+COO -P NH 3+P COOHNH 2COO-P泳。

蛋白质的理化性质 The document was finally revised on 2021六、蛋白质的理化性质1、两性解离溶液的pH大于某一蛋白质的等电点时,该蛋白质颗粒带负电荷,反之带正电。
R-CH-COOH→等电点(PI)→R-CH-COO—▕净电荷为0 ▕NH3+ NH22、胶体性质(1)颗粒表面电荷(2)水化膜胶体性质由这两个因素而来,去除这两个因素则蛋白质便容易析出。
3、蛋白质变性:在某些物理和化学因素下,其特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构。
(破坏了共价键,二硫键)蛋白质水解才是破坏了肽键。
·复性:蛋白质在去除变性因素后恢复至原构象的现象。
(变形的蛋白质易于沉淀,但也不一定沉淀;有时蛋白质虽沉淀,但并未变性;蛋白质在变性因素去除后,也可能不复性)·凝固:加热使蛋白质变性后进一步发展的不可逆结果,使之变成坚固的凝块。
4、☆特征吸收峰:280nm波长处5、变色反应(1)茚三酮(2)双缩脲七、蛋白质实验方法1透析、超滤2盐析→变性3电泳:十二烷基磺酸钠(SDS)→(加入至)蛋白质样与聚丙烯酰胺凝胶系统→蛋白质颗粒表面覆盖SDS→分子间电荷差异消失→使蛋白质在电场中泳动速率仅与蛋白质颗粒大小有关4层析5超速离心6分析序列(1)分析已纯化蛋白残基组成(2)测定多肽链N端、C端均为何种残基。
(3)把肽链水解为段,进行分析(4)测定各肽段氨基序列,一般用Edman降解法(5)一般用数种水解法,分析出各肽段中氨基酸顺序。
7结构测定圆二色光谱→二级结构X射线衍射↘核磁共振技术→三维空间结构。


蛋白质的理化性质蛋白质是一类高分子生物大分子化合物,由氨基酸分子结合而成。
下面将从化学、物理、生化等方面来介绍蛋白质的理化性质。
1. 氨基酸的性质氨基酸是蛋白质的基本组成单位,其分子结构具有酸性和碱性两部分,分别是羧基和氨基。
氨基酸的酸性和碱性反应性决定蛋白质的异性和电性。
氨基酸的酸性基团和碱性基团在不同的环境下会存在不同的离子形式,从而影响蛋白质的电性质。
2. 构象的性质蛋白质的构象是指氨基酸之间的立体构型,决定了蛋白质的特殊结构和功能。
蛋白质的构象主要由五种不同层次的结构组成,包括原生构象、二级构象、三级构象、四级构象和超级结构。
每一层次的构象都有一定的稳定性和特殊结构,是蛋白质功能和特性的决定因素。
3. 溶解和凝固的性质蛋白质在水中具有一定的溶解性,但可能会因为温度、pH值、离子强度等因素的改变而发生凝固。
这种溶解或凝固的性质取决于蛋白质的特殊结构以及其所处环境。
当蛋白质分子与水分子之间的相互作用受到破坏或受到特定溶剂或离子的作用时,蛋白质分子会转化为凝胶态或沉淀态。
4. 热力学性质蛋白质分子的热力学性质涉及其结构及其所处溶液环境的物理化学性质,可用于研究蛋白质折叠和复性过程。
蛋白质的热力学性质包括热容量、热稳定性、相转化、热解离等。
这些性质的变化与蛋白质结构的稳定性和功能密切相关。
蛋白质的光学性质主要表现为它们具有的吸收、发射光线的光学行为。
蛋白质的吸收和发射光束涉及其分子内的色团,这些分子内的色团主要由氨基酸的芳香族侧链所构成。
蛋白质的光学性质可以利用光谱分析来研究蛋白质的结构和功能。
综上所述,蛋白质的理化性质是多方面的,包括氨基酸的性质、构象的性质、溶解和凝固的性质、热力学性质以及光学性质等,这些性质的变化都会导致蛋白质的性质和功能的变化。
因此,对蛋白质的理化性质进行研究对于理解蛋白质的结构、功能与机制具有重要意义。

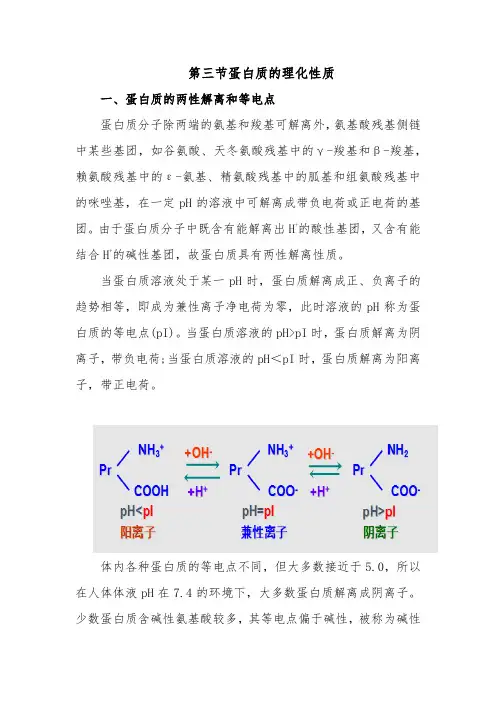
第三节蛋白质的理化性质一、蛋白质的两性解离和等电点蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基侧链中某些基团,如谷氨酸、天冬氨酸残基中的γ-羧基和β-羧基,赖氨酸残基中的ε-氨基、精氨酸残基中的胍基和组氨酸残基中的咪唑基,在一定pH的溶液中可解离成带负电荷或正电荷的基团。
由于蛋白质分子中既含有能解离出H+的酸性基团,又含有能结合H+的碱性基团,故蛋白质具有两性解离性质。
当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子净电荷为零,此时溶液的pH称为蛋白质的等电点(pI)。
当蛋白质溶液的pH>pI时,蛋白质解离为阴离子,带负电荷;当蛋白质溶液的pH<pI时,蛋白质解离为阳离子,带正电荷。
体内各种蛋白质的等电点不同,但大多数接近于5.0,所以在人体体液pH在7.4的环境下,大多数蛋白质解离成阴离子。
少数蛋白质含碱性氨基酸较多,其等电点偏于碱性,被称为碱性蛋白质,如鱼精蛋白、组蛋白等。
也有少量蛋白质含酸性氨基酸较多,其等电点偏于酸性,被称为酸性蛋白质,如胃蛋白酶和丝蛋白等。
由于组成蛋白质的氨基酸种类和数量不同,其蛋白质的等电点也各不相同。
在同一pH条件下,不同蛋白质所带净电荷的性质及电荷量不同。
因此,利用蛋白质两性解离性质,可通过电泳、层析等方法将不同蛋白质分离、纯化。
二、蛋白质的高分子性质蛋白质属于生物大分子,分子量在104-106D,其分子的直径可达1-100nm,在胶粒范围之内。
在蛋白质颗粒中,疏水基团大多位于分子内部,而亲水基团多分布于分子表面,在溶液中与水发生水合作用,颗粒表面形成一层水化膜,相互不会聚集。
此外,在非等电点的溶液中,同种性质的蛋白质颗粒表面都带有同种的电荷,相互排斥,使蛋白质颗粒相互隔开,不易聚集沉淀。
因此,蛋白质分子表面的水化膜和同种电荷是蛋白质胶体溶液稳定的两个重要因素。
蛋白质是高分子化合物,蛋白质溶液具有胶体溶液的性质,不能透过半透膜,是某些蛋白质分离纯化方法的基础。

第四节 蛋白质的理化性质一、两性离解和等电点蛋白质是由氨基酸组成的,在其分子表面带有很多可解离基团,如羧基、氨基、酚羟基、咪唑基、胍基等。
此外,在肽链两端还有游离的α-氨基和α-羧基,因此蛋白质是两性电解质,可以与酸或碱相互作用。
溶液中蛋白质的带电状况与其所处环境的pH 有关。
当溶液在某一特定的pH 条件下,蛋白质分子所带的正电荷数与负电荷数相等,即净电荷数为零,此时蛋白质分子在电场中不移动,这时溶液的pH 称为该蛋白质的等电点,此时蛋白质的溶解度最小。
由于不同蛋白质的氨基酸组成不同,所以蛋白质都有其特定的等电点,在同一pH 条件下所带净电荷数不同。
如果蛋白质中碱性氨基酸较多,则等电点偏碱,如果酸性氨基酸较多,等电点偏酸。
酸碱氨基酸比例相近的蛋白质其等电点大多为中性偏酸,约在5.0 左右。
1、两性解离蛋白质可以在酸性环境中与酸中和成盐,而游离成正离子,即蛋白质分子带正电,在电场中向阴极移动;在碱性环境中与碱中和成盐而游离成负离子,即蛋白质分子带负电,在电场中向阳极移动。
以“P ”代表蛋白质分子,以―NH 2 和―COOH 分别代表其碱性和酸性解离基团,随pH 变化,蛋白质的解离反应可简示如下:(pH>pI ) (pH=pI ) (pH<pI ) 移向阳极 不移动 移向阴极2、等电点沉淀和电泳①等电点沉淀蛋白质在等电点时,以两性离子的形式存在,其总电荷数为零,这样的蛋白质颗粒在溶液中因为没有相同电荷而相互排斥的影响,所以极易借静电引力迅速结合成较大的聚集体,因而易发生沉淀析出。
这一性质常在蛋白质分离、提纯时应用。
在等电点时,除了蛋白质的蛋白质的阴离子 蛋白质的阳离子 蛋白质的兼性离子(等电点)NH 3+COO -P NH 3+P COOHNH 2COO-P溶解度最小外,其导电性、粘度、渗透压以及膨胀性均为最小。
②电泳蛋白质颗粒在溶液中解离成带电的颗粒,在直流电场中向其所带电荷相反的电极移动。

蛋白质的理化性质(一)蛋白质的两性解离及等电点1.蛋白质的等电点(pI):当蛋白质溶液处于某一pH时,蛋白质上可解离基团解离成正、负离子的趋势相等,净电荷为零时溶液的pH。
➢等电点时溶解度最小可使蛋白质沉淀。
➢蛋白质pI要用等电聚焦等方法测定。
(二)蛋白质的胶体性质1.胶体溶液的三个条件:①大小在1-100nm范围内:蛋白质分子量很大,属胶体颗粒范围。
②同种电荷互相排斥:相同蛋白质颗粒带有同性电荷,与周围的反离子构成稳定的双电层。
③质点外围有水化层:多肽链上的极性基团极易吸附水分子,使蛋白质颗粒外围形成一层水化膜。
蛋白质可以形成稳定的胶体溶液。
2.利用胶体溶液性质,可用透析法将蛋白质中小分子杂质除去。
(三)蛋白质的沉淀1.定义:蛋白质在溶液中的稳定性是有条件的、相对的。
如果加入适当的试剂使蛋白质分子处于等电点状态或破坏其水化层和双电层,蛋白质胶体溶液因不再稳定而产生沉淀。
此现象即为蛋白质的沉淀作用。
2.类型:分可逆沉淀与不可逆沉淀。
➢可逆沉淀▁非变性沉淀定义:在温和条件下,改变溶液的pH或电荷状况,蛋白质结构和功能没有发生变化。
如等电点沉淀法、盐析法和有机溶剂沉淀法等。
是分离和纯化的基本方法。
a.等电点沉淀法:用弱酸或弱碱调节蛋白质溶液的pH等于pI,破坏蛋白质表面净电荷使蛋白质沉淀。
b.盐析沉淀法:1.盐析:通过加入大量高浓度中性盐如硫酸铵、氯化钠等,破坏蛋白质分子表面的水化层,中和它们的电荷,而使蛋白质沉淀析出的现象。
2.各种蛋白质亲水性及荷电均有差别,因此通过调节中性盐浓度,可使混合蛋白质溶液中的不同蛋白分别沉淀析出,这种方法称为分段盐析。
3.盐溶:加入低浓度盐导致蛋白质溶解度增加的现象。
c.有机溶剂沉淀法定义:加入能与水互溶的有机溶剂如乙醇、丙酮等,破坏蛋白质的水化膜使蛋白质产生沉淀。
注意:通常在低温条件下进行,否则有机溶剂与水互溶产生的溶解热会使蛋白质发生变性。
➢不可逆沉淀▁变性沉淀定义:沉淀条件剧烈,破坏了蛋白质胶体溶液稳定性,同时也破坏了蛋白质结构和功能。

【生物知识点】简述蛋白质的理化性质1、具有两性;2、可发生水解反应;3、溶水具有胶体的性质;4、加入电解质可产生盐析作用;5、蛋白质的变性;6、颜色反应,蛋白质可以跟许多试剂发生颜色反应;7、气味反应。
两性蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
水解反应蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
蛋白质水解时,应找准结构中键的“断裂点”,水解时肽键部分或全部断裂。
胶体性质有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
沉淀原因:加入高浓度的中性盐、加入有机溶剂、加入重金属、加入生物碱或酸类、热变性少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。
如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出,这种作用叫做盐析。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程。
利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
变性在热、酸、碱、重金属盐、紫外线等作用下,蛋白质会发生性质上的改变而凝结起来。
这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质。
蛋白质的这种变化叫做变性,蛋白质变性之后,紫外吸收,化学活性以及粘度都会上升,变得容易水解,但溶解度会下降。
蛋白质变性后,就失去了原有的可溶性,也就失去了它们生理上的作用。
因此蛋白质的变性凝固是个不可逆过程。
造成蛋白质变性的原因物理因素包括:加热、加压、搅拌、振荡、紫外线照射、X射线、超声波等。
化学因素包括:强酸、强碱、重金属盐、三氯乙酸、乙醇、丙酮等。
颜色反应例如在鸡蛋白溶液中滴入浓硝酸,则鸡蛋白溶液呈黄色。
这是由于蛋白质(含苯环结构)与浓硝酸发生了颜色反应的缘故。
还可以用双缩脲试剂对其进行检验,该试剂遇蛋白质生成紫色络合物。
简述蛋白质的理化性质。
蛋白质是一种具有生物活性的有机物质,是生物体的重要组成部分,是构成活体机体大部分亚细胞组织的重要物质。
它由氨基酸构成,包括20种氨基酸,每一种氨基酸的个体比例不定,形成了特异的蛋白质分子结构。
蛋白质具有种种特殊理化性质,它不仅能反映生物活体的特性,而且能用于科学实验室对生物材料进行分析和定量。
一、理化性质1、蛋白质结构蛋白质具有独特的三级结构,它由氨基酸组成,可以根据氨基酸序列和链构象形成复杂的空间构象。
以水解机理和非水解机理为基础,蛋白质的结构和功能的作用是相互关联的,即已知功能的蛋白质结构,也可以通过其结构推断出其功能。
2、蛋白质的水溶性大多数蛋白质具有特定的极性,所以它们能与水发生双范本作用作用,能够以很好的m比例溶解。
一般来说,极性和表面活性有关,活性质和水溶性有关,因此,蛋白质的水溶性和其本身的理化性质和结构有关。
3、pH值和温度蛋白质具有调节体内环境的重要作用,体内环境的温度和pH值的变化可以影响蛋白质的结构和活性。
它的敏感性比较大,当温度发生变化时,它会发生一定程度的改变,当α结构因温度变化而稳定时,蛋白质相对沉淀可能会发生。
此外,在体外制备蛋白质时,其pH值也可能影响其活性和稳定性。
因此,在实验检测过程中,可以通过预先调整温度和pH值来维持生物体状态。
4、脱水或催化作用蛋白质在一定的条件下,它可能会透过脱水反应的作用,或者由酶的催化活性,被活化或改变活性,以达成较大的化学反应,影响生物体的正常运作。
此外,蛋白质的部分残基也参与激酶活性的转换,从而影响蛋白质的结构和功能。
二、结论蛋白质是一种独具特性的物质,它不仅是活体组成的重要物质,而且具有独特的理化性质,例如温度、pH值、蛋白质结构以及脱水作用等。
这些理化特性既能反映到生物体的本质特性,又能在实验室中用于分析和定量。
因此,研究植物蛋白质的理化性质具有重要的理论和应用价值。
14.2.3 蛋白质的理化性质 Physical and Chemical Properties of Proteins讨论蛋白质的性质,一定要理解蛋白质分子的结构.蛋白质分子是具有生物活 性的大分子化合物,分子量很大.蛋白质分子具有一、二、三、四级结构,一级结构是蛋白质分子结构的基础。
蛋白质分子除主链(肽链)外,还有各种不同的侧链。
在这些侧链中,既有各种烃基,也有活泼的羧基、氨基、巯基、醇羟基和酚羟基等。
这些侧链基团有些是亲水基团;有些是疏水基团;有些是酸性基团;有些是碱性基团;有些裸露在二、三级结构外面;有些是掩蔽在二、三级结构的内部。
蛋白质分子内除主键(肽键)外,还有很多副键维持它的空间结构。
蛋白质的性质主要有如下几个方面: (1)蛋白质的两性性质和等电点。
蛋白质多肽链的N ―端有氨基,C ―端有 羧基,其侧链上也常有碱性基团和酸性基团。
因此,蛋白质和氨基酸相似,也具有两性性质和等电点。
调节溶液到某一pH 值时,蛋白质分子所带的正、负电荷相等,分子可成为两性离子,此时溶液的pH 值称为该蛋白质的等电点(pI )。
如果溶液的pH 值在等电点的酸侧,溶液中的H +会抑制羧基电离,并有利于氨基与H +结合,因而蛋白质的净电荷为正。
如果溶液的pH 值在等电点的碱侧,OH - 有利于羧基的电离,不利于氨基与H +结合,故蛋白质的净电荷为负。
因此,蛋白质和α―氨基酸溶液相似,也存在下列平衡关系。
如用H 2N ―Pr ―COOH 表示蛋白质分子,羧基代表分子中所有的酸性基团,氨基代表所有的碱性基团,Pr 代表其它部分,则: H2N Pr COO −H 3N COO -H 3N COOH ++pH>pI 等电点(pI )pH<pI 阴离子两性离子阳离子++ 不同的蛋白质具有不同的等电点,多数蛋白质的等电点小于7。
在动植物组织液中,pH 值一般在7―7.4之间,蛋白质大都以阴离子形式存在,并与两性离子达成平衡。
六、蛋白质的理化性质
1、两性解离溶液的pH大于某一蛋白质的等电点时,该蛋白质颗粒带负电荷,反之带正电。
R-CH-COOH→等电点(PI)→R-CH-COO—
▕净电荷为0 ▕
NH3+ NH2
2、胶体性质
(1)颗粒表面电荷(2)水化膜
胶体性质由这两个因素而来,去除这两个因素则蛋白质便容易析出。
3、蛋白质变性:在某些物理和化学因素下,其特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构。
(破坏了共价键,二硫键)
蛋白质水解才是破坏了肽键。
·复性:蛋白质在去除变性因素后恢复至原构象的现象。
(变形的蛋白质易于沉淀,但也不一定沉淀;有时蛋白质虽沉淀,但并未变性;蛋白质在变性因素去除后,也可能不复性)
·凝固:加热使蛋白质变性后进一步发展的不可逆结果,使之变成坚固的凝块。
4、☆特征吸收峰:280nm波长处
5、变色反应
(1)茚三酮(2)双缩脲
七、蛋白质实验方法
1透析、超滤
2盐析→变性
3电泳:十二烷基磺酸钠(SDS)→(加入至)蛋白质样与聚丙烯酰胺凝胶系统→蛋白质颗粒表面覆盖SDS→分子间电荷差异消失→使蛋白质在电场中泳动速率仅与蛋白质颗粒大小有关
4层析
5超速离心
6分析序列
(1)分析已纯化蛋白残基组成(2)测定多肽链N端、C端均为何种残基。
(3)把肽链水解为段,进行分析(4)测定各肽段氨基序列,一般用Edman降解法
(5)一般用数种水解法,分析出各肽段中氨基酸顺序。
7结构测定
圆二色光谱→二级结构
X射线衍射↘
核磁共振技术→三维空间结构。