第5节 强电解质溶液理论简介
- 格式:ppt
- 大小:104.00 KB
- 文档页数:10

第五章电解质溶液5.1本章学习要求1.了解电解质溶液的导电机理,掌握Faraday 电解定律。
2.掌握电导、电导率、摩尔电导率的基本概念、计算公式及测定方法。
3.掌握离子独立移动定律及其应用。
4.了解离子迁移数的概念及其测定原理。
5.掌握强电解质的离子平均活度系数的意义及计算。
5.2内容概要5.2.1离子的电迁移1. 电解质溶液导电机理在外电源电场的作用下,电解质溶液 (electrolyte solution) 中的正负离子分别向两个电极移动,迁移到电极附近的离子分别在两个电极上进行氧化或还原作用。
因此,正负离子分别向两个电极迁移以及电极反应这两个过程缺一不可。
2.Faraday 定律 ( Faraday′s law )数学表达式为:q = n∣Z∣F式中n 为电极上发生反应的物质的量 (mol) ,q 为通过的电量 (C) ,∣ Z∣为离子的电荷数的绝对值,F 为Faraday 常数,通常取值为F ·mol。
1 = 96485C电极上所通过的电量一般从电解过程中电极上析出或溶解的物质的量来精确推算,所用装置称为电量计或库仑计。
常用的有铜电量计、银电量计和气体电量计等。
3. 离子的电迁移 (ionic electromigration )(1)离子淌度(又称离子迁移率,ionic mobility )当电场稳定时,离子的迁移速率( υ与电势梯度 E l)呈正比,即υ=U E l ) (d /d · d /d式中 U 称为离子淌度,其物理意义是电势梯度为单位数值时的离子迁移速率,单位是 m · V · s 。
(2)离子迁移数 (transference number of ion)因为正、负离子移动的速率不同,所带电荷不等,所以每种离子迁移的电量不同,正、负离子共同承担导电的任务。
电解质溶液中各种离子迁移电量的百分数称为离子迁移数,用 t 表示,即t其中 q 为某种离子传输的电量,q 为通过溶液的总电量。




第五章电解质溶液前言1. 电化学在现代生活中应用十分广泛,主要工艺有电解和电镀2. 导体可分为电子导体和离子导体,顾名思义电子导体是由电子承担导电作用,温度升高,电阻增大(如金属)。
离子导体则刚好相反,且是由离子承担导电作用。
第一节法拉第定律一:法拉第定律(3)1.定律内容:再电极界面上析出的物质的物质的量与通入的电荷量成正比。
若将几个电极串联起来(通过电量相同)且所选取的基本单位也相同,那么析出的物质的物质的量也相同。
2.计算公式:Q=nZF 其中F为常量,数值等于96500 C/mol3.基本粒子的选取:注意法拉第定律中的物质的量和摩尔质量都是指基本单元的物质的量和摩尔质量。
我们规定用带电量为元电荷的粒子作为基本单元,例如H+和2421SO都可以做为基本单元。
二:离子的电迁移1.离子淌度:我们定义离子的迁移速率与两极间的电势差和极间距的商的乘积成正比,公式为u=U(dE/dl)。
其中U 为离子迁移速率。
(dE/dl)称为电势梯度。
我们可以用离子淌度表示离子的流动性。
2. 离子迁移数:我们定义一段时间内某离子通过产生的电量与总电量的比值叫做离子迁移数。
公式为t’=Q’/Q 此外还要知道两件事:(1) Q 总=Q 正+Q 负(2) t 正+t 负=1第二节 电导和电导率一:基本概念1. 电导:电阻的倒数成为电导,表示通电能力强弱(溶液的电导是各离子电导的和)2. 电导率:电阻率的倒数成为电导率,表示对电流阻碍能力大小 (电导率也可理解为单位长度单位面积的导体的电导)3. 摩尔电导率:我们为了消除浓度对电导率的影响引入了摩尔电导率,摩尔电导率就是电导率除以物质的浓度 他的单位是二:浓度对电导率的影响:通过大量的实验证明,当浓度足够小的时候,电导率随浓度时呈线性变化的,变化规律为 m m (1∞=-ΛΛ。
所以我们可以令c 近CV m m κκ==Λ1231mol m S m mol m S ---⋅⋅=⋅⋅似为0从而推出极限摩尔电导率。



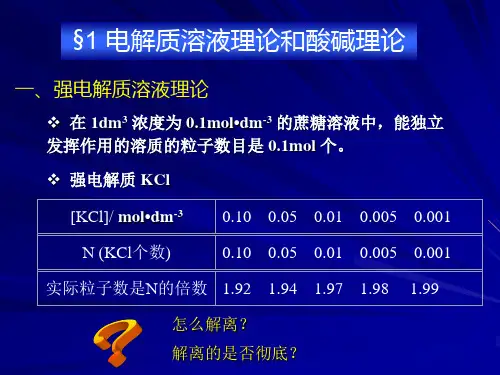
强电解质溶液理论目的与要求:1、了解离子互吸理论。
2、了解活度、活度因子和离子强度。
重点:离子互吸理论难点:活度和活度因子基本内容:一、离子互吸理论(ion-ion interaction theory)Question:强电解质在溶液中是完全解离的,其解离度理论上应等于1,然而根据溶液导电性实验测得的强电解质的解离度却小于1??Solution:1923年P. Debye和E. Hückel提出离子互吸理论1、离子互吸理论的理论要点:)强电解质在水溶液中是完全解离的;)离子间的静电作用,使得正、负离子周围形成了由异号电荷组成的“离子氛”;)离子氛的存在,离子间相互牵制,离子不是完全独立的自由离子,因此,在电场中离子移动的速度要比毫无牵挂的离子移动的慢,产生解离不完全的假象;)强电解质的解离度仅反映了溶液中离子间相互牵制作用的强弱程度,称为表观解离度;二、活度与活度因子Question:如何定量描述强电解质溶液中离子间的牵制作用??Solution:活度、活度因子、离子强度1、活度(activity,a)—— 电解质溶液中离子的有效浓度活度a B= γB·b B/ bØ2、活度因子(activity factor,γ)结论:a B<b B,故γB<1。
若γ值越大,越接近于1,则活度越接近浓度,表明离子间的牵制作用越小,离子活度的自由程度大。
Question:稀溶液、弱电解质溶液、难溶电解质溶液的活度、活度因子有何特点?3、平均活度(a±)及平均活度因子(γ±)−+±⋅=γγγ−+±⋅=a a a4、离子强度(ionic strength ,I )∑=⋅⋅⋅+++=223322221121)(21i i z b z b z b z b I 单位:mol·kg -1结论:离子浓度越大,电荷数越多,则离子强度越大,离子间的相互牵制作用越强,离子的平均活度因子越小;反之,离子浓度越小,电荷数越少,则离子强度越小,离子间的相互牵制作用越弱,离子的平均活度因子越大。

§7.5强电解质溶液理论简介*§7.5 强电解质溶液理论简介通过对强电解质溶液的系统研究,人们得出了两个重要的经验公式:科尔劳什经验公式和路易斯经验公式。
如何来解释这两个经验公式所展现的关系呢?因为路易斯经验公式是热力学的和静态的,理论处理相对容易,而科尔劳什经验公式是动力学的和动态的,其处理也相对复杂,因此,我们可以首先讨论路易斯经验公式并建立相关的理论,而后再处理科尔劳什经验公式。
1.德拜-休克尔离子活度理论因为理想溶液的化学势可以表示为ln B B B RT m μμ=+,而非理想溶液的化学势可以表示为ln ln B B B B RT m RT μμγ=++,因此,当将1 mol 的电解质从理想溶液转入非理想溶液中时,需要做的功可以表示为:Δ(,)ln 'B G T p RT W γ==- 因此,'ln B W RTγ=-(7.11)式(7.11)建立了活度系数与溶质转移过程中所做的有效功之间的联系。
所以,描述离子活度系数变化的关键是求算有效功。
对电解质溶液而言,显然这种有效功来源于离子由于静电吸引而导致的势能。
但由于电解质溶液的复杂性,给求解离子间的势能带领困难。
1918~1920年,高什(Ghosh)曾假设电解质溶液具有离子晶体的结构而试图求算该势能,但不成功。
直至1923年,德拜(Debye)和休克尔(Hückel)建立了“离子氛(ionic atmosphere )”模型,才较好地解决了电解质溶液中阴阳离子间的势能问题。
如图7.9所示,由于阴阳离子间的静电吸引,如果在一个阳离子周围选取一个小的立方体空间,则在此小立方体内由于阴离子出现的几率要比正离子大,导致该小体积带部分负电荷。
从统计力学观点看,在阳离子周围存在一个球形对称的负电荷氛围,称为“离子氛”。
离子氛的总电量与中心离子电量相等。
同理,在一个阴离子周围也存在一个正电的离子氛。
也就是说,在强电解质溶液中,每一个离子都作为“中心离子”而被带有相反电荷的离子氛包围;同时,每—个离子又对构成另一个或若干个其他中心离子的离子氛作出贡献。

11.7强电解质溶液理论简介11.7.1德拜—休克尔(Debye-Huckel)离子互吸理论溶液中粒子间互相作用对溶液的性质影响很大。
对电解质溶液,粒子间相互作用主要有离子间的相互作用和离子与溶剂分子间的相互作用。
1923年德拜和休克尔把物理学中的静电学和化学联系起来。
首先提出了强电解质离子互吸理论。
由于该理论是建立在强电解质是全部电离这一假设上,因此又称为非缔合式电解质理论。
此理论的要点是:∙离子间的相互作用力主要是库仑力。
而强电解质溶液与理想溶液的偏差是由库仑力引起的。
∙提出离子氛模型以简化理论分析。
将离子间存在着的库仑力归结为各中心离子与它周围的离子氛的静电引力。
∙借助于静电学理论和统计力学方法并引入适当假设,推导出德拜—休克尔极限公式。
下面就离子氛的概念及德拜—休克尔极限公式作简单介绍。
(1)离子氛(离子电迁移与离子氛动画观看)从宏观角度看,电解质溶液总是电中性的;而从微观角度看,一方面正、负离子间的库仑力要使离子象在晶格中那样作规则的排列而力呈有序的分布,另一方面热运动又将使离子处于杂乱分布。
由于热运动不足以抵消库仑力的影响,所以两种力相互作用的结果必然形成这样的情景:在一个离子(中心离子)的周围,异性离子出现的几率要比同性离子多。
因此可以认为,在每一个中心离子的周围,相对集中地分布着一层带异号电荷的离子。
我们将这层异号电荷所构成的球体称为离子氛。
见图11-12。
为了正确地理解离子氛,还需要在概念上明确几点。
a.在没有外加电场作用时,离子氛是球形对称的,离子氛的总电量与中心离子电量相等。
这是因为离子氛中的每一个离子是属于许多离子氛所共有的。
b.中心离子是任意选择的,溶液中的每一个离子均可作为中心离子,而与此同时它又是其他离子氛中的成员之一。
c.由于离子的热运动,中心离子并没有固定的位置,因此,离子氛是瞬息万变的。
由于离子氛连同被它包围的中心离子是电中性的,所以溶液中各个离子氛之间不再存在着静电作用。