酶促反应动力学实验
- 格式:doc
- 大小:84.00 KB
- 文档页数:7


酶促反应动力学实验报告酶促反应动力学实验报告摘要:本实验旨在研究酶促反应的动力学过程。
通过测量不同底物浓度下酶催化反应速率的变化,分析酶的催化特性和底物浓度对反应速率的影响。
实验结果表明,酶促反应速率与底物浓度呈正相关关系,但随着底物浓度增加,反应速率逐渐趋于饱和。
1. 引言1.1 酶的作用1.2 酶促反应动力学2. 实验方法2.1 材料准备2.2 实验步骤3. 实验结果与分析3.1 反应速率与底物浓度关系曲线3.2 酶活性计算公式及计算结果4. 讨论与结论4.1 反应速率与底物浓度关系解释4.2 实验误差及改进方案1 引言1.1 酶的作用酶是一类生物催化剂,能够加速生物体内化学反应的进行。
它们通常是蛋白质或核酸分子,并具有高度特异性。
在细胞内,酶参与调节代谢途径、合成新物质以及降解废物等重要生物过程。
1.2 酶促反应动力学酶促反应动力学研究酶催化反应速率与底物浓度、温度和pH等因素之间的关系。
其中,底物浓度是影响酶催化速率的重要因素之一。
当底物浓度较低时,反应速率随着底物浓度的增加而迅速增加;当底物浓度较高时,反应速率逐渐趋于饱和。
2 实验方法2.1 材料准备- 酶溶液:根据实验要求选择合适的酶溶液。
- 底物溶液:根据实验要求配置不同浓度的底物溶液。
- 缓冲液:用于维持实验环境中恒定的pH值。
- 试管或微孔板:用于进行反应混合和观察。
- 分光光度计:用于测量反应混合液的吸光度变化。
2.2 实验步骤1. 准备一系列不同浓度的底物溶液,并标明其浓度。
2. 在试管或微孔板中分别加入相同体积的酶溶液和不同浓度的底物溶液,混合均匀。
3. 将反应混合物放入分光光度计中,设置适当的波长并记录吸光度值。
4. 在一定时间间隔内,测量吸光度值的变化,并记录下来。
5. 根据实验数据计算反应速率。
3 实验结果与分析3.1 反应速率与底物浓度关系曲线根据实验数据绘制反应速率与底物浓度关系曲线。
实验结果显示,随着底物浓度的增加,反应速率也增加。

酶促反应动力学实验报告引言酶是一类催化化学反应的蛋白质,它们在生物体内发挥着至关重要的作用。
酶促反应动力学是研究酶催化反应速度的学科,通过实验可以深入了解酶催化反应的机理和动力学参数。
本实验旨在探究酶促反应的动力学特性,并对实验结果进行分析和讨论。
材料与方法材料•酶溶液•底物溶液•缓冲液•反应容器•定量移液器方法1.准备反应溶液:将一定量的酶溶液、底物溶液和缓冲液按一定比例混合,制备出合适的反应溶液。
2.设定实验条件:调节反应温度、pH值等实验条件,使其与生物体内环境接近。
3.开始反应:在反应容器中加入一定量的反应溶液,并立即启动计时器。
4.定时取样:在不同时间点,用定量移液器取出一定体积的反应液体样品。
5.快速停止反应:在取样后立即向反应容器中加入适量的反应停止剂,使反应迅速停止。
6.测定反应产物:使用合适的实验方法,测定取样时刻反应液中的反应产物的浓度。
结果与分析初始速率测定在实验中,我们首先对反应体系的初始速率进行了测定。
通过在不同时间点取样并快速停止反应,我们测定了不同时间点的反应产物浓度,并计算出了初始速率。
观察速率与底物浓度的关系为了探究反应速率与底物浓度之间的关系,我们固定其他实验条件不变,改变底物浓度,观察反应速率的变化。
通过在不同底物浓度下进行实验,并记录反应速率的数据,我们建立了速率与底物浓度之间的关系曲线。
实验结果显示,速率随着底物浓度的增加而增加,但达到一定浓度后,速率趋于饱和,不再随底物浓度的增加而增加。
酶催化反应的动力学方程根据实验结果,我们可以得到酶催化反应的动力学方程。
一般来说,酶催化反应的速率与底物浓度的关系可以用Michaelis-Menten方程描述:V = (Vmax * [S]) / (Km + [S])其中V为反应速率,[S]为底物浓度,Vmax为最大反应速率,Km为米氏常数。
结论酶促反应动力学实验通过测定酶催化反应的速率与底物浓度的关系,探究酶催化反应的动力学特性。


酶催化反应动力学的测定实验报告引言:酶是一类底物特异性高、效率高的蛋白质催化剂,对生命体的正常代谢过程具有重要的调控作用。
酶催化反应动力学是研究酶催化速率与底物浓度、温度等因素之间关系的实验方法。
本实验旨在通过测定过氧化氢酶催化过氧化氢分解反应速率随底物浓度变化的关系,探究酶催化反应的动力学特性。
实验材料与方法:1. 实验材料:- 过氧化氢酶储备液- 过氧化氢底物液- 磷酸盐缓冲液(pH 7.0)- 酶抑制剂:肼,对苯二酚2. 实验仪器:- 分光光度计- 温度控制设备- 酶解反应体系3. 实验步骤:1) 预先配制过氧化氢酶催化反应所需的底物液。
2) 准备一系列不同浓度的底物液,如0.2%、0.4%、0.6%、0.8%和1.0%。
3) 将每种底物液分别加入试管中,保持温度一致,加入过氧化氢酶储备液。
4) 使用分光光度计,以固定波长对反应过程进行连续测量,并记录反应速率随时间的变化。
5) 通过计算反应速率与底物浓度之间的关系,确定酶催化反应的动力学特性。
结果与讨论:本实验通过测定过氧化氢酶催化过氧化氢分解反应在不同底物浓度下的速率,得到了一组反应速率与底物浓度之间的数据。
根据实验数据,我们绘制出反应速率随底物浓度变化的曲线图。
实验数据表明,反应速率随底物浓度的增加而增加,但随着底物浓度继续增加,反应速率逐渐趋于饱和。
这反映了酶催化反应中的酶与底物结合能力饱和的特点。
为了进一步验证实验结果的可靠性,我们进行了反应速率对时间变化的监测。
结果显示,反应速率随时间的增加而逐渐减小,表明酶活性随着时间的推移会受到某种因素的限制,可能是酶活性的衰减或底物浓度的减少。
通过对实验数据的进一步分析,我们可以得到酶催化反应速率与底物浓度之间的动力学关系。
常见的动力学模型有米氏方程、麦克斯韦-伯尔赛方程等,它们可以描述酶催化反应速率与底物浓度之间的定量关系。
结论:通过本实验,我们成功测定了酶催化反应动力学特性。
实验结果显示反应速率与底物浓度之间存在一定关系,呈现出饱和曲线的特点。

酶促反应动力学实验报告14301050154 杨恩原实验目的:1.观察底物浓度对酶促反应速度的影响2.观察抑制剂对酶促反应速度的影响3.掌握用双倒数作图法测定碱性磷酸酶的Km值实验原理:一、底物浓度对酶促反应速度的影响在温度、pH及酶浓度恒定的条件下,底物浓度对酶的催化作用有很大的影响。
在一般情况下,当底物浓度很低时,酶促反应的速度(v)随底物浓度[S]的增加而迅速增加,但当底物浓度继续增加时,反应速度的增加率就比较小,当底物浓度增加到某种程度时反应速度达到一个极限值(即最大速度Vmax)。
底物浓度和反应速度的这种关系可用米氏方程式来表示(Michaelis-Menten方程)即:式中Vmax为最大反应速度,Km为米氏常数,[S]为底物浓度当v=Vmax/2时,则Km=[S],Km是酶的特征性常数,测定Km是研究酶的一种重要方法。
但是在一般情况下,根据实验结果绘制成的是直角双曲线,难以准确求得Km和Vmax。
若将米氏方程变形为双倒数方程(Lineweaver-Burk方程),则此方程为直角方程,即:以1/V和1/[S]分别为横坐标和纵坐标。
将各点连线,在横轴截距为-1/Km,据此可算出Km值。
本实验以碱性磷酸酶为例,测定不同浓度底物时的酶活性,再根据1/v和1/[S]的倒数作图,计算出其Km值。
二、抑制剂对酶促反映的影响凡能降低酶的活性,甚至使酶完全丧失活性的物质,成为酶的抑制剂。
酶的特异性抑制剂大致上分为可逆性和不可逆性两类。
可逆性抑制又可分为竞争性抑制和非竞争性抑制等。
竞争性抑制剂的作用特点是使该酶的Km值增大,但对酶促反映的最大速度Vmax值无影响。
非竞争性抑制剂的作用特点是不影响[S]与酶的结合,故其Km值不变,然而却能降低其最大速度Vmax。
本实验选取Na2HPO4作为碱性磷酸酶的抑制物,确定其抑制作用属于哪种类型。
实验步骤:实验一:底物浓度对酶促反应速度的影响1.取试管9支,将0.01mol/L基质液稀释成下列不同浓度:管号试剂2.另取9支试管编号,做酶促反应:管号试剂3.混匀,37 ℃水浴保温5分钟左右。
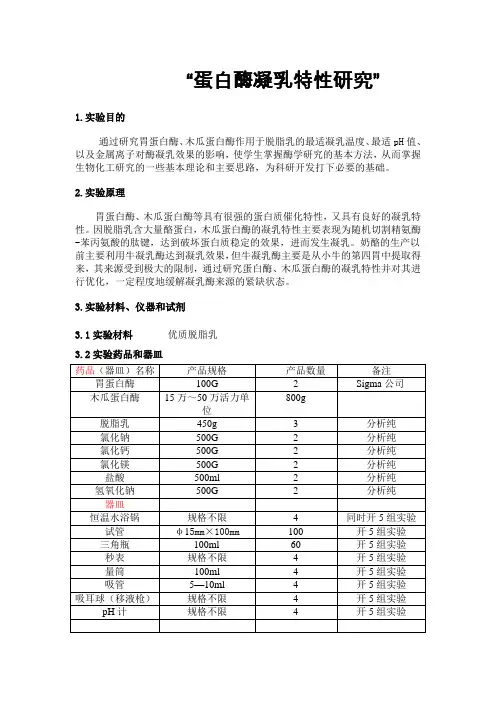
“蛋白酶凝乳特性研究”1.实验目的通过研究胃蛋白酶、木瓜蛋白酶作用于脱脂乳的最适凝乳温度、最适pH值、以及金属离子对酶凝乳效果的影响,使学生掌握酶学研究的基本方法,从而掌握生物化工研究的一些基本理论和主要思路,为科研开发打下必要的基础。
2.实验原理胃蛋白酶、木瓜蛋白酶等具有很强的蛋白质催化特性,又具有良好的凝乳特性。
因脱脂乳含大量酪蛋白,木瓜蛋白酶的凝乳特性主要表现为随机切割精氨酶-苯丙氨酸的肽键,达到破坏蛋白质稳定的效果,进而发生凝乳。
奶酪的生产以前主要利用牛凝乳酶达到凝乳效果,但牛凝乳酶主要是从小牛的第四胃中提取得来,其来源受到极大的限制,通过研究蛋白酶、木瓜蛋白酶的凝乳特性并对其进行优化,一定程度地缓解凝乳酶来源的紧缺状态。
3.实验材料、仪器和试剂3.1实验材料优质脱脂乳3.2实验药品和器皿3.3试剂(1)配制浓度为100g/L的脱脂乳1000ml,混匀后待用。
(5组)(2)配制浓度为10g/L的木瓜蛋白酶液和浓度为2g/L胃蛋白酶溶液各500ml,混匀后待用。
(5组)(3)配制0.1mol/L NaOH和0.1mol/L的HCl溶液各1000ml,用于调节溶液pH 值。
(5组)4.操作步骤4.1木瓜蛋白酶(胃蛋白酶)凝乳活力的测定取 5mL100g.L-1的脱脂乳,在65℃下保温5min,加入0.5mL10g.L-1的木瓜蛋白酶液(或胃蛋白酶液),迅速混合均匀,准确记录从加入酶液到乳液凝固的时间(s)。
把40min凝固1mL100g.L-1的脱脂乳的酶量定义为一个索氏单位(Soxhletunit),并以相对活性(RU)表示各因素的影响效果。
SU=(2400/T)×(5 / 0.5)。
式中:T为凝乳时间(s)RU(%)=(各因素下SU / 最大SU)×1004.2酶的最适凝乳温度的测定:分别在55,60,65,70, 75℃下测定酶凝乳活性。
4.3酶的热稳定性:酶液分别在55 ,60,65,70,75℃下处理10,30,60min后,测定酶的凝乳活性。



酶促反应动力学实验报告酶促反应动力学实验报告引言:酶是生物体内一类高效催化剂,能够加速化学反应速度而不参与反应本身。
酶促反应动力学研究了酶催化反应速率与底物浓度、酶浓度、温度和pH等因素之间的关系。
本实验旨在通过测定过氧化氢酶催化分解过氧化氢的速率,探究酶促反应动力学的基本原理。
实验方法:1. 实验前准备:准备所需试剂:过氧化氢溶液、过氧化氢酶溶液、缓冲液、辅助试剂等;准备所需仪器:分光光度计、计时器、试管、移液器等。
2. 实验步骤:(1) 预先调制一系列过氧化氢浓度的溶液,如0.1mol/L、0.2mol/L、0.3mol/L 等;(2) 在试管中加入一定量的缓冲液和过氧化氢酶溶液,使其浓度保持不变;(3) 在不同的试管中加入不同浓度的过氧化氢溶液,使其浓度逐渐增加;(4) 开始计时,记录下反应开始后一定时间内的吸光度变化;(5) 重复实验多次,取平均值。
实验结果:通过实验测得不同过氧化氢浓度下的吸光度变化数据,绘制出反应速率与过氧化氢浓度之间的关系曲线。
实验结果显示,随着过氧化氢浓度的增加,反应速率也随之增加,但当过氧化氢浓度达到一定值后,反应速率不再显著增加。
实验讨论:1. 底物浓度对酶促反应速率的影响实验结果表明,底物浓度对酶促反应速率有显著影响。
当底物浓度较低时,酶活性相对较低,反应速率较慢;而当底物浓度增加时,酶活性得到更充分的发挥,反应速率逐渐增加。
然而,当底物浓度达到一定值后,反应速率不再显著增加,这是因为酶的活性位点已经饱和,无法再催化更多的底物分子。
2. 酶浓度对酶促反应速率的影响实验结果还显示,酶浓度对酶促反应速率也有显著影响。
当酶浓度较低时,酶活性受限,反应速率较慢;而当酶浓度增加时,酶活性得到更充分的发挥,反应速率逐渐增加。
然而,当酶浓度达到一定值后,反应速率不再显著增加,这是因为底物浓度成为限制因素,酶浓度的增加无法进一步提高反应速率。
3. 温度和pH对酶促反应速率的影响温度和pH是酶活性的重要调节因素。

酶动力学综合实验实验(一)一一碱性磷酸酶值的测定【目的要求】1.了解底物浓度对酶促反响速度的影响2.了解米氏方程、值的物理意义及双倒数作图求值的方法。
【实验原理】1、碱性磷酸酶:碱性磷酸酶是广泛分布于人体各脏器器官中,其屮以肝脏为最多。
其次为肾脏、骨骼、肠和胎盘等组织。
但它不是单一的酶,而是一组同功酶。
本实验用的碱性磷酸酶是从大肠杆菌屮提取的。
2、米氏方程:在研究底物浓度与酶促反响速度的定量关系时,导出了酶促反响动力学的根本公式,即:V二卩机0卅[S]—K池十⑸(1)式屮:V表示酶促反响速度,也丈表示酶促反响最大速度,[S]表示底物浓度,心表示米氏常数。
3、心值的测定主要采用图解法,有以下四种:①双曲线作图法(图1-1, a)根据公式(1〕,以v对[s]作图,此时1/2$^时的底物浓度[s]值即为值,以克分子浓度W表示。
这种方法实际上很少采用, 因为在实验条件下的底物浓度很难使酶到达饱和。
实测是一个近似值,因而1/21^不准确。
此外由于v对[S]的关系呈双曲线, 实验数据要求较多,且不易绘制。
②作图法双倒数作图法(图1-1, b)实际工作屮,常将米氏方程(式(1)〕作数学变换,使之成为直线形式,测定要方便、准确得多。
其中之一即取(1〕式的倒数, 变换为方程式:丄=旦*丄+亠v Vmax [S] Vmax(2)以決堆1作图,即为形式。
此时斜率为怦,纵截距为产。
把直线U U V E*V EX外推与横轴相交,其截距相交,其截距即为一亡。
③作图法(略)把(2)式等号两边乘以V max,得:輕V+1v = —Km * 占 + V max(3)以V对着作图,这时斜率为-心,纵截距叽,横截距为-兽。
[AJ④作图法(略)把(2)式等号两边乘以[S],得:以旦对[s]作图,这时斜率为宀,纵截距为严。
I? V mar(b)本实验主要以双倒数法,即作图法来测定碱性磷酸酶值。
具体原理如下:本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯二钠产生酚和磷酸,在适宜条件下(10.0,和60°C),准确反响13分钟。
酪氨酸酶的提取及其酶促反应动力学研究一、实验目的1.认识生物体中酶的存在和催化作用,了解生物体系中在酶促反应的特点,认识一些生物化学过程的特殊性。
2.掌握生物活性物质的提取和保存方法,了解研究催化反应特别是生物化学体系中催化过程的基本思想和方法。
二、实验原理酶(enzyme)是由生物细胞合成的、对特定底物(substrate)起高效催化作用的蛋白质,是生物催化剂。
生物体内所有的化学反应几乎都是在酶的催化作用下进行的。
只要有生命活动的地方就有酶的作用,生命不能离开酶的存在。
在酶的催化下,机体内物质的新陈代谢有条不紊地进行着;同时又在许多因素的影响下,酶对代谢发挥着巧妙的调节作用。
生物体的许多疾病与酶的异常密切相关;许多药物也可通过对酶的作用来达到治疗的目的。
随着酶学研究的深入,必将对人类社会产生深远影响和作出巨大贡献。
酶的化学本质是蛋白质。
结构上,同样具有一、二、三级结构,有些酶还具有四级结构。
分子的化学组成上,有单纯酶和结合酶之分。
单纯酶分子是仅由蛋白质构成的酶,不含其他物质,如脲酶、活化蛋白酶、淀粉酶、核糖核酸酶等等。
结合酶分子是由蛋白质分子和非蛋白质部分组成,前者称为酶蛋白(apoenzyme),后者称辅助因子(cofactor)。
辅助因子是金属离子或有机小分子。
酶蛋白与辅助因子结合形成的复合物称全酶(holoenzyme),酶蛋白和辅助因子各自独立存在时,均无催化活性,只有全酶才有催化活性。
在酶促反应中酶蛋白决定着反应的专一性和效率,而辅助因子则决定着反应的种类和性质。
辅助因子按其与酶蛋白结合的紧密程度和作用特点,一般分为辅酶(coenzyme)和辅基(prosthetic group)。
辅酶是指辅助因子与酶蛋白结合松弛,没有固定的组成比,往往可用透析或超滤法除去,在反应中作为底物接受质子或基团后离开酶蛋白,参加另一酶促反应并将所携带的质子或基团转移出去,或者相反。
而辅基是指与酶蛋白结合比较紧密,与酶蛋白有一定的组成比,不能通过透析或超滤法除去,在反应中辅基不能离开酶蛋白。
“蛋白酶凝乳特性研究”1.实验目的通过研究胃蛋白酶、木瓜蛋白酶作用于脱脂乳的最适凝乳温度、最适pH值、以及金属离子对酶凝乳效果的影响,使学生掌握酶学研究的基本方法,从而掌握生物化工研究的一些基本理论和主要思路,为科研开发打下必要的基础。
2.实验原理胃蛋白酶、木瓜蛋白酶等具有很强的蛋白质催化特性,又具有良好的凝乳特性。
因脱脂乳含大量酪蛋白,木瓜蛋白酶的凝乳特性主要表现为随机切割精氨酶-苯丙氨酸的肽键,达到破坏蛋白质稳定的效果,进而发生凝乳。
奶酪的生产以前主要利用牛凝乳酶达到凝乳效果,但牛凝乳酶主要是从小牛的第四胃中提取得来,其来源受到极大的限制,通过研究蛋白酶、木瓜蛋白酶的凝乳特性并对其进行优化,一定程度地缓解凝乳酶来源的紧缺状态。
3.实验材料、仪器和试剂3.1实验材料优质脱脂乳3.2实验药品和器皿3.3试剂(1)配制浓度为100g/L的脱脂乳1000ml,混匀后待用。
(5组)(2)配制浓度为10g/L的木瓜蛋白酶液和浓度为2g/L胃蛋白酶溶液各500ml,混匀后待用。
(5组)(3)配制0.1mol/L NaOH和0.1mol/L的HCl溶液各1000ml,用于调节溶液pH 值。
(5组)4.操作步骤4.1木瓜蛋白酶(胃蛋白酶)凝乳活力的测定取 5mL100g.L-1的脱脂乳,在65℃下保温5min,加入0.5mL10g.L-1的木瓜蛋白酶液(或胃蛋白酶液),迅速混合均匀,准确记录从加入酶液到乳液凝固的时间(s)。
把40min凝固1mL100g.L-1的脱脂乳的酶量定义为一个索氏单位(Soxhletunit),并以相对活性(RU)表示各因素的影响效果。
SU=(2400/T)×(5 / 0.5)。
式中:T为凝乳时间(s)RU(%)=(各因素下SU / 最大SU)×1004.2酶的最适凝乳温度的测定:分别在55,60,65,70, 75℃下测定酶凝乳活性。
4.3酶的热稳定性:酶液分别在55 ,60,65,70,75℃下处理10,30,60min后,测定酶的凝乳活性。
(上述温度对凝乳特性研究,可根据实际情况,缩小两个水平间的差距)4.4 pH对酶凝乳效果的影响:用0.1mol/LHCl和0.1mol/L NaOH将100g/L的脱脂乳的pH调到6.0,6.5,7,7.5,8在65℃下测定酶的凝乳活性。
4.5 酶对pH的稳定性:用0.1mol/L HCl和0.1moL/LNaOH将酶液调到pH为4.0,5.0,6.0,7.0,8.0,室温下(约25℃)放置1h后,再将酶液pH调到6.0,在65℃下测定酶的凝乳活性。
(上述pH对凝乳特性研究,可根据实际情况,缩小两个水平间的差距)4.6 NaCl对酶活的影响:在酶液中添加0.2,0.5,0.8,1.1,1.5 (%)浓度的NaCl溶液,分别测定酶的凝乳活性。
4.7 Ca2+、Mg2+、K+对酶凝乳效果的影响:在乳液中添加CaCl2,MgCl2、KCl使其含量分别为0.2,0.5,0.8, 1.1,1.4 (%),然后测定酶的凝乳活性。
(上述离子对凝乳特性研究,可根据实际情况,缩小两个水平间的差距)五. 实验要求通过酶学实验研究,找出木瓜蛋白酶、蛋白酶的最适温度、最适pH 值、最适底物浓度以及那些金属离子对蛋白酶具有抑制作用、哪些离子具有促进作用。
画出趋势图或用表格加以说明。
最后写出总结报告,内容类似于研究论文(包括题名,摘要、关键词、前言和正文部分,最后还要有结论部分以及参考文献等)。
另外,实验前务必提交预习报告,否则不予参加实验。
酶促反应动力学—蔗糖酶米氏常数的测【目的要求】1.了解酶促动力学研究的范围。
2.以蔗糖酶为例,掌握测定米氏常数(Km)【实验原理】在酶促反应中,当反应体系的温度、pH 和酶浓度恒定时,反应初速度(v)则随底物浓度[S]的增加而加速,最后达到极限,称为最大反应速度(v)。
Michaelis 和Menten 根据反应速度与底物浓度的这种关系,推导出如下方程:][][S k S V v m +=此式称为米氏方程,式中Km 称为米氏常数,按此方程,可用作图法求出Km 。
方法有:1.以v[S]作图由米氏方程可知,v=V /2时,Km =[S]即米氏常数值等于反应速度达到最大反应速度一半时所需底物浓度。
因此,可测定一系列不同底物浓度的反应速度v,以v 对[S]作图。
当v =V /2时,其相应底物浓度即为Km 。
2.以1/v 对1/[S]作图取米氏方程的倒数式:VS V k v m 1][11+∙=以1/v 对1/[S]作图可得一直线,其斜率为Km /V ,截距为1/V 。
若将直线延长与横轴相交,则该交点在数值上等于—l /Km 。
本实验以蔗糖为底物.利用一定量蔗糖酶水解不同浓度蔗糖所形成的产物(葡萄糖和果糖)的量来计算蔗糖酶的Km 值。
葡萄糖和果糖能与3,5—二硝基水杨酸试剂反应,生成桔红色化合物,可于520nm 处比色测定之。
【试验材料】 1.试剂(1)标准葡萄糖溶液:准确称取100mg 葡萄糖溶于少量饱和的苯甲酸溶液(0.3%),再转移到100ml 容量瓶中,用饱和苯甲酸溶液稀释到刻度,混匀,即得浓度为1mg /m1的标准葡萄糖溶液。
冰箱贮藏可长期保存; (2)pH4.5的0.1mol/L 醋酸缓冲液:取lmol/L 醋酸钠溶液43m1及lmol /L 醋酸溶液57m1,稀释至1000m1即得; (3)pH4.5的10%蔗糖溶液:准确取l0g 蔗糖溶于少量pH4.5的0.1mol /L 醋酸缓冲液,转移到100ml 容量瓶中,用同样缓冲液稀释到刻度备用;(4)3,5—二硝基水杨酸试剂:溶液I :4.5%NaOH 溶液300m1,1%3,5一二硝基水杨酸溶液880m1及酒石酸钾钠(KNaC4O6·4H20)255g 三者一起混合均匀。
溶液Ⅱ:取结晶酚10g 及lo %NaOH 溶液22m1,加蒸馏水稀释成100ml ,混匀。
溶液Ⅲ:取6.9gNaHSO3溶于64ml 溶液n 中。
将溶液皿和溶液I 混合,激烈振摇混匀,即得3,5—二硝基水杨酸溶液,放置一周后备用。
(5)酵母蔗糖酶溶液:称取鲜酵母l0g 于研钵中,加少量细砂及10一15ml 蒸馏水研磨。
磨细后置冰箱中,过滤,滤液加2—3倍体积冷丙酮,搅拌均匀后离心,沉淀用丙酮洗两次,真空干燥得固体粉末状酶,再溶于100ml 蒸馏水,即得酶溶液。
若有不溶物可用离心法除去。
该酶液活力以6—12单位为佳。
蔗糖酶活力单位的定义为:在一定条件下反应5min ,每产生lmg 葡萄糖所需要的酶量。
备用。
2.器材(1)100m1三角烧瓶2只;(2)研钵1只;(3)50m1及100m1容量瓶各1只;(4)离心机1台(4000rpm);(5)糖管8支;(6)恒温水浴1台;(7)吸量管:1.0ml×2支;(8)秒表1只;(9)72l型分光光度计1台。
【实验方法】1.标准曲线的绘制后以零号管调零点,于520nm处测定吸光度。
以葡萄糖含量为横坐标,以吸光度为纵坐标作图。
2.根据活力选择酶浓度将10%蔗糖溶液稀释成pH4.5的6.5%的溶液,取此溶液5m1于试管中,共加两管。
将两管同时置于25℃水浴中保温5min,然后向管中加入蔗糖酶溶液1.0ml,立即混匀,同时用秒表计时,准确反应5min后,立即加入5ml0.1mol/LNaOH溶液终止酶反应。
另一管先加入5.0ml0.11mol/LNaOH溶液,再加入蔗糖酶溶液1.0ml(此为对照管)。
取干净糖管3支,第l、2管分别加入上述反应液各1.0ml及水各1.0m1,第3管加蒸馏水2.0ml,然后各管均加3.0ml二硝基水杨酸溶液。
置沸水浴中煮5min,取出后经自来水冷却3min,加水至25m1,混匀,以第3管调零点,于520nm处测吸光度值。
以测定管的吸光度值减去对照管吸光度值,求得的差值从标准曲线上查得相应的葡萄糖含量,并乘以ll,即为每1ml酶溶液的活力。
测定管中因酶催化水解而产生的葡萄糖含量以在0.4—1.6mg之间为佳,过高或过低均应适当改变蔗糖酶溶液的浓度或反应液用量后再测。
3.底物浓度对酶促反应速度的影响——米氏常数购测定取试管7支,按下表所示加入试剂。
当加完蔗糖溶液及pH4.5醋酸缓冲液后,均放置室温或恒温水浴(20℃或25℃)保温5min,再分别依次向各管加入蔗糖酶溶液1.0ml,立即摇匀.记录时间。
准确反应5min,再准时加入0.1mol/L的NaOH溶液,立即摇匀,以终止反应。
测定管反应完成后,取8支洁净糖管,前7支分别加入相应的上述反应液各1.0ml及蒸馏水各1.0ml,第8支糖管加入2.0ml蒸馏水作空白,然后各管均加入3.0ml 二硝基水杨酸溶液,沸水浴5min。
取出用自来水冷却3min,稀释到25m1,混匀,于520nm 处比色测定并记录吸光度值。
对照管的测定与测定管的操作相同。
【结果处理】根据各测定管的吸光度值(需减去相应对照管的吸光度值),从标准曲线上查出相应的还原糖毫克数(以在0.4一1.6mg范围内为佳,否则应调整反应液用量后重新测定),再乘以11,即得各管的产物量,然后分别计算各反应管相应的[S]、l/[S]、v及1/v,并作出v—[S]及1/v—1/[S]曲线。
再根据所作的两种动力学曲线,分别求出酵母蔗糖酶的Km值,并加以比较。
上述数据可记录在下表中。
酵母蔗糖酶的提取实验原理:蔗糖酶主要存在于酵母中,但工业上通常从酵母中制取。
酵母蔗糖酶系胞内酶,提取时细胞破碎或菌体自溶。
常用的提纯方法有盐析、有机溶剂沉淀、离子交换和凝胶柱层析。
以此可得到较高纯度的酶。
细胞破壁的几种方法1、高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
2、玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3、反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
4、超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料。
5、化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好。
有机溶剂沉淀法即向水溶液中加入一定量的亲水性的有机溶剂可降低溶质的溶解度使其沉淀被析出。
三、试剂:啤酒酵母、二氧化硅、甲苯(使用前预冷到0℃以下)、去离子水(使用前冷至4℃左右)、1mol / L 醋酸、95%乙醇四、仪器:研钵1个、离心管3个、 3. 滴管3个、量筒50ml 1个、水浴锅1个、恒温水浴、烧杯100ml 2个、广泛pH试纸、高速冷冻离心机四、操作步骤:1. 提取(1)准备一个冰浴,将研钵稳妥放入冰浴中。