发育生物学大实验报告
- 格式:wps
- 大小:536.50 KB
- 文档页数:13

发育生物学实验Experiments of Development Biology【课程编号】 【课程类别】限选课程【学分数】 3 学分 【适用专业】 生物科学【学时数】 96 学时 【编写日期】2009年9月15日一、教学目标通过本实验教学,使学生能掌握基本的发育生物学实验操作方法、正确使用仪器、准确取得实验数据,学会实验数据处理和科学表达实验结果的方法。
在确保基础实验训练的基础上,强化综合性实验技能训练,注重学生创新思维的培养和综合技能训练。
使学生对自己所学的解剖学, 生物化学,分子生物学等实验技术充分的实践, 学会用传统生物学方法和现代生物学方法验证动植物发育过程中的生物学现象,学会在科学实验中进行协作和配合;提高学生的科研能力,培养良好的科研素质。
二、教学内容和学时分配实验一、鸡胚培养和发育过程观察层次基础性主要内容:学习和掌握鸡胚胎发育所需要的条件,观察鸡胚胎发育的外部形态变化,掌握器官形成的基本规律。
明确环境因素对胚胎发育和健康的影响。
教学要求:了解鸡胚发育的大体阶段以及各阶段的形态特征;了解实验室鸡胚胎孵化的基本条件,明确环境对胚胎发育和健康胚胎的重要性。
实验二、鸡胚血管发生的阻断实验层次综合性主要内容:在上述鸡胚胎发育的外部形态变化观察的基础上,利用血管阻断剂,通过鸡胚操作,观察药物对血管发育的影响。
明确环境因素对胚胎血管发育和健康的影响。
教学要求:了解鸡胚血管发育的基本规律和形态特征;掌握实验室鸡胚血管阻断实验的基本方法,明确药物对胚胎血管发育和健康胚胎的重要性。
实验三、小鸡骨骼肌卫星细胞的分离、培养与发育观察层次综合性主要内容:在上述鸡胚胎发育的外部形态变化观察的基础上,在小鸡出壳后24小时, 分离培养肌肉组织的卫星细胞,观察骨骼肌卫星细胞的增殖分化能力。
并对分离得到的鸡骨骼肌卫星细胞表达卫星细胞特异的标志基因Desmin 和 Pax7 进行表达分析。
教学要求:了解鸡胚骨骼肌卫星细胞在发育中的作用,掌握鸡胚骨骼肌卫星细胞分离培养的基本方法。

第1篇一、实验目的通过本次实验,观察校园内常见生物的生长发育过程,了解生物的基本特征,培养观察、记录和分析的能力,增强对生物科学的兴趣。
二、实验时间2023年X月X日三、实验地点XX大学校园内四、实验材料1. 实验工具:放大镜、笔记本、记录表、相机等。
2. 实验对象:校园内常见的植物(如草本植物、树木)、昆虫(如蝴蝶、蚂蚁)、鸟类(如麻雀、鸽子)等。
五、实验方法1. 观察法:通过肉眼或放大镜观察生物的形态、行为、生长发育等特征。
2. 记录法:将观察到的现象详细记录在笔记本上,包括时间、地点、生物名称、特征描述等。
3. 分析法:对观察到的现象进行分析,探讨生物与环境的关系。
六、实验过程1. 观察植物- 时间:上午9:00-10:00- 地点:校园花坛、草坪- 观察对象:草本植物、树木- 观察内容:植物的生长速度、叶子的形状、颜色、花朵的开合等。
2. 观察昆虫- 时间:下午2:00-3:00- 地点:校园树林、草地- 观察对象:蝴蝶、蚂蚁- 观察内容:昆虫的活动范围、行为习性、繁殖方式等。
3. 观察鸟类- 时间:傍晚5:00-6:00- 地点:校园湖边、树林- 观察对象:麻雀、鸽子- 观察内容:鸟类的飞行姿态、鸣叫特点、觅食行为等。
七、实验结果与分析1. 植物观察结果- 草本植物生长迅速,叶色翠绿,花朵鲜艳,部分植物已进入花期。
- 树木生长稳健,枝叶茂盛,部分树木已结出果实。
2. 昆虫观察结果- 蝴蝶在花间飞舞,色彩斑斓,具有明显的性别差异。
- 蚂蚁在树木根部、土壤中活动,形成明显的群体。
3. 鸟类观察结果- 麻雀在树梢间跳跃,发出清脆的鸣叫声,群体觅食。
- 鸽子在湖边悠闲地散步,时而低头觅食,时而抬头望天。
4. 分析- 植物生长受光照、水分、土壤等因素的影响,不同植物对环境适应能力各异。
- 昆虫和鸟类在校园内形成食物链,相互依存,共同维持生态平衡。
- 生物在生长发育过程中,表现出明显的性别差异,有利于繁殖后代。

一、实验背景植物胚胎发育是植物生命历程中最重要的阶段之一,其研究对于揭示植物生长发育的分子机制具有重要意义。
细胞命运决定是胚胎发育过程中的关键环节,涉及到细胞分化、器官形成以及遗传信息的传递。
本研究以拟南芥为模式植物,通过基因敲除和基因过表达等手段,探究植物胚胎发育过程中细胞命运决定的分子机制。
二、实验材料与方法1. 实验材料(1)拟南芥植株(2)拟南芥种子(3)DNA提取试剂盒、PCR试剂盒、克隆试剂盒等分子生物学试剂2. 实验方法(1)基因敲除通过CRISPR/Cas9技术对拟南芥胚胎发育相关基因进行敲除,获得突变体植株。
具体操作步骤如下:①设计并合成目标基因的sgRNA序列;②将sgRNA序列克隆到CRISPR/Cas9表达载体中;③将表达载体转化拟南芥原生质体,筛选得到阳性转化子;④将阳性转化子转化拟南芥植株,获得突变体植株。
(2)基因过表达通过构建基因过表达载体,在拟南芥植株中过表达目标基因。
具体操作步骤如下:①设计并合成目标基因的启动子序列;②将启动子序列和目标基因序列克隆到过表达载体中;③将过表达载体转化拟南芥原生质体,筛选得到阳性转化子;④将阳性转化子转化拟南芥植株,获得过表达植株。
(3)形态学观察观察敲除和过表达植株的胚胎发育过程,记录胚胎发育过程中的形态变化。
(4)分子生物学分析通过PCR、RT-qPCR等方法检测敲除和过表达植株中目标基因的表达水平。
三、实验结果与分析1. 基因敲除结果通过CRISPR/Cas9技术敲除了拟南芥胚胎发育相关基因,获得了突变体植株。
观察突变体植株的胚胎发育过程,发现敲除基因的植株在胚胎发育过程中出现了明显的形态变化,如胚胎发育受阻、器官形成异常等。
2. 基因过表达结果通过构建基因过表达载体,在拟南芥植株中过表达了目标基因。
观察过表达植株的胚胎发育过程,发现过表达基因的植株在胚胎发育过程中表现出与野生型植株相似的胚胎发育过程。
3. 分子生物学分析结果通过PCR、RT-qPCR等方法检测敲除和过表达植株中目标基因的表达水平,发现敲除基因的植株中目标基因表达水平显著降低,而过表达植株中目标基因表达水平显著升高。

发育生物学实验报告【实验目的】1.学习掌握发育生物学常用实验方法之一RT-PCR,了解基因表达的研究方法;2.通过SDS-PAGE技术,研究果蝇总蛋白表达情况。
【实验方法】基因表达的研究方法:(一)转录水平-mRNA1.RT-PCR(Real-time RT-PCR)2.Microarray3.Northern blot4.RNA原位杂交(in situ hybridization)(二)翻译水平-蛋白质1.Western blot2.免疫组化(immunohistochemistry)发育生物学常用研究方法:RT-PCR,SDS-PAGE【实验原理】(一)背景知识1、基因表达:单拷贝基因表达存在逐步放大机制,如一个蚕丝心蛋白基因104个丝心蛋白mRNA(每个mRNA存活4d,可以合成105个丝心蛋白)共合成109个丝心蛋白。
因此单拷贝基因的mRNA表达水平对于其功能水平的调控是非常重要的。
2、PCR技术:即聚合酶链式反应。
在模板、引物和四种脱氧核苷酸存在的条件下依赖于DNA聚合酶的酶促反应,其特异性由两个人工合成的引物序列决定。
反应分三步:A、变性:通过加热使DNA双螺旋的氢键断裂,形成单链DNA;B、退火:将反应混合液冷却至某一温度,使引物与模板结合。
C、延伸:在DNA聚合酶和dNTPs及Mg2+存在下,退火引物沿5' 3'方向延伸。
以上三步为一个循环,如此反复。
3、逆转录酶和RT-PCR逆转录酶是存在于RNA病毒体内的依赖RNA的DNA聚合酶,至少具有以下三种活性:1、依赖RNA的DNA聚合酶活性:以RNA为模板合成cDNA第一条链;2、Rnase水解活性:水解RNANA杂合体中的RNA;3、依赖DNA的DNA聚合酶活性:以第一条DNA链为模板合成互补的双链cDNA.(二)RT-PCR的准备:1、引物的设计及其原则:1)引物的特异性决定PCR反应特异性。
因此引物设计是否合理对于整个实验有着至关重要的影响。

精子的发生及成熟精子的构造精巢为一管状腺,外面的白色套膜是白膜,精巢叶中含有很多曲细精管。
曲细精管内部结构:基膜支持细胞与精原细胞不同的是有核仁,细胞核卵形,染色质少五种细胞:精原细胞,初级精母细胞,次级精母细胞,精细胞,精子精子变形:细胞核在细胞的一端,含有密集的染色质,为头部,细胞质为尾部。
卵子发生及成熟卵子的构造卵巢结构:生发上皮,初级卵泡、生长中的卵泡,成熟卵泡(放射冠,紧贴卵母细胞的高层柱状卵泡细胞呈冠状排列卵母细胞和放射冠之间有一透明带,滤泡细胞和卵母细胞的分泌物质组成。
实验二草鱼卵巢组织学切片,卵细胞六个时期,精子五个时期各个时期实验三受精马蛔虫受精时卵细胞处于减一期雌核:卵子分出第二极体后染色体组成一核,雌核。
然后在卵细胞内形成雄性原核实验四文昌鱼早期胚胎发育①受精卵,文昌鱼时均黄卵②卵裂期:二细胞期,完全卵裂,第一次经裂四细胞期,第二次经裂,与第一次分裂面垂直,产生四个大小相等的分裂球八细胞期,第三次为纬裂,分裂面在赤道面上方,八个分裂球大小几乎相等十六细胞期及多细胞期③囊胚卵裂知128分裂球时,细胞发生重排,囊胚完全形成。
囊胚是一个中空的球体,中间为囊胚腔,四周为囊胚壁。
④原肠胚文昌鱼的原肠胚为具有两层细胞的腔状结构,中央的是原肠腔,原肠腔与外界相通的是胚孔。
⑤神经胚期神经板期,整个胚体外周为外胚层细胞,胚体背部中央外胚层加厚稍扁平,为神经板。
内层细胞为中内胚层,中央的腔为原肠腔。
神经沟期,神经板部位细胞下陷,形成神经沟,两侧隆起,为神经褶。
原肠背壁细的两侧中胚层带开始与背锁板及内胚层分离,并分节。
中胚层向背侧壁折叠形成肠体腔囊神经管期,神经褶向上向中央在背中线愈合成神经管。
肠体腔囊与原肠分开,形成成对的中胚层体节。
神经管腹面为椭圆形的脊索,原肠在背部愈合形成肠管,中央管腔为消化腔。
实验六蛙的早期胚胎发育受精卵,端黄卵,乱晃集中于植物极。
卵裂期:二细胞期,区别动物极和植物极,卵裂沟没有到达底部四细胞期,第二次卵裂仍为经裂八细胞期,第三次为经裂,赤道面以上,形成四大四小的八个分裂球多细胞期,以后的卵裂过程中,动物极的比植物极分裂的要快的多囊胚囊胚早期,分裂球大,数量小。

竭诚为您提供优质文档/双击可除水稻的发育生物学实验报告篇一:发育生物学实验发育生物学实验指导20XX-20XX学年第二学期20XX年4月2日实验一1原理卵巢表面为单层立方或扁平的表面上皮,上皮下方为薄层致密结缔组织构成的白膜。
卵巢实质分为皮质和髓质。
皮质含不同发育阶段的卵泡、黄体和白体,卵泡间结缔组织由低分化的梭形的基质细胞、网状纤维及散在的平滑肌纤维构成。
髓质有血管和淋巴管。
近卵巢门处有少量门细胞,其结构和功能类似睾丸间质细胞,可分泌雄激素,在Fsh和Lh刺激下,每个周期有一批卵泡发育,其中之一发育成熟并排卵。
卵泡的发育分为原始卵泡、初级卵泡、次级卵泡和成熟卵泡四个阶段。
①原始卵泡体积小,由一个初级卵母细胞和一层扁平的卵泡细胞构成。
初级卵母细胞为圆形,直径约40μm,核大而圆,染色浅,核仁明显,胞质嗜酸性。
初级卵母细胞是在胚胎时期由卵原细胞分裂分化形成,并停滞在第一次减数分裂前期,直至排卵前才完成分裂。
②初级卵泡为原始卵泡在Fsh的作用下发育形成。
初级卵母细胞增大,在靠近质膜的胞质中出现电子致密的溶酶体,称皮质颗粒。
卵泡细胞增生,由扁平变为立方形或柱状,由单层变为多层;最内一层卵泡细胞为柱状,呈放射状排列,称放射冠。
在初级卵母细胞与放射冠的卵泡细胞之间出现一层均质状、嗜酸性的透明带。
构成透明带的蛋白中,Zp3为精子受体。
③次级卵泡其内出现卵泡腔,腔内充满卵泡液;初级卵母细胞、透明带、放射冠及部分卵泡细胞突入卵泡腔内形成卵丘;卵泡腔周围的数层卵泡细胞形成卵泡壁,称颗粒层,卵泡细胞改称颗粒细胞。
初级卵泡和次级卵泡合称生长卵泡,其周围形成卵泡膜。
卵泡膜内层有多边形或梭形的膜细胞,具有分泌类固醇激素细胞的特征;外层有胶原纤维和平滑肌纤维,膜细胞合成雄激素,雄激素进入颗粒细胞,转化为雌激素,故雌激素由两种细胞联合产生。
④成熟卵泡在Lh刺激下,次级卵泡发育为成熟卵泡。
初级卵母细胞直径可达150μm。
由于卵泡液急剧增多卵泡体积显著增大,直径可超过2cm,并向卵巢表面突出。
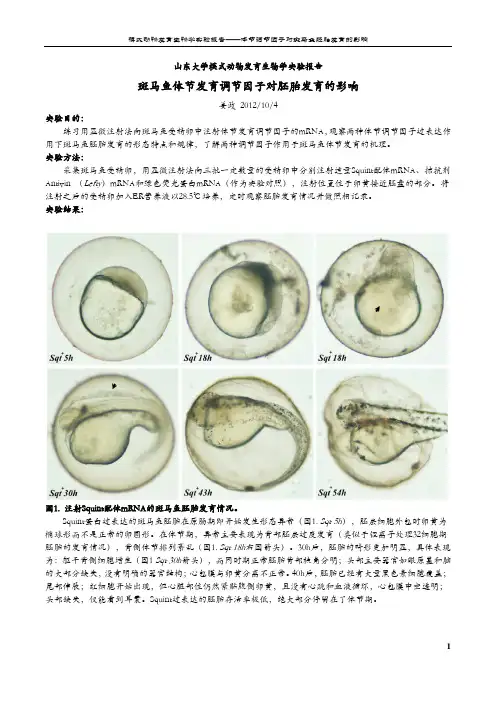



课堂号 560 课程名称:发育生物学实验主讲教师:汪家林学号 2010212810 姓名王芝成绩:性别女专业生物科学常用电子邮箱1390501534@利用果蝇总RNA进行RT-PCR制备cDNA并通过电泳的方法比较不同年龄阶段果蝇中蛋白质的表达情况前言:果蝇作为一种模式生物具有很多的优点:首先,果蝇体型小,体长不到半厘米;饲养管理容易,既可喂以腐烂的水果,又可配培养基饲料;一个牛奶瓶里可以养上成百只。
其次,果蝇繁殖系数高,孵化快,只要1天时间其卵即可孵化成幼虫,2-3天后变成蛹,再过5天就羽化为成虫。
从卵到成虫只要10天左右,一年就可以繁殖30代。
再次,果蝇的染色体数目少,仅3对常染色体和1对性染色体,便于分析。
作遗传分析时,研究者只需用放大镜或显微镜一个个地观察、计数就行了,从而使得劳动量大为减轻。
因此,本实验就运用果蝇作为实验材料,进行了一系列的实验。
摘要:先用Trizol试剂提取果蝇的总RNA,然后再通过琼脂糖凝胶电泳测定RNA的性质以确定此RNA是否可用于下游实验。
用SDS-聚丙烯酰胺凝胶电泳的方法分析不用年龄阶段的果蝇中各种蛋白质的表达情况。
关键词:果蝇总RNA 电泳 RT-PCR 蛋白质正文1.果蝇总RNA的提取1.1总RNA的提纯和纯化取果蝇成虫一只放入Trizol试剂中充分混合并研磨充分。
4℃、1 000 r/min 离心15 min,弃上清。
按照一定的比例加入TRIzol试剂,将沉淀转移至1.5 mL 离心管中,室温振荡5 min;再在每毫升TRIzol试剂中加入0.2 mL氯仿,剧烈振荡15 S,室温放置2~3 min;4 、12 000 r/min离心15 min。
此时,离心管中分为3层,即上层水相、中间相和下层有机相。
将上层水相转移至另一离心管中用于RNA提取,加入0.5 mL异丙醇,混匀,室温静置10 min;4~C、12 000 r/min离心15 min,弃上清;用1 mL 75%乙醇(用DEPC处理水配制)洗涤沉淀;风干,加适量经DEPC处理的水溶解沉淀,即是TRIzol法提取得到的RNA。

竭诚为您提供优质文档/双击可除水稻的发育生物学实验报告篇一:发育生物学实验发育生物学实验指导20XX-20XX学年第二学期20XX年4月2日实验一1原理卵巢表面为单层立方或扁平的表面上皮,上皮下方为薄层致密结缔组织构成的白膜。
卵巢实质分为皮质和髓质。
皮质含不同发育阶段的卵泡、黄体和白体,卵泡间结缔组织由低分化的梭形的基质细胞、网状纤维及散在的平滑肌纤维构成。
髓质有血管和淋巴管。
近卵巢门处有少量门细胞,其结构和功能类似睾丸间质细胞,可分泌雄激素,在Fsh和Lh刺激下,每个周期有一批卵泡发育,其中之一发育成熟并排卵。
卵泡的发育分为原始卵泡、初级卵泡、次级卵泡和成熟卵泡四个阶段。
①原始卵泡体积小,由一个初级卵母细胞和一层扁平的卵泡细胞构成。
初级卵母细胞为圆形,直径约40μm,核大而圆,染色浅,核仁明显,胞质嗜酸性。
初级卵母细胞是在胚胎时期由卵原细胞分裂分化形成,并停滞在第一次减数分裂前期,直至排卵前才完成分裂。
②初级卵泡为原始卵泡在Fsh的作用下发育形成。
初级卵母细胞增大,在靠近质膜的胞质中出现电子致密的溶酶体,称皮质颗粒。
卵泡细胞增生,由扁平变为立方形或柱状,由单层变为多层;最内一层卵泡细胞为柱状,呈放射状排列,称放射冠。
在初级卵母细胞与放射冠的卵泡细胞之间出现一层均质状、嗜酸性的透明带。
构成透明带的蛋白中,Zp3为精子受体。
③次级卵泡其内出现卵泡腔,腔内充满卵泡液;初级卵母细胞、透明带、放射冠及部分卵泡细胞突入卵泡腔内形成卵丘;卵泡腔周围的数层卵泡细胞形成卵泡壁,称颗粒层,卵泡细胞改称颗粒细胞。
初级卵泡和次级卵泡合称生长卵泡,其周围形成卵泡膜。
卵泡膜内层有多边形或梭形的膜细胞,具有分泌类固醇激素细胞的特征;外层有胶原纤维和平滑肌纤维,膜细胞合成雄激素,雄激素进入颗粒细胞,转化为雌激素,故雌激素由两种细胞联合产生。
④成熟卵泡在Lh刺激下,次级卵泡发育为成熟卵泡。
初级卵母细胞直径可达150μm。
由于卵泡液急剧增多卵泡体积显著增大,直径可超过2cm,并向卵巢表面突出。
发育生物学实验教案实验一植物生长调节剂对果实发育的影响一、实验目的1. 了解2,4-D、萘乙酸对无籽果实形成的诱导作用。
2. 了解乙烯对果实的催熟作用。
二、实验原理植物生长调节剂2,4-D、萘乙酸(NAA)等,在适当的浓度下能诱导无籽果实形成。
适当浓度的乙烯利能促进果实成熟。
三、试剂与材料1. 实验试剂20mg/L2,4-D(用少许1 mmol/L NaOH溶解2,4-D,再用蒸馏水定容),500mg/L NAA(用热水或少量95%乙醇溶解NAA,再用蒸馏水定容),40%乙烯利2. 实验材料盆栽番茄、辣椒幼苗,香蕉(或大蕉、柿子、芒果等)四、实验步骤1. 无籽果实的诱导形成(1)2,4-D诱导无籽果实在番茄开花授粉前用2-3滴20mg/L 2,4-D溶液涂在花上,以水处理作对照。
果实成熟时,观察果实内籽粒的有无。
(2)NAA诱导无籽果实在辣椒开花初期,用2-3滴500mg/L NAA溶液滴在花朵上(或喷花),以水处理作对照。
果实成熟时,检查是否有籽。
2. 乙烯利对果实的催熟作用将采收后的香蕉(或大蕉、柿子、芒果等)用500mg/L乙烯利溶液浸泡5s,以蒸馏水浸泡作对照,取出果实分别放在箩筐或纸箱内,室温保存。
5-10d之内,观察结果。
比较果皮的颜色和果实的成熟度五、注意事项1. 用植物生长调节剂处理材料的时期一定要把握好。
2. 可尝试使用不同的激素浓度,筛选出激素的最适作用浓度。
六、实验作业拍照记录实验结果(包括对照)并进行分析。
实验二人工诱发多倍体植物一、实验目的1. 了解人工诱发多倍体植物的原理、方法及其在植物育种上的意义。
2. 观察多倍体植物,鉴别植物染色体数目的变化及引起植物其它器官的变异。
二、实验原理自然界各种生物的染色体数目是相当恒定的,这是物种的重要特征。
例如玉米体细胞染色体有20个,配成10对。
遗传学上把一个配子的染色体数,称为染色体组(或称基因组)用)用n表示。
如玉米染色体组内包含10个染色体,它的基数n=10。
发育生物学实验报告篇一:遗传学实验-果蝇杂交实验实验报告传学设计性实验报告实验名称果蝇杂交实验学院生命科学学院专业生物技术班级名称学生姓名学号任课教师完成日期 XX年11月15日教务处制1前言1.1 实验目的通过实验验证分离规律、自由组合规律、伴性遗传和连锁互换规律,掌握果蝇杂交的实验技术和基因定位的三点测验方法,在实验中熟练运用生物统计的方法对实验数据进行分析。
1.2 实验原理果蝇(fruit fly)是双翅目(Diptera)昆虫,属果蝇属(genus Drosophila),约有3000多种,我国已发现800多种。
大部分的物种以腐烂的水果或植物体为食,少部分则只取用真菌,树液或花粉为其食物。
以果蝇作为遗传学研究的材料,利用突变株研究基因和性状之间的关系已近一百年,至今,各种研究遗传学的工具已达完善的地步,果蝇对今日的遗传学的发展有其不可磨灭的贡献;从1980年初,Drs. C. Nesslein-Volhard和E. Weichaus以果蝇作为发育生物学的模式动物,利用其完备的遗传研究工具来探讨基因是如何调控动物体胚胎的发育,也带动了其它模式生物(线虫、斑马鱼、小鼠和拟南芥等)的研究,且有非常具体的成果。
通常用作遗传学实验材料的是果蝇。
用果蝇作为实验材料有许多优点:⑴饲养容易。
在常温下,以玉米粉等作饲料就可以生长,繁殖。
⑵生长迅速。
十天左右就可完成一个世代,每个受精的雌蝇可产卵400~500个,因此在短时间内就可获得大量的子代,便于遗传学分析。
⑶染色体数少。
只有4对。
⑷唾腺染色体制作容易。
横纹清晰,是细胞学观察的好材料。
⑸突变性状多,而且多数是形态突变,便于观察。
果蝇的性别及突变性状的鉴别:果蝇的每一体细胞有8个染色体(2n=8),可配成4对,其中3对在雌雄果蝇中是一样的,称常染色体。
另外一对称性染色体,在雌果蝇中是XX,在雄蝇中是XY。
果蝇的雌雄在幼虫期较难区别,但到了成虫期区别相当容易。
一、实训目的1. 了解鸡卵的结构及其功能。
2. 观察鸡胚胎发育的各个阶段。
3. 掌握胚胎发育的基本规律。
4. 培养观察能力和实验操作技能。
二、实训时间2023年X月X日三、实训地点XX学院生物实验室四、实训器材1. 新鲜鸡蛋若干2. 剪刀3. 碗4. 显微镜5. 生理盐水6. 记录本五、实训步骤1. 准备工作- 将新鲜鸡蛋清洗干净,用生理盐水浸泡消毒。
- 将鸡蛋放在室温下孵化,每天观察记录。
2. 观察鸡卵结构- 将鸡蛋钝端向上,用剪刀轻轻敲碎卵壳,剥掉卵壳,观察卵黄、卵黄膜、胚盘、卵白、气室等结构。
- 记录各结构的位置、形态和功能。
3. 观察胚胎发育- 每天观察鸡蛋内部的变化,记录胚胎发育的各个阶段。
- 注意观察胚盘的大小、颜色、形态变化,以及胚胎的运动情况。
4. 显微镜观察- 将发育到一定阶段的胚胎取出,用生理盐水漂洗,制成玻片标本。
- 在显微镜下观察胚胎的细胞结构、器官形成等。
5. 数据分析与讨论- 分析鸡胚胎发育的规律,探讨外界环境对胚胎发育的影响。
六、实训结果1. 鸡卵结构- 卵黄:位于鸡蛋中央,呈黄色,富含营养物质,为胚胎发育提供能量。
- 卵黄膜:位于卵黄表面,具有保护作用。
- 胚盘:位于卵黄的一端,含有细胞核,是胚胎发育的场所。
- 卵白:位于卵黄周围,富含水分和营养物质,为胚胎发育提供营养。
- 气室:位于卵黄上方,贮存氧气,供胚胎呼吸。
2. 胚胎发育阶段- 初期:胚盘颜色较浅,胚胎细胞开始分裂。
- 中期:胚盘逐渐增大,颜色加深,胚胎开始形成器官。
- 晚期:胚胎发育成熟,器官功能完善。
3. 显微镜观察结果- 观察到胚胎细胞逐渐分裂,形成胚胎层。
- 观察到胚胎器官逐渐形成,如心脏、肝脏、肠道等。
4. 数据分析与讨论- 鸡胚胎发育受外界环境的影响较大,如温度、湿度等。
- 温度过高或过低都会影响胚胎发育,甚至导致胚胎死亡。
七、实训体会1. 通过本次实训,我了解了鸡卵的结构及其功能,掌握了鸡胚胎发育的基本规律。
鸡培发育实验报告引言鸡培发育实验是一种常用的生物学实验,旨在观察和研究鸡胚胎在不同时期的发育过程。
通过对鸡胚胎的观察和记录,可以了解鸡胚胎在不同发育阶段的形态变化以及器官的形成和发育。
本实验旨在探究鸡胚胎发育的时期和过程,为进一步研究动物胚胎学奠定基础。
材料与方法材料- 鸡蛋- 鸡蛋孵化器- 骨钳- 显微镜方法1. 将鸡蛋放入鸡蛋孵化器中,并设置合适的温度和湿度。
2. 每隔一定时间,从孵化器中取出一个鸡蛋。
3. 用骨钳小心地打开鸡蛋壳,暴露其中的胚胎。
4. 将胚胎置于显微镜下,通过显微镜观察胚胎的形态和结构。
5. 记录观察到的胚胎特征、器官发育情况等。
6. 放回鸡蛋孵化器继续孵化。
结果与讨论一天在孵化的第一天,观察到鸡蛋内的胚胎还处于胚胎磷酸钙填充阶段,其外表呈现无色凝胶状物质。
胚胎可以观察到鸡心、背脊和部分尾巴的初步形成。
三天经过三天的孵化,胚胎的形态发生了明显的变化。
鸡胚的眼睛和脑部开始形成,此时已经可以观察到眼珠和大脑的初步形态。
此外,鸡胚的肢脚也开始形成,骨骼和肌肉也开始发育。
五天经过五天的发育,鸡胚体的结构更加完整。
观察到鸡脑的发育更加明显,鸡胚的头部与身体也逐渐分化。
此时的胚胎已经具备形成鸡身体各个器官的潜力。
七天孵化的第七天,观察到鸡胚体的发育非常明显。
头部的器官已经发育完整,眼睛已经分化出虹膜和晶状体。
同时,鸡胚的四肢也发育出足发质和脚趾,并且骨骼变得更加坚硬。
十天经过十天的孵化,鸡胚体形态更加完全。
表皮和内脏器官的发育已经基本完成。
观察到骨骼和肌肉的进一步发育,并且开始形成消化、呼吸和循环系统等内脏器官。
十四天经过十四天的孵化,鸡胚体的发育已接近成熟。
观察到鸡胚体的羽毛已经开始生长,并且鸣翼等行为也开始出现。
鸡胚体的内脏器官已经成熟,包括心脏、肺部、肠道等。
结论通过对鸡胚胎的观察和记录,我们了解到鸡胚从形成初期到孵化前的发育过程。
在不同的发育阶段,观察到鸡胚的器官逐渐发育,形态不断完善。
发育生物学实验报告发育生物学实验报告引言发育生物学是研究生物体从受精卵到成熟个体的发育过程的科学。
通过实验研究,我们可以深入了解生物的发育机制,揭示生命的奥秘。
本实验旨在通过观察和记录昆虫的发育过程,探索其发育规律和影响因素。
材料与方法在实验中,我们选择了果蝇(Drosophila melanogaster)作为研究对象,因其短寿命、繁殖力强以及遗传学研究的便利性。
我们从实验室中获得了果蝇的受精卵,并将其放置在特定的培养基中。
我们将实验分为以下几个步骤:1. 取出果蝇受精卵:使用显微镜和细长的玻璃棒,小心地取出果蝇受精卵,并将其放入培养基中。
2. 培养受精卵:将培养基置于恒温箱中,保持适宜的温度和湿度条件。
观察受精卵的发育情况,并记录下来。
3. 观察幼虫的发育:当受精卵孵化为幼虫后,我们将其转移到新的培养基中。
每天观察幼虫的体长、体重和外部形态的变化,并记录下来。
4. 观察蛹的形成:当幼虫进入蛹化阶段时,我们将其转移到另一个培养基中。
观察蛹的外部形态变化,以及蛹壳的颜色和硬度的变化。
5. 观察成虫的出现:当蛹化完成后,成虫开始出现。
我们将其转移到新的培养基中,并观察其外部形态、行为特征和寿命。
结果与讨论通过实验观察和记录,我们得出了以下结论:1. 发育过程的时间:果蝇的发育过程相对较短,从受精卵到成虫出现,大约需要10-14天的时间。
其中,受精卵孵化为幼虫的时间约为3-4天,蛹化过程大约持续5-7天。
2. 发育过程的特征:果蝇的发育过程经历了受精卵、幼虫、蛹和成虫四个阶段。
每个阶段都伴随着特定的形态和生理变化。
例如,幼虫阶段的果蝇会经历多次蜕皮,体长和体重会不断增加。
3. 发育过程的影响因素:果蝇的发育过程受到多种因素的影响,包括温度、湿度、养料和遗传因素等。
例如,较高的温度可以加快果蝇的发育速度,而缺乏养料则会延缓其发育进程。
4. 遗传变异的观察:通过观察果蝇群体中的遗传变异现象,我们可以深入了解基因对发育过程的影响。
胚的发育实验报告《胚的发育实验报告》胚的发育是生物学中一个非常重要的研究课题,通过实验可以更加深入地了解胚胎在不同条件下的发育过程。
本文将介绍一项关于胚的发育实验,并对实验结果进行分析和讨论。
实验目的:本实验旨在观察不同条件下胚的发育情况,比较不同条件对胚的影响,并探讨可能的影响因素。
实验材料和方法:实验使用小鼠胚胎作为研究对象,将胚胎分为实验组和对照组。
实验组胚胎在不同温度、养分和环境条件下进行培养,对照组胚胎则在标准条件下培养。
观察和记录胚胎在不同条件下的发育情况,包括胚胎的大小、形态和分化情况等。
实验结果:经过一段时间的培养,实验组和对照组的胚胎都有了一定程度的发育。
然而,实验组的胚胎在不同条件下表现出不同的发育情况。
在高温条件下培养的胚胎发育较快,但形态不够完整;在低温条件下培养的胚胎发育较慢,但形态较为完整。
而在养分不足的条件下培养的胚胎则呈现出发育受阻的情况。
实验讨论:通过对实验结果的分析,我们可以得出结论:温度和养分是影响胚胎发育的重要因素。
高温会加快胚胎的发育速度,但可能导致形态不完整;低温则会减缓胚胎的发育速度,但形态较为完整。
养分不足则会影响胚胎的正常发育。
这些结果为我们进一步研究胚胎发育提供了重要的参考。
结论:通过本实验,我们对胚的发育过程有了更深入的了解,同时也为胚胎发育相关研究提供了一定的实验依据。
在今后的研究中,我们将进一步探讨胚胎发育的影响因素,并寻找更多可能的解释和应用。
希望通过这些研究,能够为生物学和医学领域的发展做出更大的贡献。
发育生物学实验报告【实验目的】1.学习掌握发育生物学常用实验方法之一RT-PCR,了解基因表达的研究方法;2.通过SDS-PAGE技术,研究果蝇总蛋白表达情况。
【实验方法】基因表达的研究方法:(一)转录水平-mRNA1.RT-PCR(Real-time RT-PCR)2.Microarray3.Northern blot4.RNA原位杂交(in situ hybridization)(二)翻译水平-蛋白质1.Western blot2.免疫组化(immunohistochemistry)发育生物学常用研究方法:RT-PCR,SDS-PAGE【实验原理】(一)背景知识1、基因表达:单拷贝基因表达存在逐步放大机制,如一个蚕丝心蛋白基因104个丝心蛋白mRNA(每个mRNA存活4d,可以合成105个丝心蛋白)共合成109个丝心蛋白。
因此单拷贝基因的mRNA表达水平对于其功能水平的调控是非常重要的。
2、PCR技术:即聚合酶链式反应。
在模板、引物和四种脱氧核苷酸存在的条件下依赖于DNA聚合酶的酶促反应,其特异性由两个人工合成的引物序列决定。
反应分三步:A、变性:通过加热使DNA双螺旋的氢键断裂,形成单链DNA;B、退火:将反应混合液冷却至某一温度,使引物与模板结合。
C、延伸:在DNA聚合酶和dNTPs及Mg2+存在下,退火引物沿5' 3'方向延伸。
以上三步为一个循环,如此反复。
3、逆转录酶和RT-PCR逆转录酶是存在于RNA病毒体内的依赖RNA的DNA聚合酶,至少具有以下三种活性:1、依赖RNA的DNA聚合酶活性:以RNA为模板合成cDNA第一条链;2、Rnase水解活性:水解RNANA杂合体中的RNA;3、依赖DNA的DNA聚合酶活性:以第一条DNA链为模板合成互补的双链cDNA.(二)RT-PCR的准备:1、引物的设计及其原则:1)引物的特异性决定PCR反应特异性。
因此引物设计是否合理对于整个实验有着至关重要的影响。
在引物设计时要充分考虑到可能存在的同源序列,同种蛋白的不同亚型,不同的mRNA剪切方式以及可能存在的hnRNA对引物的特异性的影响。
尽量选择覆盖相连两个内含子的引物,或者在目的蛋白表达过程中特异存在而在其他亚型中不存在的内含子。
2)引物设计原则的把握:引物设计原则包括a、引物长度:一般为15~30bp ,引物太短会影响PCR的特异性,引物太长PCR 的最适延伸温度会超过Taq酶的最适温度,也影响反应的特异性。
b、碱基分布:四种碱基最好应随机分布,避免嘌呤或嘧啶的聚集存在,特别是连续出现3个以上的单一碱基。
GC含量(Tm值):40%~60%,PCR扩增的复性温度一般是较低Tm值减去5~10度。
c、3'端要求:3'端必须与模板严格互补,不能进行任何修饰,也不能有形成任何二级结构的可能。
末位碱基是A时错配的引发效率最低,G、C居中间,因此引物的3'端最好选用A、G、C而尽可能避免连续出现两个以上的T。
d、引物自身二级结构:引物自身不应存在互补序列,否则会自身折叠成发夹状结构或引物自身复性。
e、引物之间的二级结构:两引物之间不应有多于4个连续碱基互补,3'端不应超过2个。
f、同源序列:引物与非特异扩增序列的同源性应小于连续8个的互补碱基存在。
g、5'端无严格限制:5'末端碱基可以游离,但最好是G或C,使PCR产物的末端结合稳定。
还可以进行特异修饰(标记、酶切位点等)等等。
根据实验目的选择适当的引物。
常用引物设计软件如Primer5.0,Oligo6.0等对于这些条件都可以自行设置。
2、耗材:实验所用的接触样品的耗材如冻存管、枪头、EP管之类事先都需经过0.1%DEPC水浸泡处理,除去RNA酶,防止操作过程中RNA降解。
然后经高压灭活(灭菌和灭活DEPC)。
3、试剂准备:变性液、水饱和酚、乙酸钠、氯仿、异丙醇、75%酒精、经DEPC 处理并高压的水。
(三)RNA的提取方法:RT-PCR中从细胞分离的RNA的质量至关重要,包括RNA的纯度和完整性。
RNA分离的最关键因素是尽量减少RNA酶的污染。
但RNA酶活性非常稳定,分布广泛,除细胞内源性RNA酶外,环境中也存在大量RNA酶。
因此在提取RNA时,应尽量创造一个无RNA酶的环境,包括去除外源性RNA 酶污染和抑制内源性RNA酶活性,主要是采用焦碳酸二乙酯(DEPC)去除外源性RNA酶,通过RNA酶的阻抑蛋白Rnasin和强力的蛋白质变性剂如异硫氰酸胍抑制内源性RNA酶。
【实验步骤】一、RT-PCR(一)Total RNA 提取(Trizol内含异硫氰酸胍等物质,能迅速破碎细胞,抑制细胞释放出的核酸酶;当加入氯仿时,它可抽提酸性的苯酚,而酸性苯酚可促使RNA进入水相,离心后可形成水相层和有机层,这样RNA与仍留在有机相中的蛋白质和DNA分离开。
水相层(无色)主要为RNA,有机层(黄色)主要为DNA和蛋白质。
)1、细胞或组织加Trizol(50mg/ml)后,匀浆。
室温放置5min,使其充分裂解。
2、4℃, 12,000g, 离心5min。
3、转移上清至一新EP管中,加入氯仿(200μl氯仿/ml Trizol),振荡混匀,室温放置1-5min。
4、4℃, 12,000g, 离心15min。
5、小心转移上层水相至新离心管中。
(注:千万不要吸取中间界面;若同时提取DNA和蛋白质,则保留下层酚相存于4℃冰箱,若只提RNA,则弃下层酚相)。
6、加入异丙醇(0.5ml异丙醇/ml Trizol),充分缓慢混匀,室温放5min。
7、4℃, 12,000g, 离心10min。
8、弃上清,加入1ml 75%乙醇,悬起管底沉淀。
9、4℃, 7,500g, 离心5min。
10、弃上清,室温干燥RNA沉淀。
(注:RNA样品不要过于干燥,否则很难溶解)。
11、溶解:加入50μl RNase free H2O溶解。
(可在55-60℃温育5-10min助溶)。
12、电泳检测或测OD值定量RNA浓度。
13、RNA样品电泳。
检测提取RNA的完整度。
14、注意事项:(1)Trizol有毒、具有腐蚀性。
(2)组织块不宜过大,需先剪碎组织,再充分研磨。
(3)高蛋白、脂肪或多糖类组织,组织匀浆后4℃12,000g 离心10min去掉不溶物及脂肪。
(4)Rnase非常稳定,是导致RNA 降解最主要的物质。
提取RNA过程中所用到的枪头、EP管、匀浆器等必须进行去RNase处理。
RNase广泛存在于人的皮肤上、唾液中,提RNA时必须带手套,最好戴口罩,穿实验服。
(二)反转录(以RNA为模板,利用Promega公司提供反转录试剂盒合成了第一链cDNA)1.取一只DEPC处理过的小EP离心管,向其中加入以下混合液,其体系如下:Total RNA 1 ulRNase-free H2O 4 ulOligo-anchor R 1 ul2.将混合液充分混匀并瞬时离心,置于70 ︒C孵育10 min后,立马在冰上冷却2 min,再次瞬时离心使得混合液集于管底;3.冰上继续向管中加入:5×Reaction Buffer 5 ulRibonuclease inhibitor(20 U/μL) 1.25 uldNTP Mix(10mM) 1.25 ulM-MLV Reverse Transcriptase 1 ulRNase-free H2O 10.5 ul4.将总反应液轻轻混匀瞬时离心,42 ︒C孵育60 min;5.最终转录产物用ddH2O水稀释适当倍数后作为PCR模板使用。
(三)PCR扩增1.PCR反应体系的组成:10×PCR Buffer (含Mg2+) 2.5uldNTP(10 mM each)0.5ul上游引物(10 μM)0.5ul下游引物(10 μM)0.5ulDNA template(cDNA,1:10) 1.0ulTaq DNA polymerase(2U/μl) 0.5uldd H2O 19.5ul总体积25ul2.PCR程序:预变性94 ℃2min变性94 ℃15s退火温度57℃15s延伸72 ℃30s 30 cycles延伸72 ℃5min3.注意事项:(1)Taq 酶要现用现取(2)取用PCR管要用镊子(3)小心取用,换枪头,不能污染!4.结果的检查:琼脂糖凝胶电泳(1)DNA电泳迁移率的对数与凝胶浓度成线性关系。
凝胶浓度的选择取决于DNA分子的大小。
(2)分离小于300bp的DNA片段所需胶浓度是2.0%,分离大于300bp 的DNA分子所需胶浓度为1.0%。
(3)琼脂糖电泳的电压是100v,5v/cm。
二、SDS-PAGE1. 提取果蝇总蛋白Buffer: TBS (20 mM Tris-HCl, 150 mM NaCl, pH7.9), 400ul(根据实际需要适量即可)5 蛋白上样缓冲液匀浆器、离心机、电磁炉2. SDS-PAGE检测果蝇总蛋白表达。
(1)凝胶制备制备凝胶板:①分离胶制备:按表配制20ml 10%分离胶,混匀后用细长头滴管将凝胶液加至长、短玻璃板间的缝隙内,约8cm高,用1ml注射器取少许蒸馏水,沿长玻璃板板壁缓慢注入,约3—4mm高,以进行水封。
约30min后,凝胶与水封层间出现折射率不同的界线,则表示凝胶完全聚合。
倾去水封层的蒸馏水,再用滤纸条吸去多余水分。
②浓缩胶的制备:按表配制10ml 3%浓缩胶,混匀后用细长头滴管将浓缩胶加到已聚合的分离胶上方,直至距离短玻璃板上缘约0.5cm处,轻轻将样品槽模板插入浓缩胶内,避免带入气泡。
约30min后凝胶聚合,再放置20—30min。
待凝胶凝固,小心拔去样品槽模板,用窄条滤纸吸去样品凹槽中多余的水分,将pH8.3 Tris-甘氨酸缓冲液倒入上、下贮槽中,应没过短板约0.5cm以上,即可准备加样。
(2)加样加样前沸水浴中加热1分钟,以消除亚稳态聚合。
加样体积为20μL。
用微量注射器贴在长玻璃板小心将样品还有Marker通过缓冲液加到凝胶凹形样品槽底部,可开始电泳。
(3)电泳将直流稳压电泳仪开关打开,电压调节至120V左右。
当蓝色染料迁移至底部时,电泳完成,关闭电源。
拔掉固定板,取出玻璃板,用刀片轻轻将一块玻璃撬开移去,将胶板移至大培养皿中染色。
(4)染色及脱色将染色液倒入培养皿中,染色1h左右,用蒸馏水漂洗数次,再用脱色液脱色,直到蛋白区带清晰。
(5)扫描条带用蛋白胶扫描仪扫描条带,得到样张。
【实验结果】一、提取RNA琼脂糖凝胶电泳结果(第5组)二、RT-PCR琼脂糖凝胶电泳结果图(第5组)三、果蝇总蛋白SDS-PAGE检测结果(从左到右依次为marker、蛹、幼虫、幼虫、成虫,小组做成虫)【结果讨论】一、就实验中出现的各种问题进行分析讨论。