冶金物理化学答案
- 格式:doc
- 大小:150.00 KB
- 文档页数:7


冶金物理化学答案冶金物理化学是研究金属和合金在制备、加工、合成和结构过程中物理和化学变化的科学。
它涵盖了从矿石到最终产品的整个过程,包括提取、分离、合成和加工。
冶金物理化学在工业和科学研究中扮演着重要角色,对于理解金属和合金的性质以及优化其制备过程至关重要。
在冶金物理化学的研究中,人们通常的是金属和合金的物理和化学变化,包括相变、扩散、还原和氧化等。
这些变化受到温度、压力、浓度和时间等因素的影响。
通过对这些变化的深入研究,人们可以更好地理解金属和合金的结构和性质,并优化其制备过程。
在工业生产中,冶金物理化学的应用广泛且重要。
例如,在钢铁工业中,冶金物理化学可以帮助人们理解钢铁的相变和结构,从而优化其制备和处理过程。
在铝工业中,冶金物理化学可以帮助人们理解铝的熔炼和铸造过程,从而提高铝的质量和性能。
除了在工业生产中的应用,冶金物理化学还在材料科学和工程领域发挥了重要作用。
通过对金属和合金的深入研究,人们可以开发出具有优异性能的新材料,例如高强度钢、轻质铝合金和高导电铜合金等。
冶金物理化学是理解和优化金属和合金制备和处理过程的关键。
通过深入研究和应用冶金物理化学,我们可以提高工业生产的效率和质量,同时推动新材料的发展和进步。
冶金物理化学是一门研究金属和合金的冶炼、分离、精炼和提纯的学科。
它主要涉及金属和合金的物理和化学性质,以及这些性质在冶炼、分离、精炼和提纯过程中的变化。
冶金物理化学的研究范围广泛,包括金属和合金的相图、热力学性质、动力学性质、电化学性质以及表面化学性质等。
它可以帮助我们了解金属和合金在不同条件下的物理和化学行为,从而指导冶炼、分离、精炼和提纯的过程。
在冶炼过程中,冶金物理化学可以用来确定最佳的冶炼方法和工艺参数。
例如,通过研究铁、锰、铬等金属的氧化还原反应,我们可以了解它们在不同温度和压力下的行为,从而优化它们的冶炼过程。
在分离过程中,冶金物理化学可以用来研究不同金属之间的相互作用,以及它们与分离剂之间的相互作用。

冶金物理化学学习指导及习题解答1.冶金热力学辅导热力学内容下四个部分1)冶金热力学基础2)冶金熔体(铁溶液、渣溶液)3)热力学状态图(Ellingham图,相图)注:把各个知识点划分成三个等级;最重要的等级―――“重点掌握”第二等级―――“掌握”,第三等级―――“了解”,这便于学习者在自学或复习内容时参考。
也便于在学习时能抓住重点,更快更好地掌握冶金物理化学这门重要基础学科。
1.1 冶金热力学基础共7个知识点1) 重点掌握体系中组元i 的自由能表述方法;(包括理想气体、液体、固体)理想气体的吉布斯自由能封闭的多元理想气体组成的气相体系中,任一组元i 的吉布斯自由能为ln i i i G G RT P ∅=+i P '-i 组分气体的实际压强,Pa ;P ∅-标准压强,Pa ,也即Pa 51001325.1⨯。
应该注意的是,高温冶金过程中的气体由于压强比较低,都可以近似看作理想气体。
液相体系中组元i 的吉布斯自由能在多元液相体系中,任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+其中,i a ----组元的活度,其标准态的一般确定原则是:若i 在铁液中,选1%溶液为标准态,其中的浓度为质量百分数,[%i]; 若i 在熔渣中,选纯物质为标准态,其中的浓度为摩尔分数,i X ;若i 是铁溶液中的组元铁,在其他组元浓度很小时,组元铁的活度定义为1。
固相体系中组元i 的吉布斯自由能在多元固相体系中,其中任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+i a 确定原则是:若体系是固溶体,则i 在固溶体中的活度选纯物质为标准态,其浓度为摩尔分数,i X ; 若体系是共晶体,则i 在共晶体中的活度定义为1; 若体系是纯固体i ,则其活度定义为1。
2)重点掌握化学反应等温方程式ln G G RT Q ∅∆=∆+G ∆有三种情况 1)0>∆G ,以上反应不可以自动进行;2) 0<∆G ,以上反应可以自动进行; 3) 0=∆G ,以上反应达到平衡,此时G RTLnK ∅∅∆=-注:(1)G ∆是反应产物与反应物的自由能的差,表示反应的方向(反应能否发生的判据);表示任意时刻(不平衡状态)的压强商或活度商。


冶金物理化学答案一、解释下列概念(每题5分,共20分)1.扩散脱氧:在炼钢过程中,根据分布规律,钢液中的[O]扩散到渣中,与加入渣相的脱氧元素发生的脱氧反应称为扩散脱氧。
2、炉渣:炉渣是火法冶金中以氧化物为主要成分形成的多组分熔体,是金属提炼和精炼过程中除金属熔体以外的另一产物。
3.硫容量:炉渣含有或溶解硫的容量,即CS?(%s)?(po2/ps2)1/24、偏摩尔量:在恒温、恒压及其他组分的物质的量保持不变的条件下,溶液的广度性质x(x代表u、h、v、s、g)对其组分摩尔量的偏微商值。
二、简短回答问题(共60分)1、简述热力学计算中活度标准态之间的转换关系。
答:(1)纯物质标准态活度与假想纯物质标准态活度的换算:ab[r]ab[h]?pb/pbpb/kh(x)*?kh(x)p*b?rb0故ab[r]?rbab[h]0(2)纯物质的标准态活度与1%质量溶液的标准态活度之间的换算:ab[r]ab[%]?pb/pbpb/kh(%)*?kh(%)pb*?mab100m?kh(x)pb*?mab100m?rb0(3)假设纯物质的标准态活度与1%质量溶液的标准态活度之间的换算:ab[h]ab[%]?pb/kh(x)pb/kh(%)?kh(%)kh(x)?mab100m2.简述了炉渣氧化脱磷的热力学条件。
答:根据炉渣的脱磷反应:lp?(%p2o5)[%p]2?kp(to)(êo)f542p?feo??cao?cap2o954根据上述公式,为了使脱磷反应完全,必要的热力学条件是:(1)炉渣碱度高;(2)氧化铁含量高;(3)较低的浴温;大渣量。
3.一氧化碳还原氧化铁的顺序是什么?写出反应方程式(天平)。
答:氧化铁被co还原在570℃以上及其下有不同的转变顺序,因此氧化铁还原是逐级的,反应如下:T570co3fe2o3(s)?有限公司?2fe3o4(s)?cofe3o4(s)?有限公司?3feo (s)?科菲欧(s)?有限公司?fe(s)?co2222t?570co3fe2o3(s)?co?2fe3o4(s)?co14fe3o5(s)?co?34fe(s)?co24.正常溶液的定义和热力学特征。

北京科技大学 2006—2007学年 第一学期冶金物理化学标准答案一、简答 (每小题5分,共50分)1. 试用相图的基本规则说明以下相图的错误所在?答:违背了相图的构筑规则“在二元系中,单相区与两相区邻接的界线延长线必须进入两相区,不能进入单相区”2. 在Ellingham 图上,为什么形成CO 的曲线的斜率为负值,而一般的斜率为正值? 答:CO O C 222=+ΘΘΘΘ−−=ΔC O CO S S S S 2202f ΘΘ−≈S S CO 0p ΘΔ−∴S ;∴ΘΔG ~T 曲线的斜率小于零。
同理可以证明一般反应的~T 曲线的斜率大于零。
ΘΔG 3. 简述分子理论的假设条件。
答:1)熔渣是由各种电中性的简单氧化物分子、CaO 、MgO 、、、及它们之间形成的复杂氧化物分子FeO 32O Al 2SiO 52O P 2SiO CaO •、22SiO CaO •、、等组成的理想溶液。
22SiO FeO •52O P CaO •2)简单氧化物分子于复杂氧化物分子之间存在着化学平衡,平衡时的简单氧化物的摩尔分数叫该氧化物的活度。
以简单氧化物存在的氧化物叫自由氧化物;以复杂氧化物存在的氧化物叫结合氧化物。
如:()=2()+() 22SiO CaO •CaO 2SiO 2222SiO CaO SiO CaO D x x x K •=由K D 计算的x CaO 及x SiO2叫及的活度。
CaO 2SiO 4. 试解释正规溶液定义。
答:过剩混合热(其实为混合热)不为零,混合熵与理想溶液的混合熵相同的溶液叫正规溶液。
5. 试从热力学原理说明熔渣的氧化还原性? 答:定义∑FeO 0表示渣的氧化性。
决定炉渣向钢液传氧的反应是()=FeO [][]Fe O +[]FeOa O K00=Θ或[]FeOa O L 000=令[]FeOa O L00'0=----代表实际熔渣中的值。
当时,'oL f 0L f 0'0'00ln ln ln L L RT L RT L RT G =+−=Δ0,反应逆向进行,钢液中的氧向熔渣传递;当时,='oL p 0L G Δ0'0ln L L RT 0p ,反应正向进行,熔渣中的氧向钢液传递。



装 订 线 内 不 得 答 题自觉遵 守考 试 规 则,诚 信 考 试,绝 不作 弊3、完全离子溶液形成时其混合焓为零。
阳离子与阳离子、阴离子与阴离子分别形成理想溶液;4、碱性氧化物以简单阳离子存在,酸性氧化物以复杂阴离子存在。
故,完全离子溶液=理想阳离子溶液+理想阴离子溶液,且++=22M M x a ,++=22O O x a4.试写出正规溶液定义。
解:正规溶液定义:过剩混合热不为零(Δmix H m E ≠0),过剩混合熵为零的溶液(Δmix S m E=0)叫做正规溶液。
5.试写出硫容量的一种表达式。
解:当气相分压小于0.1Pa 时,硫以硫化物的形式存在。
硫化物容量表示为:⎪⎪⎭⎫⎝⎛⋅⋅=⎪⎪⎭⎫ ⎝⎛⋅=--∑2222)32()(2/1%S O S O S a n K p p S w C γθ 当体系的气相分压大于0.1Pa 时,渣中硫以硫酸盐形式存在,定义硫酸盐的容量为:2/12/3%22)(⎪⎪⎭⎫ ⎝⎛⋅⎪⎪⎭⎫ ⎝⎛=θθp p p p S w C S O S6.简述有效边界层的定义。
答:当流体速度为u b 的粘性流体绕固体表面流动时,由于表面的摩擦作用在固体表面附近会形成具有很大速度梯度的区域。
在固体表面上流体速度u x 为零,而在距固体表面一小距离处,流体速度就等于99%的流体本体速度u b 。
这个区域叫速度边界层,距固体表面这一距离称为速度边界层厚度δu 。
当含某一组元A 浓度为C b 的流体绕固体表面流动时,如果由于流体与固体表面含组元A 的浓度不同,则会在固体垂直方向建立起浓度梯度。
在固体表面上组元A的浓度为C s ,而在距固体表面一小距离处,组元A 的浓度就降到99%的流体本体浓度C b 。
这个区域叫浓度边界层,距固体表面这一距离称为浓度边界层厚度δc 。
为了数学上的处理方便,将分子扩散(D )和湍流传质(ED )折算成稳态的分子扩散,为此由浓度为C s 的固体表面点作浓度曲线的切线,使之与本体浓度C b 的延长线相交于一点,过这点作一平行于固体表面的平面,该平面与固体表面之间的区域称为有效边界层,其厚度用δc ′表示。
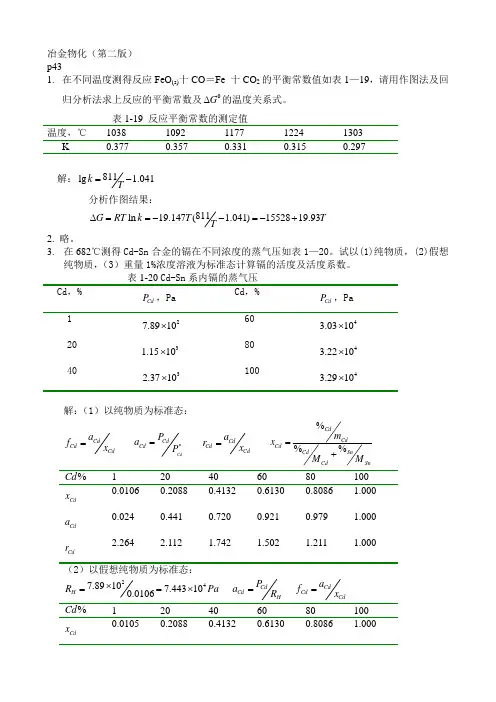
冶金物化(第二版) p431. 在不同温度测得反应FeO (s)十CO =Fe 十CO 2的平衡常数值如表1—19,请用作图法及回归分析法求上反应的平衡常数及0G ∆的温度关系式。
表1-19 反应平衡常数的测定值 温度,℃ 1038 1092 1177 1224 1303 K 0.377 0.357 0.331 0.315 0.297解:811lg 1.041k T=-分析作图结果:811ln 19.147( 1.041)1552819.93G RT k T T T∆==--=-+2. 略。
3. 在682℃测得Cd-Sn 合金的镉在不同浓度的蒸气压如表1—20。
试以(1)纯物质,(2)假想纯物质,(3)重量1%浓度溶液为标准态计算镉的活度及活度系数。
Cd P ,Pa Cd P ,Pa 1 27.8910⨯ 60 43.0310⨯ 20 31.1510⨯ 80 43.2210⨯ 40 32.3710⨯10043.2910⨯解:(1)以纯物质为标准态:CdCd Cd a f x =CdCdCd P a P *=CdCd Cd a r x =%%%CdCd Cd CdSnCdSnm x M M =+%Cd120 40 60 80 100 Cd x 0.0106 0.2088 0.4132 0.6130 0.8086 1.000 Cd a0.024 0.441 0.720 0.921 0.979 1.000 Cd r2.2642.1121.7421.5021.2111.000(2)以假想纯物质为标准态:247.89107.443100.0106H R Pa ⨯==⨯ CdCd H P a R =CdCdCd a f x =%Cd120 40 60 80 100 Cd x0.0105 0.2088 0.4132 0.6130 0.8086 1.000Cd a Cd f1.0000.9330.7700.6640.5350.44227.89101%i i DK Pa ==⨯ %%Cd Cda f =%Cd120 40 60 80 100 Cd a1.000 18.38 30.04 38.40 40.81 41.70 %f1.0000.9170.7510.6400.5700.4174. A-B 系合金在1000K 时组分A 的蒸气压如表1-21。

P1881.试计算高炉中炉气的CO 2为16%的区域内。
总压为126656.25Pa 时,石灰石的分解温度和沸腾温度。
CaO 3 =CaO CO 2. :G ° =1 7 0 5 77 1 4T4. 1 98908 lg P CO 2 = 7.53- P CS 20265 ° - P CO 2 =— = ------------- =0.22P- 101325T =1082.5KT =1198.4K2.根据氧势图, 求Fe 2O 3分解在大气中分解的开始温度和沸腾温度,并与 Fe 2O 3分解压的热力学计算值进行比较。
P)2'也=苛=0.21 % =0.21 101325Pa连接 “O” 与 P 2=10皿87 点,T=1380 C沸腾 P O =1=10° T=1460 C 计算:6Fe 2O 3 =4Fe 3O 4 0200= 58 67 70 3 4T0. 2 0开始分解:T 开=1338 C沸腾:T 沸=1451 C 3.把5X10~kg 的碳酸钙放在体积为1.5乂10誓m 3真空容器内,加热到800C ,问有多少kg 的 碳酸钙未能分解而残留下来。
CaO 3 =CaO CO 2G 0 =1 7 0 577 1 4T4. 19①开始分解P'CO 2 =P 总、勺6%= 126656.2 0.16 =20265Pa ②沸腾时:P CO 2=P 总、P C O 2普=1.25IgP o^ =30645.517.77_。
8908T=800C ( 1073K) Ig F CO 2 = —+7.53F C O 2 =0.169.F C O =0.169 101.325Pa =17124Pa 按理想气体处理,分解的CO 2量则分解的CaO 3摩尔数为n = 0.00288molm = 100g / mol 0.00288mol = 0.288g:m =0.5 103 -0.288 10^ =0.212 10°kg5.用空气/水汽=3(体以比)的混合气体去燃烧固体碳。
第一部分《冶金实验研究方法》主要教学内容一、课程的性质与任务:冶金试验研究方法包括“高温冶金物理化学研究的基本技术”和“高温冶金物理化学实验研究方法"两部分内容。
本课程是冶金工程专业的一门主要专业课程,为必修课程。
本课程的基本任务:掌握冶金实验的基本理论和基本技能;能够进行冶金学科方向的科学实验和数据处理。
二、课程的基本内容及要求:第一部分高温冶金物理化学的基本技术第一章实验室的高温获得主要内容(1)冶金实验的高温特点(2)获得高温的方法:电阻炉、感应炉、电弧炉和等离子炉等高温炉的内容(重要)(3)电阻炉恒温带概念、测定意义和方法(4)冶金常用金属和非金属电热体的种类、特点和选择第二章温度测量方法主要内容(1)温标及温度的测量方法(2)热电偶的工作原理、结构和使用(重要)(3)辐射温度计的工作原理,介绍常用几种辐射温度计第三章实验室用耐火材料(了解)内容(1)耐火材料的性能指标(2)常用耐火材料化合物(3)耐火材料的制造工艺以及常见问题第四章气体净化及气氛控制1、主要内容(1)气体储备和安全使用: 防毒、防火、防爆(使用常识)(2)常用气体净化方法:吸收、吸附、催化和冷凝及其内容 (掌握)(3)常用的气体净化剂:干燥剂、脱氧剂和吸附剂,其中分子筛吸附原理是重要内容(4)气体流量的测定:转子流量计(常识)和毛细管流量计(了解)第五章真空技术1、主要内容(1)了解真空技术对冶金工业发展的意义(2)真空的概念和真空度的分类(常识)(3)真空泵的类别和机械真空泵、双级泵工作原理及安全使用(掌握)(4)真空规测量真空度麦克劳真空规、热电阻真空规、热电偶真空规和热阴极电离真空规的原理和使用(掌握)第二部分高温冶金物理化学的实验研究方法第七章量热技术(了解量热的概念)第八章固体电解质的原理及应用主要内容(重要)(1)固体电解质的概念和导电机理(2)氧化物固体电解质电池的工作原理(3)固体电解质传感器的设计与使用(自学)(4)固体电解质氧电池在炼钢中的应用第九章化学平衡的研究主要内容(1)化学平衡的研究内容(了解)(2)实验研究的技术步骤高温炉的选择、建立化学位、氧位的建立和控制、平衡时间的确定、取样、选择坩埚(掌握)(3)化合物和熔体组元热力学数据确定(掌握)第十章相平衡的研究动态法和静态法测定相图的原理第十二、十三、十四章熔体物理性能的测定主要内容(重要)(1)概述熔体物性的研究在冶金研究中的地位(2)表面张力的测定原理和测定方法,其中概念:表面活性物质、表面张力和温度的关系等知识点要掌握(3)密度的测定原理和测定方法(4)粘度的测定原理和方法,其中粘度和温度的关系、粘流活化能、熔化性温度概念要掌握(5)电导率的概念和单位要掌握第十六章热分析技术(重要)1.主要内容(1)热分析技术的定义、分类和研究应用(2)差热分析技术DTA的原理和方法(3)差示扫描量热技术DSC的原理和方法(4)热重技术TG的原理和方法第十七章夹杂物及物相分析主要内容(1)夹杂物的概念、在钢铁中的作用和分类(了解)(2)物相分析定义和分析方法:显微分析法金相法、显微硬度法、化学腐蚀法、岩相法(概念要掌握)(3)相的提取和分离技术:化学提取、电解法、物理分离法(了解)第十九章冶金反应工程学研究(重要)主要内容(1)冶金反应工程学的概念、研究内容和方法(2)停留时间分布法表示方法和实验测定等(3)物理模拟法数学模型法和数学模拟法的概念和应用第二十章实验设计方法(重要)主要内容(1) 概述实验设计对实验研究的重要作用(2) 正交实验设计法的定义和设计步骤说明:未涉及到的教材章节作为自学内容。
一、解释下列概念(每题5分,共20分)1、扩散脱氧:在炼钢过程中,根据分配定律钢液中的[O]向熔渣中扩散,而与加入渣相中的脱氧元素进行的脱氧反应称为扩散脱氧。
2、炉渣:炉渣是火法冶金中以氧化物为主要成分形成的多组分熔体,是金属提炼和精炼过程中除金属熔体以外的另一产物。
3、硫容量:炉渣容纳或溶解硫的能力,即2/122)/()(%S O S P P S C ⨯=。
4、偏摩尔量:在恒温、恒压及其他组分的物质的量保持不变的条件下,溶液的广度性质X (X 代表U 、H 、V 、S 、G )对其组分摩尔量的偏微商值。
二、简答题(共60分)1、简述热力学计算中活度标准态之间的转换关系。
答:(1)纯物质标准态活度与假想纯物质标准态活度之间的转换:][0][0*)()(*][][//H B B R B BBx H x H B B B H B R B a r a r pK K p p p a a ====故(2)纯物质标准态活度与质量1%溶液标准态活度之间的转换:*)(*(%)(%)*[%]][100100//B BA Bx H BA BH H B B B B R B r MMp K MMp K K p p p a a ⨯=⨯===(3)假想纯物质标准态活度与质量1%溶液标准态活度之间的转换:BA x H H HB x H B B H B MMK K K p K p a a 100//)((%)(%))([%]][===2、简述炉渣氧化脱磷的热力学条件。
答:由炉渣脱磷反应可知:9245245252)(%)(%][%)(%O CaPCaOFeO PP P fCaO FeO K P O P L γγγ⋅==由上述公式可知,为使脱磷反应进行完全,必要的热力学条件是: (1) 较高的炉渣碱度; (2) 较高的氧化铁含量; (3) 较低的熔池温度;大渣量。
3、铁氧化物被CO 还原的顺序是什么?写出反应方程式(配平)。
答:氧化铁被CO 还原在570℃以上及其下有不同的转变顺序,因此氧化铁还原是逐级的,反应如下:25324332224324332)(43)(41)(2)(3570)()()(3)()(2)(3570COs Fe CO s O Fe CO s O Fe CO s O Fe Ct COs Fe CO s FeO CO s FeO CO s O Fe CO s O Fe CO s O Fe Ct oo+=++=+<+=++=++=+>4、正规溶液的定义及其热力学特征。
答:混合焓不为零,但混合熵等于理想溶液混合熵的溶液称为正规溶液。
正规溶液的热力学特征为: ∑-=∆=∆≠∆i i R m m m x x R S S H ln ,0)(5、简述双膜传质理论的基本要点。
答:双膜传质理论的基本要点如下:(1)在两个相(液-液、气-液)的相界面两侧都有一层边界薄膜,这层薄膜对物质从一相进入另一相建立了基本的传质阻力。
(2)在两层薄膜之间的界面上处于动态平衡。
(3)每相中组元的扩散质流(j )()i l l C C k j -=或 ()g i g p p k j -= 其中:lll D k δ=,gg g RT p k δ=(4)薄膜中的流体是静止不动的,不受流体体内流动状态的影响,各相中传质独立进行,互不影响。
6、不锈钢冶炼时Cr 和C 存在选择性氧化,怎样才能做到“去C 保Cr”?答: 不锈钢冶炼时有如下反应:44304322.6179347064][3)(][4CCOCr pa p a KTGCOCr O Cr C =-=∆+=+根据对上述反应的分析可知:(1)“去C 保Cr”的最低温度是钢液中[Cr]与[C]氧化的转化温度,提高熔池温度,使反应00<∆G ,则反应向[Cr]还原方向进行,达到去C 保Cr 。
(2)降低CO p ,可在][Cr ϖ不变时,降低][C ϖ,达到去C 保Cr 。
7、从氧势图上(T G -∆0)可以得到哪些信息?答:(1)T G -∆0的关系是直线,直线的斜率是氧化物生成反应熵的负值(-0反S ∆)。
1)当反应的0反S ∆为负值时,直线的斜率为正,表明氧化物的稳定性随温度升高而减小(或氧化物的氧势随温度升高而升高)。
2)当反应的0反S ∆为正值时,直线的斜率为负,表明氧化物的稳定性随温度升高而增大(或氧化物的氧势随温度升高而降低)。
3)当反应的0反S ∆接近于零时,直线的斜率趋于零,表明氧化物的稳定性不随温度而改变(或氧化物的氧势不随温度而改变)。
(2)在已知温度和气相中氧的压力时,可以确定金属或氧化物的稳定性。
(3)可以求氧化物在某温度的分解压。
(4)在指定的温度下可以比较各种氧化物的相对稳定性。
(5)可以确定CO/CO 2或H 2O/H 2混合气对金属的氧化还原作用。
8、叙述氧气转炉吹炼过程脱碳速度的变化情况,并写出相应的关系式。
答:氧气转炉脱碳过程可以分为三个阶段:(1) 吹炼初期因钢水中硅含量很高,而钢水温度较低,以硅的氧化为主,而脱碳反应受到抑制,硅的氧化速度由快变慢,而脱碳速度由慢到快,最后达到最大值;(2) 在吹炼中期,随着钢水温度上升,钢水中的碳以极大的速度转移到点火区,供给的氧气几乎100%消耗于脱碳,因此脱碳速度始终保持最高水平,几乎为定值;(3) 吹炼后期,脱碳反应继续进行,但随着钢水中含碳量的减少,脱碳速度也随着钢水中的碳含量减少不断降低。
因此,整个脱碳过程中脱碳速度变化的曲线形成为台阶形。
各阶段的脱碳速度可以写出以下关系式: 第一阶段:t k dt C d 1][=- 第二阶段:2][k dt C d =-第三阶段:][][3C k dtC d =-其中:k 1——决定于[Si]及熔池温度等因素的常数; t ——吹炼时间;k 2——高速脱碳阶段由氧气流量所确定的常数;k 3——碳含量减低后,脱碳反应受碳的传质控制时,由氧流量、枪位等决定的常数。
三、计算题(四选二,共20分)1、试确定原始组成为50%CO 、20%O2、30%CO 2的混合气体燃烧后的气相组分的浓度。
(10分)解:取100m 3的混合气体为计算基础。
该体系内的反应为:2CO+O 2=2CO 2可知CO 与O 2反应的摩尔量比为2:1。
因此20m 3的O 2和40m 3的CO 反应,形成40m 3的CO 2,而原始组成中50m 3CO 中,剩余10m 3CO ,而氧气则全部反应。
故平衡气相的总体积为:10m 3CO+70m 3 CO 2。
因此,燃烧后的气相平衡成分为: CO=10/80×100%=12.5% CO 2=70/80×100%=87.5%2、在1540℃时,Fe-C 系内碳的溶解度为5.2%,加入硅2%后,碳的溶解度下降到4.6%。
求铁液内硅对碳的相互作用系数:SiC e 。
(10分)解:铁液中碳的溶解反应为:饱石][%C C =反应的平衡常数][C a K =。
标准态相同时,Fe —C 系和Fe —C —Si 系的平衡常数应相等。
即:][%][%C f C f f C C Si Si C C C = 13.16.4/2.5][%][%===SiSi C C C f假定在0~2%Si 浓度范围内,][%lg Si f Si C -成线性关系,可得:21065.2213.1lg ][%lg ][%lg -⨯==∆∆≈∂∂=Si f Si f eSiCSiCSiC3、在1873K 时与纯氧化铁渣平衡的铁液的氧的质量分数为0.211%。
与组分为ω(CaO )=39.18%,ω(MgO )=2.56%,ω(SiO2)=39.76%,ω(FeO )=18.57%的熔渣平衡的铁液的氧的质量分数为0.048%。
试计算熔渣中FeO 的活度及活度系数。
(10分)解:氧在熔渣与铁液间的反应为: ()][][Fe O FeO +=根据上述反应可知,氧以不同形式在铁液与熔渣间的分配常数为:FeOO O a a L =故得:OO FeO L a a =由题可知,对于纯氧化铁渣有:211.01211.0===FeOO O a a L与熔渣平衡的铁液则有:048.0][%==O a O ϖ故:227.0211.0048.0===OO FeO L a a又 )(227.0)(211.0048.0)(][%FeO x FeO x FeO x L O r O FeO ===ϖ其中)(FeO x 可根据100g 熔渣组分的物质的量得出:663.06076.39)(700.05618.39)(2====SiO n CaO n258.07257.18)(064.04056.2)(====FeO n MgO n153.0685.1258.0)()(685.1====∑∑BB n FeO n FeO x n故:48.1153.0227.0==FeO r4、高炉炉缸中硅的还原反应是:CO Si C SiO s 2][2)()(2+=+。
设炉缸内k P a P CO 5.175=,097.02=SiO α,1=C α,[%C]=4.0。
已知:T G CO Si C SiO l s 1.37772760022)(01)()(2-=∆+=+ TG Si Si l 25.17131500][02%)(--=∆=288.0=CSi e ,11.0=SiSi e 。
求:1500℃时生铁中平衡的硅含量。
解:由题可知反应CO Si C SiO s 2][2)()(2+=+的TG G G 35.394596100020103-=∆+∆=∆所以60.2031140304.2314.8lg 03+-=⨯∆-=TTG KCSiO CO Si p p Si f K αα⋅=22)/]([%2lg )/lg(2]lg[%lg lg SiO CO Si p p Si f K α-++= (1)其中:][%11.04288.0][%][%Si Si e c e f SiSi CSi Si ⨯+⨯=+=将有关数据带入(1)式得:097.0lg )325.1035.175lg(2]lg[%0.4288.0][%11.060.2031140-++⨯+⨯=+-Si Si T整理后得:0394.0][%11.0]lg[%=-+Si Si解得平衡硅含量为: [%Si]=1.64。