冶金物理化学习题解
- 格式:pdf
- 大小:369.94 KB
- 文档页数:42


冶金物理化学学习指导及习题解答1.冶金热力学辅导热力学内容下四个部分1)冶金热力学基础2)冶金熔体(铁溶液、渣溶液)3)热力学状态图(Ellingham图,相图)注:把各个知识点划分成三个等级;最重要的等级―――“重点掌握”第二等级―――“掌握”,第三等级―――“了解”,这便于学习者在自学或复习内容时参考。
也便于在学习时能抓住重点,更快更好地掌握冶金物理化学这门重要基础学科。
1.1 冶金热力学基础共7个知识点1) 重点掌握体系中组元i 的自由能表述方法;(包括理想气体、液体、固体)理想气体的吉布斯自由能封闭的多元理想气体组成的气相体系中,任一组元i 的吉布斯自由能为ln i i i G G RT P ∅=+i P '-i 组分气体的实际压强,Pa ;P ∅-标准压强,Pa ,也即Pa 51001325.1⨯。
应该注意的是,高温冶金过程中的气体由于压强比较低,都可以近似看作理想气体。
液相体系中组元i 的吉布斯自由能在多元液相体系中,任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+其中,i a ----组元的活度,其标准态的一般确定原则是:若i 在铁液中,选1%溶液为标准态,其中的浓度为质量百分数,[%i]; 若i 在熔渣中,选纯物质为标准态,其中的浓度为摩尔分数,i X ;若i 是铁溶液中的组元铁,在其他组元浓度很小时,组元铁的活度定义为1。
固相体系中组元i 的吉布斯自由能在多元固相体系中,其中任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+i a 确定原则是:若体系是固溶体,则i 在固溶体中的活度选纯物质为标准态,其浓度为摩尔分数,i X ; 若体系是共晶体,则i 在共晶体中的活度定义为1; 若体系是纯固体i ,则其活度定义为1。
2)重点掌握化学反应等温方程式ln G G RT Q ∅∆=∆+G ∆有三种情况 1)0>∆G ,以上反应不可以自动进行;2) 0<∆G ,以上反应可以自动进行; 3) 0=∆G ,以上反应达到平衡,此时G RTLnK ∅∅∆=-注:(1)G ∆是反应产物与反应物的自由能的差,表示反应的方向(反应能否发生的判据);表示任意时刻(不平衡状态)的压强商或活度商。


冶金物理化学答案一、解释下列概念(每题5分,共20分)1.扩散脱氧:在炼钢过程中,根据分布规律,钢液中的[O]扩散到渣中,与加入渣相的脱氧元素发生的脱氧反应称为扩散脱氧。
2、炉渣:炉渣是火法冶金中以氧化物为主要成分形成的多组分熔体,是金属提炼和精炼过程中除金属熔体以外的另一产物。
3.硫容量:炉渣含有或溶解硫的容量,即CS?(%s)?(po2/ps2)1/24、偏摩尔量:在恒温、恒压及其他组分的物质的量保持不变的条件下,溶液的广度性质x(x代表u、h、v、s、g)对其组分摩尔量的偏微商值。
二、简短回答问题(共60分)1、简述热力学计算中活度标准态之间的转换关系。
答:(1)纯物质标准态活度与假想纯物质标准态活度的换算:ab[r]ab[h]?pb/pbpb/kh(x)*?kh(x)p*b?rb0故ab[r]?rbab[h]0(2)纯物质的标准态活度与1%质量溶液的标准态活度之间的换算:ab[r]ab[%]?pb/pbpb/kh(%)*?kh(%)pb*?mab100m?kh(x)pb*?mab100m?rb0(3)假设纯物质的标准态活度与1%质量溶液的标准态活度之间的换算:ab[h]ab[%]?pb/kh(x)pb/kh(%)?kh(%)kh(x)?mab100m2.简述了炉渣氧化脱磷的热力学条件。
答:根据炉渣的脱磷反应:lp?(%p2o5)[%p]2?kp(to)(êo)f542p?feo??cao?cap2o954根据上述公式,为了使脱磷反应完全,必要的热力学条件是:(1)炉渣碱度高;(2)氧化铁含量高;(3)较低的浴温;大渣量。
3.一氧化碳还原氧化铁的顺序是什么?写出反应方程式(天平)。
答:氧化铁被co还原在570℃以上及其下有不同的转变顺序,因此氧化铁还原是逐级的,反应如下:T570co3fe2o3(s)?有限公司?2fe3o4(s)?cofe3o4(s)?有限公司?3feo (s)?科菲欧(s)?有限公司?fe(s)?co2222t?570co3fe2o3(s)?co?2fe3o4(s)?co14fe3o5(s)?co?34fe(s)?co24.正常溶液的定义和热力学特征。

冶金物理化学学习指导及习题解答1.冶金热力学辅导热力学内容下四个部分1)冶金热力学基础2)冶金熔体(铁溶液、渣溶液)3)热力学状态图(Ellingham图,相图)注:把各个知识点划分成三个等级;最重要的等级―――“重点掌握”第二等级―――“掌握”,第三等级―――“了解”,这便于学习者在自学或复习内容时参考。
也便于在学习时能抓住重点,更快更好地掌握冶金物理化学这门重要基础学科。
1.1 冶金热力学基础共7个知识点1) 重点掌握体系中组元i 的自由能表述方法;(包括理想气体、液体、固体)理想气体的吉布斯自由能封闭的多元理想气体组成的气相体系中,任一组元i 的吉布斯自由能为ln i i i G G RT P ∅=+i i P P P ∅'=i P '-i 组分气体的实际压强,Pa ;P ∅-标准压强,Pa ,也即Pa 51001325.1⨯。
应该注意的是,高温冶金过程中的气体由于压强比较低,都可以近似看作理想气体。
液相体系中组元i 的吉布斯自由能在多元液相体系中,任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+其中,i a ----组元的活度,其标准态的一般确定原则是:若i 在铁液中,选1%溶液为标准态,其中的浓度为质量百分数,[%i]; 若i 在熔渣中,选纯物质为标准态,其中的浓度为摩尔分数,i X ;若i 是铁溶液中的组元铁,在其他组元浓度很小时,组元铁的活度定义为1。
固相体系中组元i 的吉布斯自由能在多元固相体系中,其中任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+i a 确定原则是:若体系是固溶体,则i 在固溶体中的活度选纯物质为标准态,其浓度为摩尔分数,i X ; 若体系是共晶体,则i 在共晶体中的活度定义为1; 若体系是纯固体i ,则其活度定义为1。
2)重点掌握化学反应等温方程式ln G G RT Q ∅∆=∆+G ∆有三种情况 1)0>∆G ,以上反应不可以自动进行;2) 0<∆G ,以上反应可以自动进行; 3) 0=∆G ,以上反应达到平衡,此时G RTLnK ∅∅∆=-注:(1)G ∆是反应产物与反应物的自由能的差,表示反应的方向(反应能否发生的判据);c dC D a bA Ba aQ a a = 表示任意时刻(不平衡状态)的压强商或活度商。

北京科技大学 2006—2007学年 第一学期冶金物理化学标准答案一、简答 (每小题5分,共50分)1. 试用相图的基本规则说明以下相图的错误所在?答:违背了相图的构筑规则“在二元系中,单相区与两相区邻接的界线延长线必须进入两相区,不能进入单相区”2. 在Ellingham 图上,为什么形成CO 的曲线的斜率为负值,而一般的斜率为正值? 答:CO O C 222=+ΘΘΘΘ−−=ΔC O CO S S S S 2202f ΘΘ−≈S S CO 0p ΘΔ−∴S ;∴ΘΔG ~T 曲线的斜率小于零。
同理可以证明一般反应的~T 曲线的斜率大于零。
ΘΔG 3. 简述分子理论的假设条件。
答:1)熔渣是由各种电中性的简单氧化物分子、CaO 、MgO 、、、及它们之间形成的复杂氧化物分子FeO 32O Al 2SiO 52O P 2SiO CaO •、22SiO CaO •、、等组成的理想溶液。
22SiO FeO •52O P CaO •2)简单氧化物分子于复杂氧化物分子之间存在着化学平衡,平衡时的简单氧化物的摩尔分数叫该氧化物的活度。
以简单氧化物存在的氧化物叫自由氧化物;以复杂氧化物存在的氧化物叫结合氧化物。
如:()=2()+() 22SiO CaO •CaO 2SiO 2222SiO CaO SiO CaO D x x x K •=由K D 计算的x CaO 及x SiO2叫及的活度。
CaO 2SiO 4. 试解释正规溶液定义。
答:过剩混合热(其实为混合热)不为零,混合熵与理想溶液的混合熵相同的溶液叫正规溶液。
5. 试从热力学原理说明熔渣的氧化还原性? 答:定义∑FeO 0表示渣的氧化性。
决定炉渣向钢液传氧的反应是()=FeO [][]Fe O +[]FeOa O K00=Θ或[]FeOa O L 000=令[]FeOa O L00'0=----代表实际熔渣中的值。
当时,'oL f 0L f 0'0'00ln ln ln L L RT L RT L RT G =+−=Δ0,反应逆向进行,钢液中的氧向熔渣传递;当时,='oL p 0L G Δ0'0ln L L RT 0p ,反应正向进行,熔渣中的氧向钢液传递。

习题11.计算浓度为1.0×10-6M的醋酸溶液的平衡pH,醋酸的电离常数: Ka=1.8×10-5.(HAC=H++AC-)2.在同一张图上, 画出一个多元体系平衡pH图,该平衡pH是各物种总浓度对数的函数.(列出物质)3.考察Na2CO3-H2O体系,计算所有物种的平衡浓度,平衡浓度是Na2CO3总浓度的函数.参考: F. S. Nakayama, Hydrolysis of sodium Carbonate, J.Chem. Educ., 47,67,(1970)4.修改程序1-6,使之能用于求解酸, 碱混合体系的平衡问题,例如一个溶液中HCl的浓度是aM,NH3的浓度是bM,三乙醇胺的浓度是cM.参考:M .J. D. Brand, A general method for the solution of polynomial equations in H+ion concentration, J. Chem. Educ. 53,771(1976)5.讨论溶液平衡MX(s)=M z++X z-Ksp=a Mz+.a Xz-试证明25℃时,在C摩尔1:1电解质溶液中,盐MX的溶解度是方程:F(S)=2logS-1.018Z2Z2S+C -logKsp的一个根,假定满足Debye-Huckel 极限定理,选择一系列难溶盐,画出溶解度-离子强度图.(X)6.编写一个程序, 求解在含有HCl的溶液中, CuCl溶解度的最小值.(CuCl=Cu+ClK=[Cu+]*[Cl-]=1.628*10-7[Cl]T=[Cl]cu+[Cl]h S=[Cu+]*(37.5+64)/10 [Cl-]T=0.1+[Cl-]=0.1+[Cu+] [Cu+](0.1+[Cu+])=1.628E-7X(0.1+x)=1.628e-7F(x)=x2+0.1x-1.628e-7牛顿法7.编写一个程序,用自由能极小值方法求解平衡问题.参考: S. Davidson, Iterative method of solving equilibrium problem by free-energy minimization. J. Chem. Educ. 50,299(1973)8.化学反应的平衡浓度一氧化碳与氢按以下反应生成甲醇CO+2H2=CH3OH现有1mol CO与2mol H2的混合物, 在t=590℃, P=3.04×107Pa下进行反应并达到平衡,(K f=1.393×10-15 (正反应速率常数),K r=0.43(逆反应)), 求CH3OH在平衡气相中的摩尔分数.C1=K f*Pco*P2H2 正反应速率C2=Kr*P CH3OH 逆反应速率K=P CH3OH/( Pco*P2H2 )=Kf/KrPV=nRT9.配合平衡计算将0.1mol/L Cu(NH3)42+溶于0.1mol/L氨水中, 试问所得溶液中Cu2+的离子浓度为多少,设Cu(NH3)42+的不稳定常数(电离常数)为4.6×10-14. 例题4K=[Cu][NH]/[CuNH]10.求1mol/L[Ni(NH3)6](NO3)2溶液中Ni2+的浓度,已知配合反应Ni(NH3)2+6=Ni2++6NH3的不稳定常数为K d=5.7×10-9.Kd=[Ni][NH]6/ [Ni(NH)] NH=1-Ni(NH)=NiNi+Ni(NH)=1F(Ni)=6^6*[Ni]^7+Kd*[Ni]-kdF’(x)=7*6*x^6+kd11.求0.2mol/L HF溶液的pH值. 已知HF的离解常数K=7.2×10-4.例题5 H+包括水中的12.推导浓度为C的一元弱酸水溶液中氢离子浓度的表达式.(①考虑水的离解,②不考虑水的离解)并分别计算苯酚(K=1.004×10-10)和硝基苯(K=7.096×10-8)两种酸在浓度为1mol/L和1×10-4mol/L时的pH.阴阳离子都给出则考虑电中性13.已知氨分解反应式为:NH3=0.5N2+1.5H2在450℃时平衡常数Kp=0.1132×108(Pa), 计算总压为3.039×107Pa时,氨最多能分解的百分数.习题二1.已知反应2NO3=NO+O2的平衡常数K与标准焓变ΔH及温度T(K)之间的关系如下:lnK=-ΔH/RT+C实验测定t=97℃时K=0.508×10-6,t=27℃时,K=9.79×10-11,计算t=50℃时的平衡常数。


第一章1 冶金原理研究的主要内容包括________、________和________。
冶金动力学、冶金热力学、冶金溶液。
2 金属熔体指________、________。
液态的金属、合金。
1、冶金原理是提取冶金的主要基础科学,它主要是应用_______的理论和方法研究提取冶金过程,为解决有关_____问题、开拓____的冶金工艺、推进冶金技术的发展指明方向。
物理化学、技术、新2、根据组成熔体的主要成分的不同,一般将冶金熔体分为________、______、_______、_______四种类型。
金属熔体、熔渣、熔盐、熔硫。
3、冶金原理按具体的冶金对象分为______冶金原理及_____冶金原理。
钢铁、有色金属。
4、根据熔渣在冶炼过程中的作用的不同,熔渣主要分为________、_______、________、__________四种。
在生产实践中,必须根据各种冶炼过程的特点,合理地选择_____,使之具有符合冶炼要求的物理化学性质。
冶炼渣、精炼渣、富集渣、合成渣。
熔渣。
5、熔渣是_______和_______的重要产物之一。
金属提炼、精炼过程。
6、熔渣是指主要由各种______熔合而成的熔体。
氧化物。
7、________的作用在于使原料中的某些有用成分富集于炉渣中,以便在后续工序中将它们回收利用。
富集渣、8、_______的作用是捕集粗金属中杂质元素的氧化产物,使之与主金属分离。
精炼渣。
9、在造锍熔炼过程中,为了使锍的液滴在熔渣中更好的沉降、降低主金属在渣中的损失,要求熔渣具有较低的______、______和_______。
粘度、密度、渣-锍界面张力。
10、为了提高有价金属的回收率、降低冶炼过程的能耗,必须使锍具有合适的______.物理化学性质。
11、在生产实践中,必须根据各种冶炼过程的特点,合理地选择________,使之具有符合冶炼要求的物理化学性质。
熔渣成分12、冶金过程热力学可以解决的问题有:1)计算给定条件下的;根据的正负判断该条件下反应能否自发地向________进行:2)计算给定条件下的平衡常数,确定反应进行的______;3)分析影响反应的和平衡常数,为进一步提高________指明努力方向。
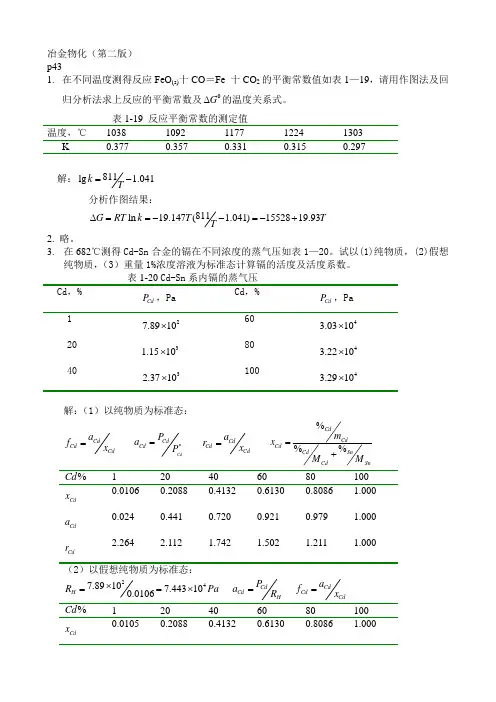
冶金物化(第二版) p431. 在不同温度测得反应FeO (s)十CO =Fe 十CO 2的平衡常数值如表1—19,请用作图法及回归分析法求上反应的平衡常数及0G ∆的温度关系式。
表1-19 反应平衡常数的测定值 温度,℃ 1038 1092 1177 1224 1303 K 0.377 0.357 0.331 0.315 0.297解:811lg 1.041k T=-分析作图结果:811ln 19.147( 1.041)1552819.93G RT k T T T∆==--=-+2. 略。
3. 在682℃测得Cd-Sn 合金的镉在不同浓度的蒸气压如表1—20。
试以(1)纯物质,(2)假想纯物质,(3)重量1%浓度溶液为标准态计算镉的活度及活度系数。
Cd P ,Pa Cd P ,Pa 1 27.8910⨯ 60 43.0310⨯ 20 31.1510⨯ 80 43.2210⨯ 40 32.3710⨯10043.2910⨯解:(1)以纯物质为标准态:CdCd Cd a f x =CdCdCd P a P *=CdCd Cd a r x =%%%CdCd Cd CdSnCdSnm x M M =+%Cd120 40 60 80 100 Cd x 0.0106 0.2088 0.4132 0.6130 0.8086 1.000 Cd a0.024 0.441 0.720 0.921 0.979 1.000 Cd r2.2642.1121.7421.5021.2111.000(2)以假想纯物质为标准态:247.89107.443100.0106H R Pa ⨯==⨯ CdCd H P a R =CdCdCd a f x =%Cd120 40 60 80 100 Cd x0.0105 0.2088 0.4132 0.6130 0.8086 1.000Cd a Cd f1.0000.9330.7700.6640.5350.44227.89101%i i DK Pa ==⨯ %%Cd Cda f =%Cd120 40 60 80 100 Cd a1.000 18.38 30.04 38.40 40.81 41.70 %f1.0000.9170.7510.6400.5700.4174. A-B 系合金在1000K 时组分A 的蒸气压如表1-21。

P1881.试计算高炉中炉气的CO 2为16%的区域内。
总压为126656.25Pa 时,石灰石的分解温度和沸腾温度。
CaO 3 =CaO CO 2. :G ° =1 7 0 5 77 1 4T4. 1 98908 lg P CO 2 = 7.53- P CS 20265 ° - P CO 2 =— = ------------- =0.22P- 101325T =1082.5KT =1198.4K2.根据氧势图, 求Fe 2O 3分解在大气中分解的开始温度和沸腾温度,并与 Fe 2O 3分解压的热力学计算值进行比较。
P)2'也=苛=0.21 % =0.21 101325Pa连接 “O” 与 P 2=10皿87 点,T=1380 C沸腾 P O =1=10° T=1460 C 计算:6Fe 2O 3 =4Fe 3O 4 0200= 58 67 70 3 4T0. 2 0开始分解:T 开=1338 C沸腾:T 沸=1451 C 3.把5X10~kg 的碳酸钙放在体积为1.5乂10誓m 3真空容器内,加热到800C ,问有多少kg 的 碳酸钙未能分解而残留下来。
CaO 3 =CaO CO 2G 0 =1 7 0 577 1 4T4. 19①开始分解P'CO 2 =P 总、勺6%= 126656.2 0.16 =20265Pa ②沸腾时:P CO 2=P 总、P C O 2普=1.25IgP o^ =30645.517.77_。
8908T=800C ( 1073K) Ig F CO 2 = —+7.53F C O 2 =0.169.F C O =0.169 101.325Pa =17124Pa 按理想气体处理,分解的CO 2量则分解的CaO 3摩尔数为n = 0.00288molm = 100g / mol 0.00288mol = 0.288g:m =0.5 103 -0.288 10^ =0.212 10°kg5.用空气/水汽=3(体以比)的混合气体去燃烧固体碳。
冶金物理化学试题及答案一、单项选择题(每题2分,共20分)1. 冶金过程中的氧化还原反应主要发生在哪个区域?A. 熔融区B. 固相区C. 液相区D. 气相区答案:A2. 金属的熔点和沸点之间有什么关系?A. 熔点高于沸点B. 熔点低于沸点C. 熔点等于沸点D. 熔点与沸点无关答案:B3. 以下哪种物质不属于冶金原料?A. 铁矿石B. 焦炭C. 石灰石D. 塑料答案:D4. 冶金过程中,哪种气体是主要的还原剂?A. 氧气B. 氮气C. 氢气D. 二氧化碳答案:C5. 金属的腐蚀主要发生在哪个阶段?A. 熔炼阶段B. 精炼阶段C. 铸造阶段D. 材料使用阶段答案:D6. 冶金过程中,哪种物质可以作为脱硫剂?A. 石灰石B. 石英C. 铁矿石D. 焦炭答案:A7. 以下哪种金属属于有色金属?A. 铁B. 铜C. 铝D. 锌答案:B8. 冶金过程中,哪种物质可以作为脱氧剂?A. 氧气B. 氮气C. 氢气D. 二氧化碳答案:A9. 金属的塑性变形主要发生在哪个温度区间?A. 室温以下B. 室温至再结晶温度C. 再结晶温度以上D. 熔点附近答案:B10. 冶金过程中,哪种物质可以作为造渣剂?A. 石灰石B. 石英C. 铁矿石D. 焦炭答案:A二、多项选择题(每题3分,共15分)11. 冶金过程中,以下哪些因素会影响金属的还原?A. 温度B. 压力C. 气体成分D. 金属的化学性质答案:A, B, C, D12. 以下哪些物质可以作为冶金过程中的燃料?A. 焦炭B. 煤C. 天然气D. 石油答案:A, B, C, D13. 以下哪些因素会影响金属的熔点?A. 晶体结构B. 原子半径C. 电子结构D. 化学键强度答案:A, B, C, D14. 以下哪些物质可以作为冶金过程中的助熔剂?A. 石灰石B. 石英C. 铁矿石D. 焦炭答案:A, B15. 以下哪些因素会影响金属的腐蚀速率?A. 环境温度B. 金属纯度C. 表面状态D. 应力状态答案:A, B, C, D三、判断题(每题2分,共20分)16. 冶金过程中,金属的还原反应总是伴随着氧化反应。
第一章1 冶金原理研究的主要内容包括________、________和________。
冶金动力学、冶金热力学、冶金溶液。
2 金属熔体指________、________。
液态的金属、合金。
1、冶金原理是提取冶金的主要基础科学,它主要是应用_______的理论和方法研究提取冶金过程,为解决有关_____问题、开拓____的冶金工艺、推进冶金技术的发展指明方向。
物理化学、技术、新2、根据组成熔体的主要成分的不同,一般将冶金熔体分为________、______、_______、_______四种类型。
金属熔体、熔渣、熔盐、熔硫。
3、冶金原理按具体的冶金对象分为______冶金原理及_____冶金原理。
钢铁、有色金属。
4、根据熔渣在冶炼过程中的作用的不同,熔渣主要分为________、_______、________、__________四种。
在生产实践中,必须根据各种冶炼过程的特点,合理地选择_____,使之具有符合冶炼要求的物理化学性质。
冶炼渣、精炼渣、富集渣、合成渣。
熔渣。
5、熔渣是_______和_______的重要产物之一。
金属提炼、精炼过程。
6、熔渣是指主要由各种______熔合而成的熔体。
氧化物。
7、________的作用在于使原料中的某些有用成分富集于炉渣中,以便在后续工序中将它们回收利用。
富集渣、8、_______的作用是捕集粗金属中杂质元素的氧化产物,使之与主金属分离。
精炼渣。
9、在造锍熔炼过程中,为了使锍的液滴在熔渣中更好的沉降、降低主金属在渣中的损失,要求熔渣具有较低的______、______和_______。
粘度、密度、渣-锍界面张力。
10、为了提高有价金属的回收率、降低冶炼过程的能耗,必须使锍具有合适的______.物理化学性质。
11、在生产实践中,必须根据各种冶炼过程的特点,合理地选择________,使之具有符合冶炼要求的物理化学性质。
熔渣成分12、冶金过程热力学可以解决的问题有:1)计算给定条件下的;根据的正负判断该条件下反应能否自发地向________进行:2)计算给定条件下的平衡常数,确定反应进行的______;3)分析影响反应的和平衡常数,为进一步提高________指明努力方向。
冶金原理(第二版) p431. 在不同温度测得反应FeO (s)十CO =Fe 十CO 2的平衡常数值如表1—19,请用作图法及回归分析法求上反应的平衡常数及0G ∆的温度关系式。
表1-19 反应平衡常数的测定值 温度,℃ 1038 1092 1177 1224 1303 K 0.377 0.357 0.331 0.315 0.297解:811lg 1.041k T=-分析作图结果:811ln 19.147( 1.041)1552819.93G RT k T T T∆==--=-+2. 略。
3. 在682℃测得Cd-Sn 合金的镉在不同浓度的蒸气压如表1—20。
试以(1)纯物质,(2)假想纯物质,(3)重量1%浓度溶液为标准态计算镉的活度及活度系数。
Cd P ,Pa Cd P ,Pa 1 27.8910⨯ 60 43.0310⨯ 20 31.1510⨯ 80 43.2210⨯ 40 32.3710⨯10043.2910⨯解:(1)以纯物质为标准态:CdCd Cd a f x =CdCdCd P a P *=CdCd Cd a r x =%%%CdCd Cd CdSnCdSnm x M M =+%Cd120 40 60 80 100 Cd x 0.0106 0.2088 0.4132 0.6130 0.8086 1.000 Cd a0.024 0.441 0.720 0.921 0.979 1.000 Cd r2.2642.1121.7421.5021.2111.000(2)以假想纯物质为标准态:247.89107.443100.0106H R Pa ⨯==⨯ CdCd H P a R =CdCdCd a f x =%Cd120 40 60 80 100 Cd x0.0105 0.2088 0.4132 0.6130 0.8086 1.000Cd a Cd f1.0000.9330.7700.6640.5350.44227.89101%i i DK Pa ==⨯ %%Cd Cda f =%Cd120 40 60 80 100 Cd a1.000 18.38 30.04 38.40 40.81 41.70 %f1.0000.9170.7510.6400.5700.4174. A-B 系合金在1000K 时组分A 的蒸气压如表1-21。
钢液中[O]=0.058%。
试确定计算FeO 的活度的正确性。
解:1)分子理论取100g 渣,计算其中各简单氧化物分子的物质的量12.020.16772FeO n mol ==;14.970.37440MgO n mol ==;8.840.14171MnO n mol ==;219.340.37460SiO n mol ==;42.680.76256CaO n mol ==;25 2.150.015142P O n mol ==; 设熔渣中存在的复杂氧化物;在分子理论的假设下,熔渣的结构有4种组元: 简单氧化物FeO;RO(CaO,MnO,MgO 三物之和);复杂氧化物2252,4CaO SiO CaO PO . 其中,酸性氧化物全部与碱性氧化物形成复杂氧化物。
2220.374RO SiO SiO n n mol ∙== ; 252540.015RO P O P O n n mol ∙== ; 0.167FeO n mol =过剩碱22524()24 0.7620.1250.37420.33240.0150.537CaO MnO MgO CaO SiO CaO P O RO n n n n n n mol∙∙=++--=++-⨯-⨯=剩余22524()0.1670.5370.3220.015 1.041i FeO CaO SiO CaO P O RO n n n n n mol∙∙=+++=+++=∑剩余;a a a a 0.7620.732,11.041C OC O C O C O in a x n γ=====∑;n n n n 0.1250.120,11.041M O M O M O M O in a x n γ=====∑;0.1670.160,11.041FeOFeO FeO FeO in a x n γ=====∑2)完全离子理论0.079FeO a =,修正后0.166FeO a = 3)由反应()[][]FeO O Fe =+得[%O]O FeOL a =,在1873K 时实验得到0.23O L =,所以 [%O]0.0580.2520.23FeO O a L ===55试用完全离子溶液模型计算1600℃时炉渣中(CaO)、(MnO)、(FeO)的活度及活度系数。