探索碱的性质第二课时
- 格式:doc
- 大小:84.50 KB
- 文档页数:3

1.3探索碱的性质(二)【学习目标】1知识与技能:了解氢氧化钠和氢氧化钙的个性。
进一步了解强碱的注意事项,进一步掌握碱的共性。
2、过程与方法:通过观察和分析,认识两种重要的碱。
通过实验,了解碱的个性。
3、情感、态度与价值观:善于将科学性和实用性相结合,从共性中了解个性【重点难点】Na OH和Ca (OH)2的个性及强碱的腐蚀性【学习过程】1.氢氧化钠的俗名:2.氢氧化钠可以做某些气体的干燥剂。
3.氢氧化钠溶于水且溶解时会。
4.思考:烧碱固体必须密封保存的原因:5.总结NaOH的个性:6.氢氧化钙的俗名:氢氧化钙是由与水化合而生成的。
7.氢氧化钙物理性质:8.思考:有人用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了。
在这个过程发生了哪些化学变化?写出有关的化学方程式。
9.盛有盐酸、氯化钠、氢氧化钠的三瓶无色液体,只用酚酞一种试剂如何将它们区别?10.按下列要求各写一个化学方程式(1) NaOH →Cu(OH)2(2) NaOH →Na2CO3(3) NaOH →NaCl11.下列物质暴露在空气中,质量增加且变质的是()A.浓硫酸B。
火碱C。
水D。
浓盐酸12. 对于反应A+B=C+D来说,下列说法错误的是()A. 若生成物C、D分别为氯化钠和水,该反应不一定是中和反应B. 若A、C为单质,B、D为化合物,该反应一定是置换反应C. 若A为可溶性碱,B为可溶性盐,则该反应可能是复分解反应D. 参加反应的A、B的质量之和一定等于生成的C、D的质量之和13.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。
经过一段时间后,下列有关叙述正确的是( )A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解14.用水作试剂,不可能区分开来的一组物质是()A.生石灰、食盐、烧碱B.汽油、酒精、浓硫酸C.无水硫酸铜、碳酸钙、碳酸钠D.氯化钾、硝酸钠、硫酸钾15.现有硫酸、盐酸、氢氧化钠、氢氧化钙四种无色溶液,按如下步骤实验:A B 溶液变浑浊CO2气体B D 无明显现象石蕊试液C A 无明显现象D C 有白色沉淀产生试根据实验现象推测:A B C D16.如下图所示:是某同学设计的制取纯净、干燥的CO2气体的装置:回答下列问题:(1)指出图中标明仪器的名称①是,②是。




课题探索碱的性质(2)课型:新授课主备人季学祥审核人(教研组)班级姓名学习组长学习目标:1、知识点掌握:1)了解碱的主要性质,举例说明碱在日常生活中的用途和对人类的影响;2)继续练习使用试管和滴管进行物质(溶液)性质试验的操作;3)了解强碱的使用注意事项,理解中和反应的实质。
2、能力培养:通过实验操作,提高学生动手的能力。
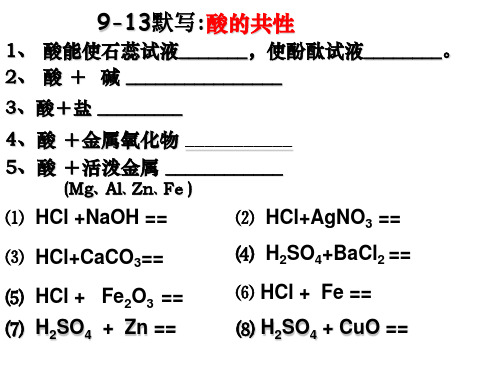
学习重点:碱的主要性质和强酸的使用学习难点:碱的典型反应及其方程式学习过程:一、预习·导学1、碱的共性是:(1)碱的水溶液能使紫色石蕊试液、无色酚酞试液变;(2)碱能和某些非金属氧化物反应生成;如:。
(写化学反应方程式,下同)(3)碱能和酸反应生成;如:。
(4)碱能和某些盐反应生成。
如:。
2、氢氧化钠俗称或,化学式为。
氢氧化钠暴露在空气中易吸收而潮解,吸收二氧化碳而变质,其方程式是。
3、氢氧化钙俗称或,化学式为,水溶液是。
4、写出下列化学反应方程式:1)二氧化碳通入石灰水:;2)氢氧化钠溶液与稀硫酸:;3)氢氧化钙溶液与碳酸钠溶液:;4)氢氧化钠溶液与硫酸铜溶液:;5)氢氧化钠溶液与氯化铁溶液:。
家长签名二、预习·疑问(通过认真预习,请你写下疑惑摘要,在预习准备课上与组员交流)星级评定(由学习组长评定,对完成预习任务并积极讨论疑惑的组员给予一颗星)三、学习·研讨1、.除去食盐溶液中混有的少量硫酸镁,可加入适量的一种试剂是()A、BaCl2溶液 B、NaOH溶液 C、Na2O D、BaO2、某种消化药片的有效成分是氢氧化镁,能减缓胃酸过多引起的疼痛。
在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是 ( )3、10克10%的盐酸与10克10%的氢氧化钠溶液混合,混合后溶液能与下列物质反应的是()A、CuSO4溶液B、CO2C、CuOD、 H2SO44、请写出下列反应的化学方程式:(1)用石灰浆粉刷过的墙壁,刚开始时会“冒汗”:;(2)敞口放置一段时间的氢氧化钠溶液中滴加足量稀盐酸,产生气泡:,,收集生成的气体,通入澄清的石灰水,澄清石灰水变浑浊:;(3)工业上用氢氧化钠溶液吸收二氧化硫气体:。
探索碱的性质第二课时
学习目标:
1)进一步熟悉碱的主要性质,能够熟练写出常见的关于碱的相关化学方程式2)理解中和反应及其实质,并能说出中和反应在生活中的用途
课前预习
1、写出下列物质化学式:
氢氧化钠氢氧化钾氢氧化镁
氢氧化钙氢氧化铜氢氧化钡
氢氧化锌氢氧化铁氢氧化铝
氢氧化亚铁氨水
以上碱能溶于水的有
不溶于水的有
导学一:中和反应
1、碱和酸作用生成的反应叫做反应。
2、写出下列化学反应方程式:
氢氧化钙与盐酸:
氢氧化钠与硫酸:
氢氧化钠与二氧化硫:
思考:第三个方程式是不是属于酸碱中和反应?
根据上述知识得出结论:叫酸碱中和反应思考:酸碱中和反应的实质是什么?
你能用化学符号表示出中和反应的实质吗?
3、酸碱中和反应的应用:
农业上用施加来降低土壤的酸性;
精制石油时,用来中和过量的酸。
课堂小测
1、除去食盐溶液中混有的少量氯化镁,可加入适量的一种试剂是()
A.BaCl
2溶液 B.NaOH溶液 C.Na
2
O D.BaO
2、某种消化药片的有效成分是氢氧化镁,能减缓胃酸过多引起的疼痛。
在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是:
3、请写出下列反应的化学方程式:
(1)用石灰浆粉刷过的墙壁,刚开始时会“冒汗”:
(2)工业上用氢氧化钠溶液吸收二氧化硫气体:
4、用盐酸与氢氧化钠溶液作用,研究中和反应时,看不到明显的实验现象。
有如下做法:
①放弃对此问题的研究;②挪用其他人的实验结果;
③实验前向氢氧化钠溶液中滴加两滴无色酚酞试液;
④改用氢氧化铜与稀硫酸反应。
其中正确的是( )
A.①③ B.③④C.①④D.②④
5、下列物质中,可以用来区别氢氧化钠溶液和Ca(OH)2溶液的是()
A紫色石蕊试液 B无色酚酞试液 C 二氧化碳气体 D氯化纳
6、可以用来鉴别酸性或碱性溶液的指示剂有()
①紫色石蕊试液②无色酚酞试液③蓝色石蕊试纸④红色石蕊试纸
A.只有①B.只有②和③C.只有②③④D.①②③④
6.下列物质长期放在敞口容器中,质量会减少的是()
A.氢氧化钠固体 B.大理石 C.浓硫酸 D.浓盐酸
7、中和反应在日常生活和工农业生产中有广泛的应用。
下列实例不属于中和反应在生活中的应用的是()
A.土壤酸化后加入熟石灰改良
B.胃酸分泌过多的病人遵医嘱服用某些含有碱性物质的药物,以中和过多的胃酸
C.蚊子叮咬人的皮肤时会分泌出蚁酸,使被叮咬处肿成大包,如果涂一些含碱性物质的药水就可减轻痛痒
D.金属表面锈蚀后,可用稀盐酸进行清洗
8、据报载,一辆载浓硫酸的槽罐车在路上因车祸翻倒,浓硫酸大量泄漏。
为了不污染道路两旁边的水源,下列措施中可行的是( )
A .用水冲洗泄漏的浓硫酸
B .将熟石灰撒在泄漏出的浓硫酸中
C .将氯化钡撒在泄漏出的浓硫酸中
D .用土将泄漏出的浓硫酸掩埋
9、固体氢氧化钠和氧化钙的混合物叫做碱石灰,常用作干燥剂。
下列气体不能用碱石灰干燥的是( )
A.CO
B.CO 2
C.H 2
D.O 2
10、能用来鉴别稀盐酸、纯水、澄清石灰水三瓶无色液体的试剂是( )
A.酚酞溶液
B.稀硝酸
C.碳酸钠溶液
D.硫酸钠溶液 选做题:
11、如图所示,广口瓶中盛有气体X ,胶头滴管中盛有液体Y ,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间后可见到小气球a 膨胀鼓起。
下表中的各组物质不出现上述现象的是( )
12、久盛石灰水的试剂瓶内壁常附有一层白膜,出现这种现象的化学反应方程式是:
,要洗去这层白膜最好的试剂是 , 其化学反应方程式是 。
13、实验室有2瓶失去标签的试剂,已知一瓶是稀硫酸,一瓶是NaOH 溶液,你有哪些方法可以将它们区别开来?写出三种区别方法:
方法一: 方法二: 方法三:。