弱酸、弱碱的证明方法及其强化练习
- 格式:docx
- 大小:21.57 KB
- 文档页数:10


弱酸、弱碱的证明方法一、弱电解质的证明理论依据弱电解质的证明,是基于与强电解质对比进行的。
弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。
因此,只要证明有电离平衡存在,就证明了弱电解质。
二、弱酸CH3COOH的证明方法1、测定一定浓度的CH3COOH溶液的PH值例如:测定0.1mol/L的CH3COOH的PH值>1,说明CH3COOH是弱酸。
2、测定一定浓度的CH3COONa溶液的PH值例如:测定0.1mol/LCH3COONa溶液的PH>7,证明CH3COOH是弱酸。
3、将一定PH值的CH3COOH溶液稀释10n倍后,测定PH值。
例如:将PH=1的CH3COOH溶液10mL,用蒸馏水稀释至1000mL,PH<3,证明CH3COOH 是弱酸。
4、测定相同浓度的CH3COOH溶液和HCl溶液的导电性,比较导电性强弱。
例如:测定0.1mol/LCH3COOH溶液和0.1mol/LHCl溶液的导电性,导电性弱的CH3COOH 是弱酸。
5、测定一定PH值CH3COOH溶液与HCl溶液,稀释相同倍数倍后PH值的改变例如:将PH=1的CH3COOH溶液与HCl溶液10mL都稀释至100mL,PH值变化小的是CH3COOH,是弱酸。
6、用等物质的量浓度的CH3COOH与HCl分别与锌反应,看产生气泡的速率。
例如:用0.1mol/LCH3COOH溶液和0.1mol/LHCl溶液分别与锌反应,产生气泡速率慢的是CH3COOH,是弱酸。
7、用等物质的量浓度的CH3COOH与HCl分别与碳酸氢钠反应,看产生气泡的速率。
例如:用0.1mol/LCH3COOH溶液和0.1mol/LHCl溶液分别与碳酸氢钠反应,产生气泡速度慢的是CH3COOH,是弱酸。
8、用等体积等PH值的CH3COOH与HCl溶液分别与一定浓度的氢氧化钠进行中和滴定,看消耗氢氧化钠溶液的体积。
例如:将PH=1的CH3COOH溶液与HCl溶液各20mL,分别与0.1mol/L的NaOH溶液进行中和滴定,消耗NaOH溶液多的是CH3COOH,是弱酸。


强酸(碱)与弱酸(碱)的比较李仕才考点梳理1.一元强酸(HA)与一元弱酸(HB)的比较方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH 溶液的pH>1。
方法二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH 加水稀释10倍后,1<pH<2。
方法三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可做以下实验:(1)向一定浓度的醋酸钠溶液中,加入几滴酚酞溶液,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
3、强弱电解质的图像分析盐酸、醋酸图像题的分析方法(1)相同体积、相同浓度的盐酸、醋酸①加水稀释相同的倍数,醋酸的pH大。
②加水稀释到相同的pH,盐酸加入的水多。
(2)相同体积、相同pH的盐酸、醋酸①加水稀释相同的倍数,盐酸的pH大。
②加水稀释到相同的pH,醋酸加入的水多。
(3)不论怎样稀释,酸溶液的pH不能等于或大于7,碱溶液的pH不能等于或小于7,都只能趋近于7。
考向分析:考向一、强酸和弱酸(碱)的判断典例1、下列事实一定能说明HNO2为弱电解质的是()①常温下,NaNO2溶液的pH>7②用HNO2溶液做导电实验灯泡很暗③HNO2不能与NaCl反应④常温下0.1 mol·L-1的HNO2溶液pH=2⑤1 L pH=1的HNO2溶液加水稀释至100 L后溶液的pH=2.2⑥1 L pH=1的HNO2和1 L pH=1的盐酸与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH溶液多⑦HNO2溶液中加入一定量NaNO2晶体,溶液中[OH-]增大⑧HNO2溶液中加水稀释,溶液中[OH-]增大A.①②③⑦ B.①③④⑤C.①④⑤⑥⑦ D.②④⑥⑧解析:②如果盐酸(强酸)的浓度很小灯泡也很暗;④如果是强酸,pH=1;⑤如果是强酸,加水稀释至100 L后溶液的pH=3,实际pH=2.2,这说明HNO2溶液中存在HNO2H++NO-2,加水平衡右移,使pH<3;⑥依据HNO2+NaOH===NaNO2+H2O、HCl+NaOH===NaCl+H2O可知,[HNO2]大于[HCl],而溶液中[H+]相同,所以HNO2没有全部电离;⑦加入NaNO2,溶液中[OH-]增大,说明化学平衡移动;⑧不论是强酸;还是弱酸,加水稀释,溶液中[H+]均减小,而[OH-]增大。

判断HA为弱酸的方法
1、取10-a mol/L的HA溶液,测其PH>a , 证明HA为弱酸。
2、取NaA的溶液,测其PH>7 (常温), 证明HA为弱酸。
3、测NaA的溶液中各离子的浓度,若C(Na+) > C(A-) , 证明HA为弱酸。
4、取a mol/LHA溶液与a mol/LnaOH溶液等体积混合,测其PH>7 (常温),
证明HA为弱酸。
5、若已知两相同PH同体积的两瓶酸液,一瓶为强酸,一瓶为弱酸,要判断
哪一瓶为弱酸:
方法一:加等体积的进行稀释,测其PH,PH变化小的为弱酸。
方法二:加水稀释到相同的PH,加水多的为弱酸。
6、若已知PH=a的HA某酸溶液和PH=a的另一某HB酸溶液,且一瓶为强酸,
一瓶为弱酸,如何用简单的方法证明哪一瓶为弱酸:
方法一:在HA溶液中加少量固体NaA ,在HB溶液中加少量固体NaB ,若HA中PH不变,则HA为强酸,而HB中PH变化大,则HB
为弱酸,反之亦然。
方法二、三:同上“4中”的方法。
7、若已知两相同PH同体积的两瓶酸液,一瓶为强酸,一瓶为弱酸,要判断
哪一瓶为弱酸:
(1)分别用同浓度同体积的NaOH溶液中和,耗碱多的为弱酸。
(2)分别与足量的Zn反应,耗Zn多的为弱酸。
(3)分别与足量的Zn反应,产生H2多的为弱酸。
8、已知100ml0.1mol/LHCl溶液和100ml0.1mol/LHA溶液,如何证明HA为
弱酸:
向两酸液中逐渐加入0.01mol的NaOH固体(由少到多),做导电性实验,导电能力不变的是强酸HCl ,导电能力由弱到强的是弱酸HA 。
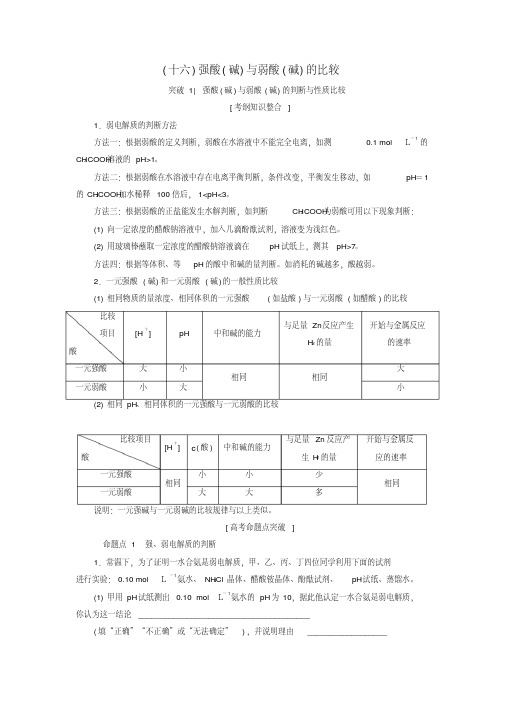
(十六)强酸(碱)与弱酸(碱)的比较突破1| 强酸(碱)与弱酸(碱)的判断与性质比较[考纲知识整合]1.弱电解质的判断方法方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
方法二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释100倍后,1<pH<3。
方法三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可用以下现象判断:(1)向一定浓度的醋酸钠溶液中,加入几滴酚酞试剂,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
方法四:根据等体积、等pH的酸中和碱的量判断。
如消耗的碱越多,酸越弱。
2.一元强酸(碱)和一元弱酸(碱)的一般性质比较(1)相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较比较项目酸[H+] pH 中和碱的能力与足量Zn反应产生H2的量开始与金属反应的速率一元强酸大小相同相同大一元弱酸小大小(2)相同pH、相同体积的一元强酸与一元弱酸的比较比较项目酸[H+] c(酸) 中和碱的能力与足量Zn反应产生H2的量开始与金属反应的速率一元强酸相同小小少相同一元弱酸大大多说明:一元强碱与一元弱碱的比较规律与以上类似。
[高考命题点突破]命题点 1 强、弱电解质的判断1.常温下,为了证明一水合氨是弱电解质,甲、乙、丙、丁四位同学利用下面的试剂进行实验:0.10 mol·L-1氨水、NH4Cl晶体、醋酸铵晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol·L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一结论_______________________________________(填“正确”“不正确”或“无法确定”),并说明理由__________________________________________________________________________________。
2019届高考过关知识点10一元强酸(碱)和一元弱酸(碱)的比较命题点1一元强酸(碱)和一元弱酸(碱)的一般性质比较(1)相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(2)相同pH、相同体积的一元强酸与一元弱酸的比较说明:一元强碱与一元弱碱的比较规律与以上类似。
[对点训练1]相同温度下,关于物质的量浓度、体积均相等的①NaOH溶液,②氨水,说法正确的是()A、[OH-]:①〉②B、pH:①=②C、导电性:①<②D、中和酸的能力:①〉②A[pH:①〉②,导电性:①>②,中和酸的能力:①=②。
][对点训练2] 25 ℃下,在①pH=2的CH3COOH溶液、②pH=2的HCl 溶液、③pH=12的氨水、④pH=12的NaOH溶液中,下列说法正确的是________(填字母)。
A、等体积的①、②分别与足量铝粉反应,生成H2的量:②>①B。
将等体积①②加水稀释至pH=4,加水较多的是②C、若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③D。
将四种溶液分别稀释100倍后,溶液的pH:③〉④>②〉①E、将等体积的③、④加H2O稀释100倍,pH较大的为③F、将等体积的③④加等浓度盐酸中和,所需盐酸的体积相同[答案]CDE[对点训练3]相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是()C[相同体积、相同pH的某一元强酸和一元弱酸中,H+浓度相等,因此刚开始与锌反应的速率是相同的,随着反应的进行,弱酸接着电离,故反应速率较强酸快,排除B、D;又因弱酸的物质的量浓度大于强酸,因此与足量的锌反应生成氢气的量较多,排除A项、]一元弱酸和一元强酸与金属的反应图中,a、b为pH相等的NaOH溶液和氨水,c、d为pH相等的盐酸和醋酸、关于该图像,要深刻理解以下4点:(1)关于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n;关于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n个单位,即pH〈y+n;不管如何稀释,酸溶液的pH不能等于或大于7,只能趋近于7。
证明弱酸的十种方法嘿,朋友们!今天咱们就像福尔摩斯探案一样,来探索证明弱酸的十种超有趣方法。
方法一:pH值不完全“叛逆”。
就像一个有点小脾气但又不敢太放肆的孩子。
如果一种酸,在相同浓度下,它的pH值比强酸要高那么一点点,那它很可能就是弱酸啦。
强酸就像一个火爆脾气的大汉,一下子把氢离子都释放出来,pH值降得很低。
而弱酸呢,扭扭捏捏,氢离子只出来一部分,就像小气鬼只拿出一点糖果,所以pH值没有那么低。
方法二:中和反应“耐力赛”。
想象中和反应是一场长跑比赛。
强酸就像短跑健将,和碱反应那叫一个快,“嗖”的一下就结束了。
而弱酸呢,就像个慢悠悠的小老头,和碱反应的时候,总是不紧不慢的。
因为弱酸不能一次性把氢离子都提供出来,就像小老头不能一下子拿出所有的积蓄,得一点一点来。
方法三:盐溶液的“小脾气”。
弱酸形成的盐溶液可有趣了。
这就好比一个被妈妈管着的孩子,一旦妈妈不在(酸根离子水解的时候),就开始“调皮”了。
弱酸根离子会结合水中的氢离子,让溶液显示碱性,就像孩子偷偷做自己想做的事。
而强酸形成的盐就比较“老实”,溶液基本呈中性。
方法四:稀释的“假把式”。
强酸稀释的时候,pH值那是规规矩矩按照公式来,直线下降。
弱酸可就不一样了,它就像一个爱耍小聪明的魔术师。
稀释的时候,pH值开始上升得很慢,就像魔术师故意放慢动作,因为它还在不断地电离出氢离子,想保持自己的“酸性尊严”。
方法五:导电性的“小秘密”。
如果把溶液的导电性看成是一群小电灯泡亮起来的程度。
强酸溶液就像连接了大电源,灯泡亮得很耀眼,因为它有大量的离子。
弱酸溶液呢,就像连接了一个小电池,灯泡有点昏暗,因为它电离出的离子比较少,就像小电池电量不足一样。
方法六:与金属反应的“小磨蹭”。
强酸和金属反应那是“干柴烈火”,反应速度超快。
弱酸和金属反应就像两个陌生人慢慢熟悉的过程,速度比较慢。
就像一个慢性子的人去交朋友,总是不慌不忙的,因为弱酸电离出氢离子的速度慢,所以和金属的反应也就慢腾腾的。
高中化学题型之酸碱强弱的计算在高中化学学习中,酸碱强弱的计算是一个重要的考点。
正确计算酸碱的强弱,对于理解酸碱反应的性质和进行相关计算非常关键。
本文将通过具体的题目举例,分析酸碱强弱的计算方法和考点,帮助高中学生和他们的父母更好地理解和掌握这一知识点。
一、酸碱强弱的定义和计算方法酸碱的强弱是指酸碱溶液中酸碱质的解离程度的大小。
酸强度和碱强度的大小可以用酸离子和碱离子的浓度来表示。
常用的计算方法包括酸解离常数(Ka)和碱解离常数(Kb)的计算。
1. 酸解离常数(Ka)的计算酸解离常数(Ka)是酸解离平衡常数,用来衡量酸的强弱程度。
对于一元弱酸HA,其酸解离平衡方程可以表示为:HA ⇌ H+ + A-根据酸解离平衡方程,可以得到酸解离常数的计算公式:Ka = [H+][A-]/[HA]举个例子,假设有一个0.1mol/L的乙酸(CH3COOH)溶液,其解离度为α,即CH3COOH ⇌ H+ + CH3COO-,那么乙酸的解离常数Ka可以表示为:Ka =[H+][CH3COO-]/[CH3COOH] = α^2/(1-α)2. 碱解离常数(Kb)的计算碱解离常数(Kb)是碱解离平衡常数,用来衡量碱的强弱程度。
对于一元弱碱B,其碱解离平衡方程可以表示为:B + H2O ⇌ BH+ + OH-根据碱解离平衡方程,可以得到碱解离常数的计算公式:Kb = [BH+][OH-]/[B]举个例子,假设有一个0.1mol/L的氨水(NH3)溶液,其解离度为α,即NH3 + H2O ⇌ NH4+ + OH-,那么氨水的解离常数Kb可以表示为:Kb = [NH4+][OH-]/[NH3] = α^2/(1-α)二、酸碱强弱计算的考点分析在计算酸碱强弱的过程中,需要注意以下几个考点:1. 酸碱解离平衡方程的写法:根据酸碱质的性质,正确写出酸碱解离平衡方程是计算的基础。
2. 解离度(α)的计算:解离度表示酸碱溶液中酸碱质解离的程度,是计算酸碱强弱的关键。